棘突蛋白在冠状病毒跨宿主感染中的作用
王玉燕
复旦大学基础医学院病原生物学系,上海200032
冠状病毒(coronavirus,CoV)为有包膜的正链RNA病毒,其病毒表面棘突(spike)蛋白与宿主细胞受体的特异性结合是冠状病毒侵入宿主细胞的关键, 也决定了病毒感染的组织嗜性和宿主范围[1,2]。在自然演化中,一些冠状病毒毒株由于变异而改变其细胞嗜性及组织易感性,进而获得感染新宿主的能力,即发生跨宿主感染[1,3]。2003年出现的引起人严重急性呼吸综合征的冠状病毒(severe acute respiratory syndrome-CoV,SARS-CoV)被认为是起源于蝙蝠冠状病毒(bat-CoV)并经果子狸传给人[1]。2012年出现的人新型冠状病毒(HCoV-EMC 2012)也被证实与bat-CoV同源性高,且能直接感染蝙蝠细胞[4]。人们已意识到冠状病毒跨种属感染带来的危险性,因此了解冠状病毒的跨宿主感染机制对控制病毒的传播及新型抗病毒药物的开发具有重要意义。本文就棘突蛋白及其受体在冠状病毒跨宿主感染机制中的功能进行简要综述。
1 冠状病毒的种类及其棘突蛋白
冠状病毒属套式病毒目(Nidovirale) 冠状病毒科(Coronaviridae) 冠状病毒亚科(Coronavirinae)。近年来随着新病毒的发现,冠状病毒亚科又被分为α、β、γ、δ 4个属,同属病毒根据基因组及血清学特性分为不同的组(group)[5,6]。冠状病毒的宿主繁多,主要引起呼吸道和肠道疾病,少数能引起神经系统疾病和肝炎或其他系统疾病(表1)。
棘突蛋白位于冠状病毒表面,是典型的Ⅰ型跨膜糖蛋白,由1 160~1 490个氨基酸组成,有21~35个N糖基化位点。成熟的棘突蛋白为稳定的三聚体,组成冠状病毒表面的“冠”[5,7]。棘突蛋白根据构象和功能,分为大小接近的两部分(图1、表1)。N端部分为S1,呈球状结构,含有病毒的受体结合域(receptor binding domain, RBD),参与病毒-宿主细胞的识别与结合,与病毒的细胞嗜性和毒力有关[7]。S2组成棘突蛋白的茎部,主要为螺旋结构,包括1个膜融合肽(fusion peptide, FP)区、2个疏水七肽重复序列(heptad repeat,HR)区、1个跨膜(transmembrane, TM)区和膜内区[7]。冠状病毒的TM区非常保守,将棘突蛋白锚定在膜上。膜内区富含半胱氨酸,其棕榈酰化的程度与病毒复制及细胞病变相关[8]。棘突蛋白与受体结合,在合适的pH或棘突蛋白水解酶作用下,S1被切掉,暴露FP。随后FP插入宿主细胞膜,刺激三聚体HR折叠,变构为六束HR,拉近FP区与TM区的距离,进而发生典型的Ⅰ型跨膜蛋白介导的病毒包膜与细胞膜的融合[7,9]。S2同时也参与病毒的组装和释放[10]。
棘突蛋白与病毒的毒力、感染的组织嗜性及感染宿主细胞识别相关[1,5,7]。鼠肝炎病毒(mouse hepatitis virus, MHV)可造成小鼠多脏器损伤,但不同分离株对不同的组织易感性有差异。如MHV-JHM导致严重脑炎,只有很弱的嗜肝性;MHV-A59导致小鼠肝炎和温和型脑炎;只有MHV-2表现非常强的嗜肝性,导致严重肝炎。MHV对不同组织的易感染性与其棘突蛋白的差异有关[11]。此外,通过RNA定向重组技术,可将MHV的棘突蛋白膜外区与猫传染性腹膜炎冠状病毒(feline infectious peritonitis virus,FIPV)互换,得到的重组病毒均获得新的细胞嗜性[2,12]。研究证实,仅棘突蛋白改变即可导致病毒跨宿主感染。因此,了解冠状病毒的跨宿主感染需对棘突蛋白的结构和相关功能进行深度解析。
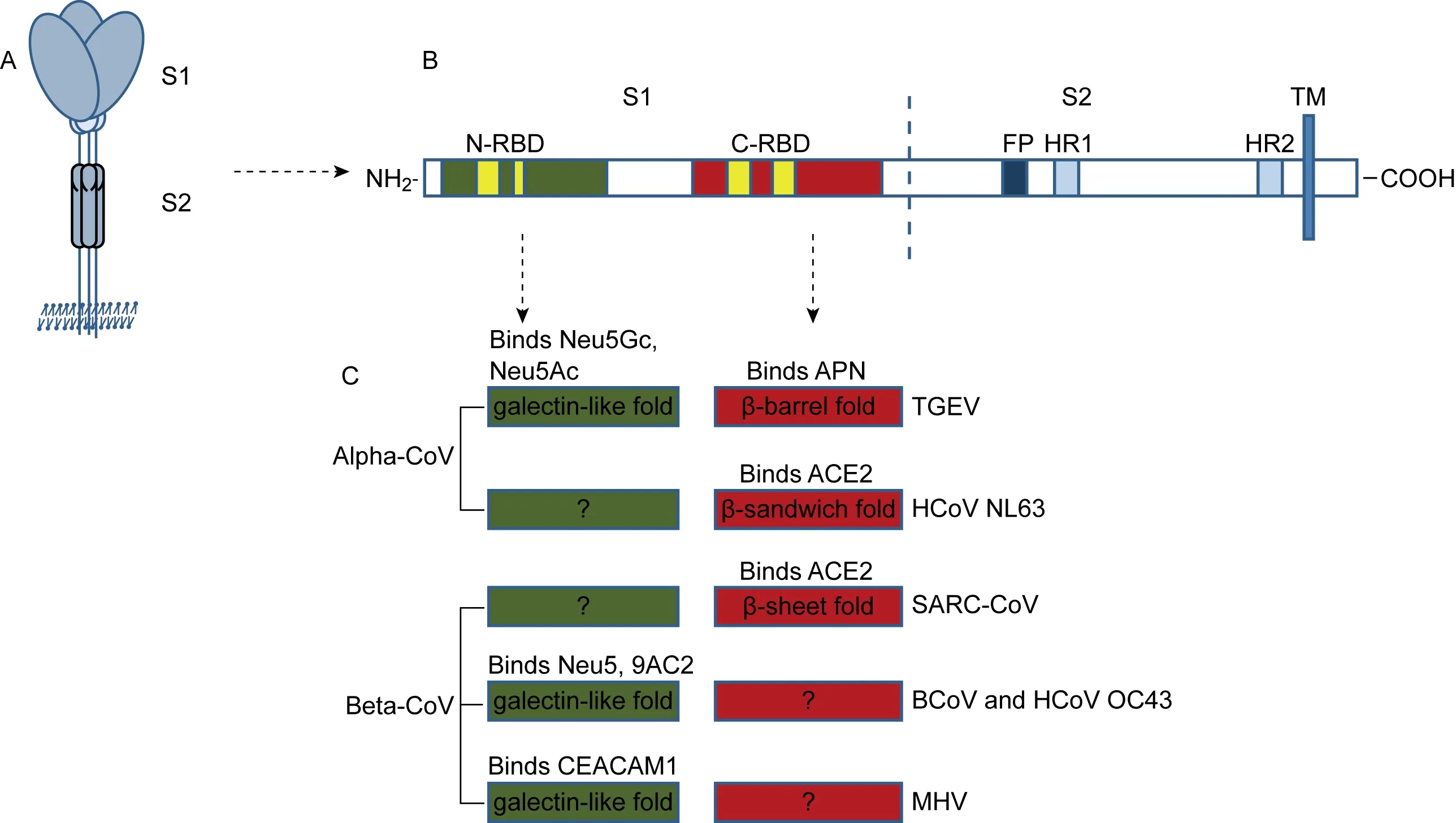
A: The spike protein assembles into trimmers on the virion surface. B: The single spike protein is depicted as follows: N-terminal receptor binding domain (N-RBD) in green; C-RBD in red with receptor binding motif in yellow; fusion peptide (FP); heptad repeat (HR) regions and transmembrane (TM). C: The structures of RBD and related receptors of coronaviruses.
图1冠状病毒棘突蛋白及其功能结构域示意图
Fig.1Diagramoffunctionaldomainsofcoronavirusspikeprotein
表1冠状病毒棘突蛋白及受体相关分子
Tab.1Spikeproteinandreceptormoleculesofcoronaviruses

CoronavirinaeGenusGroupSpeciesTropism or pathogenesisHostInfected tissues or induceddiseases*Spike protein and RBDSize(residues)N-terminusC-terminusCellular moleculesReceptorCo-receptor orother moleculesReferencesAlpha-abCCoVDogE1 453/526-678APNSialic acid28, 54TGEVPigE/R1 14832-258506-665APNSialic acid(Neu5Gc, Neu5Ac)13, 14, 25, 28, 57FCoVCatE/R/O1 455/506-678APNDC-SIGN, heparan28, 38, 42 HCoV-229EHumanR1 173/407-547APN/28, 58HCoV-NL63HumanR1 356/301-701ACE2/1, 58Beta-abcdHCoV-OC43HumanR1 36115-298/Neu5,9Ac2Heparan13, 42BCoVCattleE/R1 36315-298/Neu5,9Ac2/13, 16, 17MHV MouseR/E/H/N/O1 3241-220325-629CEACAM1,2Sialic acid1, 13, 58SARS-CoVHumanR/E/318-510ACE2DC-SIGN, DC-SIGNR, LSECtin1, 37, 58Bat-CoV HKU4Bat/1 352/383-496//Bat-CoV HKU9Bat/1 274/368-549/Gamma-abIBVAvian R/E/O1 162///Heparan sulfate, sialic acid, DC-SIGN/L-SIGN1, 5, 13, 39SW1Whale/1 472////6Delta- BuCoV HKU11Bulbuls/1 165//6
*R, respiratory system; E, intestines; H, hepatitis; N, nervous system; O, others (including infectious peritonitis, immunologic derangement, acute pancreatitis, nephritis, etc.).
2 冠状病毒棘突蛋白RBD结构与受体结合的功能
冠状病毒至少有2类RBD,均位于S1(图1B)[7]。N端RBD (N-RBD)具有糖类受体和蛋白受体双重识别活性,如MHV的N-RBD识别蛋白受体为鼠癌胚抗原相关黏附分子1(carcinoembryonic antigen-related adhesion molecule l, CEACAM1),而人冠状病毒(human CoV-OC43,HCoV-OC43)、牛冠状病毒(bovine CoV,BCoV) 和猪传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV)的N-RBD则与唾液酸类受体结合[7,13]。以氨肽酶N(aminopeptidase N,APN)为受体的α属冠状病毒及SARS-CoV的RBD位于C端 (C-RBD)[6,7]。有些病毒可能同时有2个以上RBD,如TGEV的C-RBD(506~665位氨基酸)识别APN,其N-RBD(32~258位氨基酸)识别唾液酸[7,14]。进一步研究发现,TGEV与唾液酸结合的血凝素活性区域位于棘突蛋白145~155位氨基酸,该区域内氨基酸突变或缺失会导致TGEV失去肠道嗜性[15]。非单一的受体和受体识别位点使病毒与宿主的识别不再受限于单一受体,病毒可能具有更广泛的组织嗜性和宿主范围。
对N-RBD的高级结构进行解析发现,BCoV的N-RBD核心结构与MHV的类似,主要由1个六股β片层和1个七股β片层组成,具有半乳糖结合凝集素(galactose-binding lectin)样活性[16]。BCoV的N-RBD对多种乙酰化唾液酸具有亲和性,已证实其受体为唾液酸类分子Neu5,9Ac2 (5-N-acetyl-9-O-acetylneuraminic acid)[16,17]。MHV由于缺少1个肽环而不能与唾液酸类分子结合,但与CEACAM具有高度亲和性[16]。同样在TGEV、HCoV-OC43及禽传染性支气管炎病毒(infectious bronchitis virus,IBV)棘突蛋白的N端也具有与唾液酸分子结合的活性,可能也具有类似的半乳糖结合凝集素样结构[7,14,18]。该半乳糖结合凝集素样结构与人半乳糖结合凝集素结构类似,推测可能是冠状病毒与流行性感冒病毒(简称流感病毒)类似,在进化中从宿主获得半乳糖结合凝集素样结合域,进而演化成某些冠状病毒的RBD[16]。MHV在随后演化中又获得识别蛋白受体的能力,与CEACAM1a的亲和性更高,不再依赖于唾液酸类糖类受体[19]。而起源于TGEV的猪呼吸道冠状病毒(porcine respiratory coronavirus, PRCV)仅能感染肺上皮细胞[14],而TGEV能同时感染肠道上皮细胞和肺上皮细胞。两者主要差异仅在于PRCV在棘突蛋白的N端有672或681个碱基缺失,而该区域正好是TGEV参与唾液酸结合的N-RBD[13]。PRCV仅依赖蛋白受体APN也能感染宿主细胞。这些发现表明,病毒的RBD一直处于变异中,这在解释病毒受体转换及宿主转换中具有重要意义。
多数α属冠状病毒受体APN和一些β属冠状病毒受体血管紧张素转换酶2 (angiotensin-converting enzyme 2, ACE2)的结合域为S1的C-RBD[7]。Li的团队对β属冠状病毒的C-RBD高级结构进行了系统研究和解析,发现同样以ACE2为受体,SARS-CoV与NL63的C-RBD高级结构并不相同。NL63的RBD为六股β三明治折叠,而 SARS-CoV的RBD结构域为五股β片层折叠[20]。对SARS-CoV与果子狸中分离的冠状病毒RBD进行比较分析,发现两者只有6个氨基酸的差异(图1)[1, 21],其中4个处于受体结合基序(receptor-binding motif,RBM)。RBD与受体的识别需有合适的作用面,而这4个变异氨基酸中有3个处在受体-棘突蛋白的作用面上[22]。SARS-CoV的RBD与ACE2之间能形成合适的作用面正是SARS-CoV实现种间传播所要克服的一个重要障碍[23]。通过研究不同位点氨基酸突变对RBD与受体亲和性的影响,发现SARS-CoV的棘突蛋白上2个位点氨基酸(479和487)的变异决定了病毒RBD与人的ACE2亲和性最高,而与果子狸ACE2的亲和性很低[21,24]。这2个位点氨基酸的改变可能正是SARS-CoV实现从动物到人跨宿主感染的关键。Reguera等对TEGV和PRCV的C-RBD结构进行研究,发现该区域在高级结构上由2个β片层构成桶状结构,β转角构成桶的边缘,是APN与中和性抗体的结合位点[25]。
3 冠状病毒受体识别的变异性
通常冠状病毒对其天然宿主的受体亲和性最高,所以感染宿主有明显的种属特异性[5]。α属冠状病毒除HCoV NL63外,几乎都以APN作为受体;而β属冠状病毒的受体种类则多样化,MHV的受体为CEACAM,SARS-CoV的受体是ACE2,HCoV-OC43和BCoV的受体是Neu5,9Ac2;而以IBV为代表的γ属冠状病毒的受体至今没有定论[1,5]。
受体在某些组织的特异性表达也限制了病毒的细胞感染范围。如α属冠状病毒不能感染不表达APN的细胞,但某些细胞在人工转染、诱导表达APN后则可能被冠状病毒感染[26]。TGEV、HCoV-229E、2型猫冠状病毒(feline coronavirus, FCoV)和犬冠状病毒(canine coronavirus, CCoV)具有共同的祖先,棘突蛋白的同源性很高,均能识别猫APN,但它们的宿主细胞嗜性并不完全相同[27,28]。这种嗜性的差别与APN上小范围内种属特异性相关氨基酸有关,尤其是识别位点的氨基酸N-糖基化修饰。如人APN由于缺乏1个N-糖基化修饰的天冬酰胺,仅能被HCoV-229E RBD上特异性位点识别[28]。同时,受体与RBD的亲和力也影响结合后受体介导的膜融合等入侵过程[21]。对SARS-CoV与果子狸及蝙蝠中分离的类冠状病毒进行比较,发现bat-CoV与人ACE2的亲和力很低,不能介导病毒入侵[21]。
同源性较高的病毒具有相似的RBD结构,也具有相似的受体识别特性,可能表现为受体共享,并感染相应的多种宿主动物。α属的TGEV、FCoV和CCoV棘突蛋白同源性较高,RBD高级结构相似,均可识别猪、猫和犬APN上某些保守区域的糖基化位点[28]。受体共享使病毒表现出对多种宿主来源细胞的易感性,如TGEV可在犬或猫源细胞中增殖[29]。CCoV能感染猫、猪等动物,犬群中也有TGEV的隐性流行[30,31]。这种受体共享和棘突蛋白的跨宿主受体结合能力,可能使冠状病毒在演化中更易突破宿主的种属障碍。
4 冠状病毒棘突蛋白非RBD区域及其他细胞表面分子的宿主识别作用
MHV研究结果显示,FP区上的1个氨基酸突变能破坏RBD的中和抗体表位[32],证明虽然在一级结构上RBD与FP区距离很远,但在高级结构上两者可能紧密相连。某些发生在RBD附近或S2区域的突变,虽不会影响棘突蛋白与受体的亲和力,但会影响病毒对细胞的感染能力[33]。最近研究证明,S2中的一些氨基酸突变也可能是病毒宿主范围发生改变的原因[34]。FCoV经肠道感染后,可发生持续感染,病毒可能在宿主体内转变成毒力更强的FIPV。导致病毒由肠道上皮嗜性变成巨噬细胞嗜性的本质是S2区域内10个氨基酸的突变[35]。因此,研究冠状病毒的跨宿主感染不仅要考虑RBD,还要关注S2区域变异对受体识别及病毒入侵的影响。这些变异可能主要影响病毒与辅助受体或其他细胞表面分子的相互作用。
一些细胞表面分子在病毒与宿主识别过程中起辅助受体或替代受体的作用(表1)。由于树突细胞特异性细胞间黏附分子3-结合非整合素因子(dendritic cell-specific intercellular adhesion molecule-3-grabbing nonintegrin,DC-SIGN)和(或)肝/淋巴结特异性细胞间黏附分子3-结合非整合素因子(liver/lymph node-specific intercellular adhesion molecule-3-grabbing nonintegrin,L-SIGN)的存在,SARC-CoV、HCoV 229E、FIPV和IBV等病毒可不再依赖受体感染一些非容纳细胞,或提高病毒对某些非敏感细胞的感染能力[5,36-39]。定点突变研究发现,冠状病毒的这种识别特性与棘突蛋白上多个位点的天冬酰胺糖基化有关[37]。DC-SIGN具有钙依赖的凝集素活性,主要表达在巨噬细胞和树突细胞表面,能识别糖基化的氨基酸[5],这可能是SARC-CoV、FIPV和IBV等具有感染巨噬细胞能力的病毒能导致宿主较严重多系统脏器病变的原因之一。
S2区发生变异的MHV能通过硫酸乙酰肝素(heparan sulfate)介导侵入细胞,使感染不再局限于表达CEACAM的细胞,有利于病毒向其他组织或宿主扩散[40,41]。血清Ⅰ型FIPV的某些毒株感染也不依赖于APN识别,而是借助硫酸乙酰肝素感染相应细胞[42]。硫酸乙酰肝素在多种动物细胞表面广泛表达,可在多种病毒(如甲病毒、疱疹病毒、黄病毒和反转录病毒)与宿主细胞的识别过程中发挥作用[43]。在持续感染的宿主体内,即使在受体低表达的情况下,冠状病毒也可能借助硫酸乙酰肝素而感染细胞,进而跨宿主种属感染[40]。
另外,TGEV能借助唾液酸与肠道上皮细胞的黏液样糖蛋白(mucin-like glycoprotein, MGP)结合,逃避肠道对病毒的清除作用,MGP可能是TGEV主要表现为肠道致病性的原因之一[44]。已发现的辅助受体或参与识别的分子多为糖类或具有结合病毒蛋白上糖基化位点能力的蛋白分子,组织特异性或宿主特异性不强,且通常与棘突蛋白RBD外的区域作用。病毒在进化过程中获得识别辅助受体或替代受体的能力,使易感细胞或组织范围扩大,这或许是病毒获得跨宿主感染能力的原因之一。
5 棘突蛋白变异与病毒跨宿主感染
5.1 基因点突变
冠状病毒是最大的RNA病毒,其庞大的基因组由病毒编码的聚合酶复合体复制。冠状病毒RNA的复制频率很高,其RNA聚合酶与其他RNA聚合酶类似[45]。体外实验证明,SARS-CoV在一轮基因组复制过程中每个碱基出现突变的概率约为10-6 [45]。病毒的高复制率和高突变率有利于病毒适应环境的选择压力和逃避宿主的免疫清除[6]。突变产生和积累尤其是棘突蛋白某些位点的突变可能导致病毒识别受体改变,从而产生跨宿主感染。如MHV在容纳与非容纳细胞之间的交替感染或持续性感染导致棘突蛋白某些位点突变,使MHV能利用硫酸乙酰肝素或改变其识别的受体[33,41]。Bat-CoV和SARS-CoV在棘突蛋白RBD区域的点突变决定了两者识别受体的宿主差异性[1, 24]。SARS-CoV由动物向人的跨越应包含大量类似突变的长期积累[6,46]。
5.2 基因重组
冠状病毒的复制酶复合物在复制时可能会产生模板链的转移,或在不同模板链之间跳跃[45]。由于冠状病毒的基因组采用独特的套式转录方式,病毒在复制过程中会产生一系列亚基因组mRNA (subgenomic mRNA)[45],而冠状病毒增殖过程中的任意mRNA都可能作为RNA的模板链。因此,在病毒复制过程中,常发生基因组或亚基因组之间的重组或基因转移,极大增加了病毒RNA重组的概率[47]。MHV在组织感染中的同源重组率可达25%[47]。有研究认为,β属冠状病毒中存在共同的复制信号,其同源重组信号与复制起始信号相似,或与先导序列相似,或模拟病毒RNA聚合酶的结合位点[48,49]。α属冠状病毒的同源重组可能采用了与β属冠状病毒相似的重组机制和信号,不同种属病毒间存在同源重组的潜力[50]。如FCoV79-1683、FCoV79-1146可能来自Ⅰ型FCoV与CCoV的两次基因重组[51]。SARS-CoV基因组同时存在α、β和γ属冠状病毒重组的痕迹[52]。因此,基因重组是冠状病毒变异的主要方式。
如果重组发生在棘突蛋白基因,且恰好包含RBD的改变或重组,可能导致重组病毒细胞识别特性的改变,进而造成跨宿主感染。α属冠状病毒的棘突蛋白基因存在不同来源病毒RNA同源重组的痕迹,且具有与β属病毒相似的重组特征序列,尤其是S1基因425核苷酸位点附近以及1 723~2 425核苷酸区域两端可能是基因重组的“热点”区域[50]。在这2个重组“热点”区域,CCoV、TGEV、FCoV的棘突蛋白基因间存在碱基缺失或置换[50],2个区域均恰好与病毒可能的受体识别、毒力及细胞嗜性相关区重叠。如CCoV UCD1分离株能感染猪ST细胞,而其他CCoV毒株却不能。分析发现其棘突蛋白的N端第1~273位氨基酸与TGEV高度同源,其他区域与TGEV的同源性低于FCoV,该区域恰好包含TGEV的N-RBD。推测该毒株可能是CCoV与TGEV基因重组的产物[53]。CCoV-A76 表现出与其他CCoV毒株不同的细胞嗜性,可能与其S1的N端与C端之间发生过Ⅰ和Ⅱ型CCoV重组有关[54]。Wang 等在鸡群中分离到IBV PP14株,分析发现其S1基因的5′端存在IBV Mass41与ArK99株的同源重组,该区域的重组可能影响病毒S1的构象表位,导致病毒毒力改变[55,56]。
由于自然界中冠状病毒感染非常普遍,自然宿主分布广泛,且感染通常呈隐性,一般不引起严重疾病。感染宿主后,病毒可在体内持续感染,宿主表现为长期带毒[1,30]。因此,在感染动物体内冠状病毒的基因组会持续复制、突变、重组,不断变异,导致存在很多病毒准种[45]。携带病毒的宿主,通过自然或人为的接触,发生不同宿主来源的病毒共感染,并可能在共感染宿主体内发生不同病毒间的重组。由于不同属冠状病毒在复制时采用相似的识别先导序列,具有共同的重组信号序列特征[49,50],彼此间更易发生重组,产生新变异株。重组变异的累积为产生跨宿主感染新毒株提供可能。如SARS-CoV可能正是突变、基因重组累积的结果,在SARS-CoV基因组ORF1ab和棘突蛋白基因上有7处可能发生过同源重组[52]。近年来,欧洲的流行病学调查显示,在犬群中有猪冠状病毒流行,且已产生两者的重组毒株[31]。因此,冠状病毒在宿主体内的持续感染及不同宿主来源病毒的共感染为病毒的基因重组提供了环境,为跨宿主感染提供了机会。某些跨宿主感染毒株的出现正是病毒基因突变、重组等变异积累及环境选择的结果。
6 结语
综上所述,冠状病毒跨宿主感染的关键是棘突蛋白基因通过突变或重组等机制,使RBD某些位点或结构发生变异,导致识别受体改变和感染宿主改变,从而实现跨宿主感染。而棘突蛋白上除RBD外的区域也可能与细胞表面其他辅助蛋白受体或糖类分子结合,导致病毒感染细胞范围扩大,拓宽病毒的组织嗜性或宿主范围。因此,棘突蛋白变异和相应受体分子的识别是冠状病毒实现跨宿主感染的关键。虽然对冠状病毒的跨宿主感染现象及跨宿主感染机制有了一定认识,但还有很多问题有待进一步研究和探讨。其他结构和非结构蛋白在跨宿主感染中的作用亦不明确。冠状病毒在复制过程中存在重组,但具体模板转换机制还不清楚,仅存在一些假说,现有证据还不能完整系统地解释病毒基因重组机制。现实中,不断出现的新毒力或宿主感染能力改变的冠状病毒变异株给病毒防治、药物研发等带来新的挑战。相信随着研究的深入及技术的进步,人们对冠状病毒跨宿主感染的机制将会有更进一步的认识。
致谢:复旦大学基础医学院病原生物学系叶荣博士对本文的组织与文字修改,吕钧和刘红对资料收集整理提供了诸多帮助,在此一并致谢!
[1] Graham RL, Baric RS. Recombination, reservoirs, and the modular spike: mechanisms of coronavirus cross-species transmission [J]. J Virol, 2010, 84(7): 3134-3146.
[2] Kuo L, Godeke GJ, Raamsman MJ, Masters PS, Rottier PJ. Retargeting of coronavirus by substitution of the spike glycoprotein ectodomain: crossing the host cell species barrier [J]. J Virol, 2000, 74(3): 1393-1406.
[3] Woo PC, Lau SK, Lam CS, Lau CC, Tsang AK, Lau JH, Bai R, Teng JL, Tsang CC, Wang M, Zheng BJ, Chan KH, Yuen KY. Discovery of seven novel mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and deltacoronavirus [J]. J Virol, 2012, 86(7): 3995-4008.
[4] Perlman S, Zhao J. Human coronavirus EMC is not the same as severe acute respiratory syndrome coronavirus [J]. MBio, 2013, 4(1): e00002- e00013.
[5] Belouzard S, Millet JK, Licitra BN, Whittaker GR. Mechanisms of coronavirus cell entry mediated by the viral spike protein [J]. Viruses, 2012, 4(6): 1011-1033.
[6] Woo PC, Lau SK, Huang Y, Yuen KY. Coronavirus diversity, phylogeny and interspecies jumping [J]. Exp Biol Med (Maywood), 2009, 234(10): 1117-1127.
[7] Heald-Sargent T, Gallagher T. Ready, set, fuse! The coronavirus spike protein and acquisition of fusion competence [J]. Viruses, 2012, 4(4): 557-580.
[8] Yang J, Lv J, Wang Y, Gao S, Yao Q, Qu D, Ye R. Replication of murine coronavirus requires multiple cysteines in the endodomain of spike protein [J]. Virology, 2012, 427(2):98-106.
[9] Bosch BJ, van der Zee R, de Haan CA, Rottier PJ. The coronavirus spike protein is a class I virus fusion protein: structural and functional characterization of the fusion core complex [J]. J Virol, 2003, 77(16): 8801-8811.
[10] Enjuanes L, Almazán F, Sola I, Zúiga S, Alvarez E, Reguera J, Capiscol C. Biochemical aspects of coronavirus replication [J]. Adv Exp Med Biol, 2006, 581:13-24.
[11] Navas S, Seo SH, Chua MM, Das Sarma J, Lavi E, Hingley ST, Weiss SR. Murine coronavirus spike protein determines the ability of the virus to replicate in the liver and cause hepatitis [J]. J Virol, 2001, 75(5): 2452-2457.
[12] Haijema BJ, Volders H, Rottier PJ. Switching species tropism: an effective way to manipulate the feline coronavirus genome [J]. J Virol, 2003, 77(8):4528-4538.
[13] Schwegmann-Wessels C, Herrler G. Sialic acids as receptor determinants for coronaviruses [J]. Glycoconj J, 2006, 23(1-2): 51-58.
[14] Wesley RD, Woods RD, Cheung AK. Genetic analysis of porcine respiratory coronavirus, an attenuated variant of transmissible gastroenteritis virus [J]. J Virol, 1991, 65(6): 3369-3373.
[15] Krempl C, Schultze B, Laude H, Herrler G. Point mutations in the S protein connect the sialic acid binding activity with the enteropathogenicity of transmissible gastroenteritis coronavirus [J]. J Virol, 1997, 71(4): 3285-3287.
[16] Peng G, Xu L, Lin YL, Chen L, Pasquarella JR, Holmes KV, Li F. Crystal structure of bovine coronavirus spike protein lectin domain [J]. J Biol Chem, 2012, 287(50): 41931-41938.
[17] Schultze B, Gross HJ, Brossmer R, Herrler G. The S protein of bovine coronavirus is a hemagglutinin recognizing 9-O-acetylated sialic acid as a receptor determinant [J]. J Virol, 1991, 65 (11): 6232-6237.
[18] Abd El Rahman S, El-Kenawy AA, Neumann U, Herrler G, Winter C. Comparative analysis of the sialic acid binding activity and the tropism for the respiratory epithelium of four different strains of avian infectious bronchitis virus [J]. Avian Pathol, 2009, 38(1): 41-45.
[19] Peng G, Sun D, Rajashankar KR, Qian Z, Holmes KV, Li F. Crystal structure of mouse coronavirus receptor-binding domain complexed with its murine receptor [J]. Proc Natl Acad Sci USA, 2011, 108(26): 10696-10701.
[20] Wu K, Peng G, Wilken M, Geraghty RJ, Li F. Mechanisms of host receptor adaptation by severe acute respiratory syndrome coronavirus [J]. J Biol Chem, 2012, 287(12): 8904-8911.
[21] Liu L, Fang Q, Deng F, Wang H, Yi CE, Ba L, Yu W, Lin RD, Li T, Hu Z, Ho DD, Zhang L, Chen Z. Natural mutations in the receptor binding domain of spike glycoprotein determine the reactivity of cross-neutralization between palm civet coronavirus and severe acute respiratory syndrome coronavirus [J]. J Virol, 2007, 81 (9):4694-4700.
[22] Li F, Li W, Farzan M, Harrison SC. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor [J]. Science, 2005, 309(5742): 1864-1868.
[23] Ren W, Qu X, Li W, Han Z, Yu M, Zhou P, Zhang SY, Wang LF, Deng H, Shi Z. Difference in receptor usage between severe acute respiratory syndrome (SARS) coronavirus and SARS-like coronavirus of bat origin [J]. J Virol, 2008, 82(4): 1899-1907.
[24] Qu XX, Hao P, Song XJ, Jiang SM, Liu YX, Wang PG, Rao X, Song HD, Wang SY, Zuo Y, Zheng AH, Luo M, Wang HL, Deng F, Wang HZ, Hu ZH, Ding MX, Zhao GP, Deng HK. Identification of two critical amino acid residues of the severe acute respiratory syndrome coronavirus spike protein for its variation in zoonotic tropism transition via a double substitution strategy [J]. J Biol Chem, 2005, 280(33): 29588-29595.
[25] Reguera J, Santiago C, Mudgal G, Ordoo D, Enjuanes L, Casasnovas JM. Structural bases of coronavirus attachment to host aminopeptidase N and its inhibition by neutralizing antibodies [J]. PLoS Pathog, 2012, 8(8):e1002859.
[26] Benbacer L, Kut E, Besnardeau L, Laude H, Delmas B. Interspecies aminopeptidase-N chimeras reveal species-specific receptor recognition by canine coronavirus, feline infectious peritonitis virus, and transmissible gastroenteritis virus [J]. J Virol, 1997, 71(1): 734-737.
[27] Weiss SR, Navas-Martin S. Coronavirus pathogenesis and the emerging pathogen severe acute respiratory syndrome coronavirus [J]. Microbiol Mol Biol Rev, 2005, 69 (4): 635-664.
[28] Tusell SM, Schittone SA, Holmes KV. Mutational analysis of aminopeptidase N, a receptor for several group 1 coronaviruses, identifies key determinants of viral host range [J]. J Virol, 2007, 81(3): 1261-1273.
[29] 王玉燕,吕钧,刘红,叶荣. 甲型冠状病毒属三个病毒株对不同宿主来源细胞的感染性比较[J/OL]. http://www.paper.edu.cn/releasepaper/content/201301-1114.html.
[30] Wang Y, Ma GG, Lu CP, Wen H. Detection of canine coronaviruses genotype I and II in raised Canidae animals in China [J]. Berl Munch Tierarztl Wochenschr, 2006, 119(1-2): 35-39.
[31] Decaro N, Mari V, Elia G, Addie DD, Camero M, Lucente MS, Martella V, Buonavoglia C. Recombinant canine coronaviruses in dogs, Europe [J]. Emerg Infect Dis, 2010, 16(1): 41-47.
[32] Grosse B, Siddell SG. Single amino acid changes in the S2 subunit of the MHV surface glycoprotein confer resistance to neutralization by S1 subunit-specific monoclonal antibody [J]. Virology, 1994, 202(2): 814-824.
[33] Krueger DK, Kelly SM, Lewicki DN, Ruffolo R, Gallagher TM. Variations in disparate regions of the murine coronavirus spike protein impact the initiation of membrane fusion [J]. J Virol, 2001, 75(6): 2792-2802.
[34] McRoy WC, Baric RS. Amino acid substitutions in the S2 subunit of mouse hepatitis virus variant V51 encode determinants of host range expansion [J]. J Virol, 2008, 82(3): 1414-1424.
[35] Rottier PJ, Nakamura K, Schellen P, Volders H, Haijema BJ. Acquisition of macrophage tropism during the pathogenesis of feline infectious peritonitis is determined by mutations in the feline coronavirus spike protein [J]. J Virol, 2005, 79(22):14122-14130.
[36] Jeffers SA, Tusell SM, Gillim-Ross L, Hemmila EM, Achenbach JE, Babcock GJ, Thomas WD Jr, Thackray LB, Young MD, Mason RJ, Ambrosino DM, Wentworth DE, Demartini JC, Holmes KV. CD209L (L-SIGN) is a receptor for severe acute respiratory syndrome coronavirus [J]. Proc Natl Acad Sci USA, 2004, 101(44): 15748-15753.
[37] Han DP, Lohani M, Cho MW. Specific asparagine-linked glycosylation sites are critical for DC-SIGN- and L-SIGN-mediated severe acute respiratory syndrome coronavirus entry [J]. J Virol, 2007, 81 (21):12029-12039.
[38] Regan AD, Ousterout DG, Whittaker GR. Feline lectin activity is critical for the cellular entry of feline infectious peritonitis virus [J]. J Virol, 2010, 84 (15):7917-7921.
[39] Zhang Y, Buckles E, Whittaker GR. Expression of the C-type lectins DC-SIGN or L-SIGN alters host cell susceptibility for the avian coronavirus, infectious bronchitis virus [J]. Vet Microbiol, 2012, 157 (3-4):285-293.
[40] de Haan CA, Li Z, te Lintelo E, Bosch BJ, Haijema BJ, Rottier PJ. Murine coronavirus with an extended host range uses heparan sulfate as an entry receptor [J]. J Virol, 2005, 79(22): 14451-14456.
[41] Baric RS, Sullivan E, Hensley L, Yount B, Chen W. Persistent infection promotes cross-species transmissibility of mouse hepatitis virus [J]. J Virol, 1999, 73(1): 638-649.
[42] de Haan CA, Haijema BJ, Schellen P, Wichgers Schreur P, te Lintelo E, Vennema H, Rottier PJ. Cleavage of group 1 coronavirus spike proteins: how furin cleavage is traded off against heparan sulfate binding upon cell culture adaptation [J]. J Virol, 2008, 82(12): 6078-6083.
[43] Liu J, Thorp SC. Cell surface heparan sulfate and its roles in assisting viral infections [J]. Med Res Rev, 2002, 22 (1):1-25.
[44] Krempl C, Ballesteros ML, Zimmer G, Enjuanes L, Klenk HD, Herrler G. Characterization of the sialic acid binding activity of transmissible gastroenteritis coronavirus by analysis of haemagglutination-deficient mutants [J]. J Gen Virol, 2000, 81 (Pt 2): 489-496.
[45] Vega VB, Ruan Y, Liu J, Lee WH, Wei CL, Se-Thoe SY, Tang KF, Zhang T, Kolatkar PR, Ooi EE, Ling AE, Stanton LW, Long PM, Liu ET. Mutational dynamics of the SARS coronavirus in cell culture and human populations isolated in 2003 [J]. BMC Infect Dis, 2004, 4: 32.
[46] Li W, Shi Z, Yu M, Ren W, Smith C, Epstein JH, Wang H, Crameri G, Hu Z, Zhang H, Zhang J, McEachern J, Field H, Daszak P, Eaton BT, Zhang S, Wang LF. Bats are natural reservoirs of SARS-like coronaviruses [J]. Science, 2005, 310(5748):676-679.
[47] Liao C L, Lai MM. RNA recombination in a coronavirus: recombination between viral genomic RNA and transfected RNA fragments [J]. J Virol, 1992, 66(10): 6117-6124.
[48] Lee C W, Jackwood MW. Evidence of genetic diversity generated by recombination among avian coronavirus IBV [J]. Arch Virol, 2000, 145(10): 2135-2148.
[49] Wu HY, Guy JS, Yoo D, Vlasak R, Urbach E, Brian DA. Common RNA replication signals exist among group 2 coronaviruses: evidence for in vivo recombination between animal and human coronavirus molecules [J]. Virology, 2003, 315(1): 174-183.
[50] Wang YY, Lu CP. Analysis of putative recombination hot sites in the S gene of canine coronaviruses [J]. Acta Virol, 2009, 53(2):111-120.
[51] Herrewegh AA, Smeenk I, Horzinek MC, Rottier PJ, de Groot RJ. Feline coronavirus type II strains 79-1683 and 79-1146 originate from a double recombination between feline coronavirus type I and canine coronavirus [J]. J Virol, 1998, 72(5): 4508-4514.
[52] Zhang XW, Yap YL, Danchin A. Testing the hypothesis of a recombinant origin of the SARS-associated coronavirus [J]. Arch Virol, 2005, 150 (1):1-20.
[53] Wesley RD. The S gene of canine coronavirus, strain UCD-1, is more closely related to the S gene of transmissible gastroenteritis virus than to that of feline infectious peritonitis virus [J]. Virus Res, 1999, 61(2): 145-152.
[54] Regan AD, Millet JK, Tse LP, Chillag Z, Rinaldi VD, Licitra BN, Dubovi EJ, Town CD, Whittaker GR. Characterization of a recombinant canine coronavirus with a distinct receptor-binding (S1) domain [J]. Virology, 2012, 430(2): 90-99.
[55] Wang L, Junker D, Collisson EW. Evidence of natural recombination within the S1 gene of infectious bronchitis virus [J]. Virology, 1993, 192(2): 710-716.
[56] Jia W, Wang X, Parrish CR, Naqi SA. Analysis of the serotype-specific epitopes of avian infectious bronchitis virus strains Ark99 and Mass41 [J]. J Virol, 1996, 70(10): 7255-7259.
[57] Schwegmann-Wessels C, Bauer S, Winter C, Enjuanes L, Laude H, Herrler G. The sialic acid binding activity of the S protein facilitates infection by porcine transmissible gastroenteritis coronavirus [J]. Virol J, 2011, 8: 435.
[58] Li W, Wong SK, Li F, Kuhn JH, Huang IC, Choe H, Farzan M. Animal origins of the severe acute respiratory syndrome coronavirus: insight from ACE2-S-protein interactions [J]. J Virol, 2006, 80(9): 4211-4219.
——壮肾

