自然发酵辣椒酱中乳酸菌的分离与鉴定
沙 漠 逄焕明 古丽娜孜 李 静 殷 勇 杨海燕
(新疆农业大学食品科学学院,新疆 乌鲁木齐 830052)
自然发酵辣椒酱中乳酸菌的分离与鉴定
沙 漠 逄焕明 古丽娜孜 李 静 殷 勇 杨海燕
(新疆农业大学食品科学学院,新疆 乌鲁木齐 830052)
从自然发酵的辣椒酱中分离出产酸量高、生长良好的菌株,经过形态学鉴定、生理生化特性及发酵性能试验,最终选定Lact.1和Lact.2两株适用于发酵辣椒试验的乳酸菌。鉴定结果表明Lact.1为植物乳酸杆菌 (Lactobacillus planetarium),Lact.2 为 肠 膜 明 串 珠 菌 (Leuconostoc mesenteroides)。试验结果表明两株乳酸菌产酸速度快,最适生长温度在30℃到40℃之间,最适生长p H 6.0,当食盐浓度在7%以下能生长。
发酵辣椒;乳酸菌;分离鉴定
目前,市面销售的辣椒制品主要有辣椒酱、辣椒粉及干辣椒等传统粗加工制品方面,而发酵型辣椒酱在销售中又占有相对较大的比重[1]。传统发酵辣椒酱生产,主要利用辣椒酱中存在的天然乳酸菌进行发酵,产生乳酸,再在辣椒酱中加入一定量的食盐,食盐的高渗透作用使得辣椒酱中大部分杂菌的生长受到抑制,从而发酵制成辣椒酱[2]。其独特的风味深受人们的喜爱[3,4]。传统发酵辣椒酱普遍存在着一些问题:食盐的含量过高(过多的食用食盐会造成某些器官如肾脉、心血管系统的永久性损伤[5]),质量不稳定,在保藏和使用的过程中质构易软化、表面易“生花”等[6,7]。
乳酸菌发酵食品是一种国内外消费者所喜爱的营养保健食品[8,9]。发酵蔬菜用的生产菌株主要是乳酸菌,筛选出专用于发酵辣椒的乳酸菌种对于在发酵辣椒酱生产中缩短生产周期、提高食品安全性和稳定产品质量起着关键性的作用[10,11]。为此,本试验从自然发酵的辣椒酱中筛选出发酵辣椒专用乳酸菌株,并对菌株进行了生产性能的测试和鉴定,意在实现发酵辣椒的安全化、工业化生产。
1 材料与方法
1.1 材料与仪器
1.1.1 乳酸菌种分离源
辣椒:新疆轻工国际投资有限公司。
1.1.2 试剂
蛋白胨,牛肉膏,酵母提取物,乙酸钠,葡萄糖,K2HPO4,琼脂,柠檬酸二铵,吐温80,硫酸镁,碳酸钙等:均为分析纯。
1.1.3 培养基
乳酸菌富集培养基[9]:牛肉膏1%、蛋白胨1%、葡萄糖5%、酵母膏0.5%、溴甲基酚紫0.04%、K2HPO40.2%、乙酸钠0.5%、柠檬酸铵0.2%、硫酸镁0.02%、吐温80 0.1%,琼脂1.5%、p H 6.6,121℃灭菌30 min。用作乳酸菌的初步富集。
乳酸菌分离培养基[9]:碳酸钙单独灭菌后,在葡萄糖2%的MRS的固体培养基灭菌后温度降至45℃左右时,再加入碳酸钙,并充分震荡混匀。用作乳酸菌的分离使用。
乳酸菌斜面保存培养基[9]:葡萄糖2% 的 MRS固体培养基。
1.1.4 仪器与设备
精密p H计:PHS-3C型,上海精密科学仪器有限公司;电子显微镜:XS-18型,江南光学仪器厂;
生物安全柜:HR40-ⅡA2型,青岛海尔特种电器有限公司;
灭菌锅:LD2X-40BI型,上海申安医疗器械厂;
电子恒温培养箱:DPH-9162型,上海一恒科技有限公司;
数显恒温水浴锅:HH-S型,金坛市医疗器械厂;
可见分光光度计:VIS-7220G型,上海软茂仪器有限公司。
1.2 方法
1.2.1 菌种的分离
(1)乳酸菌的富集:在无菌条件下操作,吸取自然发酵辣椒酱汁5 m L接种于富集培养基中,置于35℃的恒温培养箱,静置培养48 h,用于乳酸菌的分离。
(2)乳酸菌的分离、纯化:将富集培养样品用无菌生理盐水稀释至合适的浓度,吸取0.1 m L涂布于分离培养基平板上,35℃恒温培养48~72 h。挑取可产酸的菌落,进行反复的分离、纯化。至纯菌落为止。将所获菌落菌株编号、保存备用[12,13]。
1.2.2 形态特征鉴定
(1)菌落形态观察:仔细观察平板培养基上菌落的形态特征,分离单菌落并记录结果。
(2)菌株革兰氏染色:将所分离的单菌落进行革兰氏染色,于100倍的油镜下观察。
1.2.3 生化特性 纯化后菌株进行产 H2O2试验、产H2S试验、甲基红试验、明胶液化试验、糖发酵试验。
乳酸的定性分析:取上述发酵液约5 m L于试管中,加入10%H2SO41 m L,再加入2%KMnO4溶液1 m L,此时乳酸转化为乙醛,把事先在含氨的Ag NO3溶液中浸泡的滤纸条搭在试管上,微火加热至沸,滤纸变黑则说明其有乳酸存在[14-16]。
1.2.4 生理特性
(1)温度对乳酸菌产酸能力的影响:所筛菌株接种MRS液体培养基中,分别于0,10,20,30,40,50,60 ℃培养48 h,测定发酵液p H值并用分光光度计测 OD值[17,18]。
(2)乳酸菌产酸能力:将筛选的乳酸菌株分别接种于MRS液体培养基中,置于35℃恒温培养箱中,静置培养36 h,每隔4 h测定发酵液p H值并用可见分光光度计测OD 值[17,18]。
(3)耐酸性试验:所筛菌株接种于不同p H值的MRS培养基中,35℃培养48 h,分光光度计测OD值,确定各菌株的最适生长 p H 值[17,18]。
(4)食盐浓度对乳酸菌生长的影响:在 MRS液体培养基 中分别 加 入 1%,3%,5%,7%,9%,11%,13% 的 食 盐,所筛菌株分别接种于上述培养基,置于35℃恒温培养箱中,静置培养48 h,测定发酵液p H值可见分光光度计测OD值[17,18]。
2 结果与分析
2.1 菌株形态学特征
从新疆轻工国际投资有限公司提供的辣椒中共分离、纯化得到17株疑似乳酸菌种,经菌落形态特征观察和菌株革兰氏染色(表1)观察发现,Lact.1(图1)和Lact.2(图2)菌株均为革兰氏阳性,从形态学角度初步判定两株菌均为乳酸菌。

表1 菌落形态特征Table 1 Morphological characteristics of colony

图1 Lact.1菌体特征(×1 000)Figure 1 Shape character of Lact.1(×1 000)

图2 Lact.2菌体特征(×1 000)Figure 2 Shape character of Lact.2(×1 000)
2.2 菌株生化特性
对菌株进一步进行生化特性鉴定结果见表2、3。
由表2可知,菌株Lact.1和Lact.2符合乳酸菌不液化明胶,甲基红试验阳性,发酵不产H2S、H2O2、葡萄糖发酵产乳酸的要求。
综合上述菌落形态学特征及生化特性并参考文献[19],可发现Lact.1与植物乳酸杆菌(L.p),Lact.2与肠膜明串珠菌(L.m)所具有的特性一致。

表2 菌落生化特性+Table 2 Biochemical properties of 2 screened strains
2.3 菌株生理特性
2.3.1 最适生长温度 由图3可知,两菌株在40℃左右时的光密度值最大,此时的p H值也是最低,所以两菌株的最佳生长温度在30℃到40℃之间。在20℃以下,45℃以上都不生长。因此,35℃作为测定产酸能力、耐酸能力、耐盐能力等试验的培养温度。
2.3.2 产酸能力 由图4可知,这两株乳酸菌的产酸速度较快,p H值在36 h后降到4.0左右。所接种乳酸菌产酸速度越快,p H值下降的速度也就越快,抑制杂菌的能力也就越强,这样不但大大缩短了辣椒的发酵周期,而且降低了产品中的亚硝酸盐的含量,提高了发酵辣椒的质量。从图4还可看出,OD值在24 h之内就上升到0.5左右,说明所选育出的两株乳酸菌繁殖和产酸的速度是非常快的。

表3 糖发酵试验结果Table 3 Sugar fermentation of 2 screened strains

图3 Lact.1、Lact.2生长温度曲线Figure 3 Cave of growth temperature of Lact.1,Lact.2

图4 Lact.1、Lact.2产酸速度曲线Figure 4 Cave of acid producing of Lact.1,Lact.2

图5 p H对2菌株生长的影响Figure 5 Effect of p H value on the growth of two strains hour
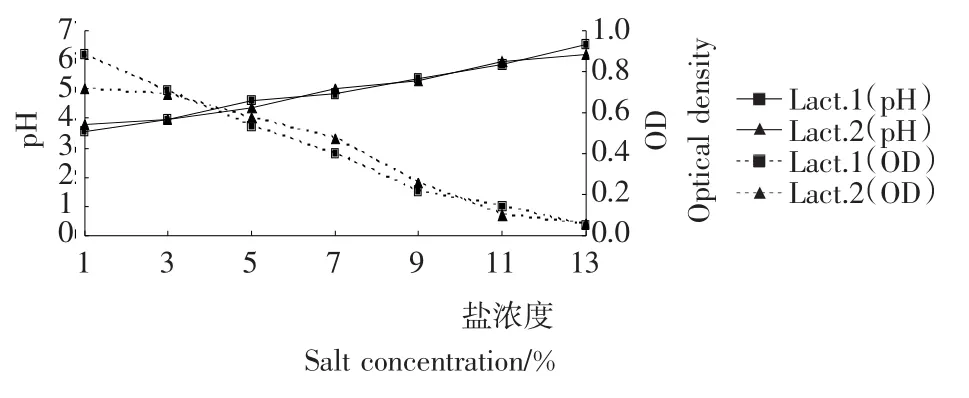
图6 食盐浓度对乳酸菌生长的影响Figure 6 Effect of salt concentration on the growth of two strains
2.3.3 耐酸性 由图5可知,Lact.1与 Lact.2两株乳酸菌在p H值低于5.0和大于9.0时还能有微弱的生长,当p H值低于3.0或大于9.0时,生长基本停止。由此可知,两株菌的最适生长p H值在6左右。
2.3.4 耐盐性 由图6可知,Lact.2对盐浓度更敏感一些,而Lact.1相对耐盐一些。各菌株在食盐的浓度在7%左右都能生长,当食盐的浓度达到9%以后,所有的菌株都受到抑制。
3 结论
(1)通过对分离菌株的形态及生化特性的研究,并参考文献[19]最终选定Lact.1和Lact.2两株适用于发酵辣椒试验的优势乳酸菌株。鉴定结果表明Lact.1为植物乳酸杆菌(Lactobacillus planetarium),Lact.2 为 肠 膜 明 串 珠 菌(Leuconostoc mesenteroides)。
(2)两菌株的生理特性试验研究结果表明:Lact.1和Lact.2产酸速率大于其他分离菌株,盐浓度在7%以下时都可生长,最适生长温度在30℃到40℃之间,在p H值为6的环境中生长速度最快。
1 闫文华,陆欢,郑胜丰,等.鲜脆剁辣椒生产工艺优化[J].食品与机械,2010,26(5):151~154.
2 卢翰,苏爱军,谭兴和.辣椒酱发酵工艺研究[J].食品与机械,2006,22(3):126~129.
3 贾洪锋.发酵辣椒中风味物质的研究[D].重庆:西南大学,2007.4 周晓媛,夏延斌,朱薇.发酵辣椒的风味调配[J].中国调味品,2006(5):46~49.
5 李雄辉.蔬菜低盐腌制过程中的酸度变化及控制[J].中国调味品,1995(6):11~13.
6 赵玲艳,邓放明,杨抚林,等.自然发酵辣椒中乳酸菌的分离及其发酵性能研究[J].食品科学,2005,26(10):82~86.
7 赵玲艳,邓放明,杨抚林.自然发酵辣椒中优良乳酸菌的分离与鉴定[J].食品研究与开发,2004,25(3):105~108.
8 Shrestha H,Nand K,Ratie R.Microbiological profile of murcha starters and physico-chemical characteristics of poko,a rice based traditional fermented food product of Nepal[J].Food Biotechnol-ogy,2002,16(1):1~15.
9 熊涛,徐立荣,范镭,等.蔬菜发酵专用乳酸菌的选育[J].食品科学,2008,29(6):264~267.
10 申彤,赵春华.果蔬乳酸发酵饮料菌种的筛选及其特性研究[J].食品工业科技,2005(9):102~104.
11 吕欣,高宇,董明盛,等.抗真菌乳酸菌的筛选及菌种鉴定[J].食品科学,2006,27(2):98~101.
12 熊晓辉,王晓飞,陆利霞,等.泡菜中乳酸菌的分离、鉴定和生产初试[J].中国调味品,2004,11(10):12~15
13 吴洁,刘蓉辉.泡菜泡制盐水中乳酸菌分离与鉴定[J].中国调味品,1995(8):16~17.
14 陈建华,朱望银,杜亚填.湘西泡菜优质乳酸菌的筛选与应用研究[J].食品科学,2010,31(1):201~205.
15 祖若夫,胡宝龙,周德庆.微生物学实验教程[M].上海:复旦大学出版社,1993:420~428.
16 凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:75~82.
17 薛凌燕.泡菜中优良发酵剂的筛选及初步研究[D].扬州:扬州大学,2008.
18 徐立荣.蔬菜发酵专用乳酸菌的选育及其菌体高密度培养[D].南昌:南昌大学,2007.
19 布坎南R E,吉布斯N E.伯杰细菌鉴定手册[M].第8版.北京:科学出版社,1984.
Isolation and identification of lactic acid bacteria from natural fermentation peppers
SHA Mo PANG Huan-ming GU Linazi LI Jing YIN Yong YANG Hai-yan
(College of Food Science,Xinjiang Agricultural University,Urumqi,Xinjiang830052,China)
Strains of lactic acid bacteria with producing high-yield lactic acid and well-growing were isolated from naturally fermented peppers.Systematic identification in morphology,physiology and biochemistry,fermentation performance choose that Lact.1 and Lact.2 for chili-jam fermentation.The results indicated that Lact.1 wasLactobacillus planetariumand Lact.2 wasLeuconostoc mesenteroides.Lact 1 and Lact 2 had good lactic acid productivity in the optimum temperature between 30℃to 40℃and the optimum p H 6.0 and could grow well in the salt concentration of 7%.
fermented pepper;lactic acid bacteria;separation and identification
10.3969/j.issn.1003-5788.2012.01.008
国家科技人员服务企业行动项目(编号:
SQ2009GJG40006)
沙漠(1986-),男,新疆农业大学在读硕士研究生。E-mail:498398739@qq.com
杨海燕
2011-10-11
—— 8品牌辣椒酱测评报告

