抗人转铁蛋白受体单克隆抗体增强姜黄素对雄激素非依赖性前列腺癌的抑制效应*
刘双林, 王志华, 胡志全△, 曾 星, 李有元, 李 恒, 章传华, 叶章群
1 武汉市第一医院泌尿外科,武汉 430022
2 华中科技大学同济医学院附属同济医院泌尿外科,武汉 430030
姜黄素是从中药姜黄的根茎中提取出来的一种脂溶性酚类色素,药用历史悠久。姜黄素可在体内、外抑制肿瘤的增殖并诱导凋亡,并可通过抑制血管生成达到抗肿瘤侵袭和转移的目的。姜黄素可能通过多条信号通路和调节相关肿瘤因子在体外抑制激素非依赖性前列腺癌细胞的增殖并诱导凋亡。最近文献报道,姜黄素具有铁螯合活性,能够上调肿瘤细胞表面转铁蛋白受体(transferrin receptor,TfR)的表达水平[1]。姜黄素一方面竞争性地与细胞外铁离子结合,降低胞外游离铁的水平;另一方面,姜黄素通过上调TfR 的表达增加肿瘤细胞对铁的利用,促进了肿瘤增殖,从而影响了它的抗瘤效应[2]。因此,在应用姜黄素同时,选用拮抗TfR 的制剂能否发挥协同抗瘤效应值得探索。本课题组拟研究姜黄素联合抗人转铁蛋白受体单克隆抗体(TfR mAb)对激素非依赖性前列腺癌的抑制作用,为姜黄素和抗人TfR mAb的临床应用提供理论基础。
1 材料与方法
1.1 材料
人前列腺癌细胞株PC-3由武汉大学典型培养物保藏中心提供;DMEM 培养液、胎牛血清、胰蛋白酶购自Gibco公司;姜黄素、二甲基亚砜(DMSO)、CFSE和碘化丙啶(PI)均购自Sigma公司。AnnexinⅤ-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司。姜黄素用DMSO 配制为50 mmol/L储备液,-20℃保存,使用时用DMEM 培养液稀释至所需浓度,确保DMSO 的终浓度低于0.1%。抗人TfR mAb 由华中科技大学同济医学院免疫学系沈关心教授馈赠。
1.2 细胞培养及实验分组
人前列腺癌细胞株PC-3 细胞在含有10%胎牛血清的DMEM 培养液中,在37℃、5% CO2的条件下培养,每3~4d 传代1 次。实验分4 组:抗人TfR mAb组加入100mg/L的抗人TfR mAb溶液进行干预,联合作用组加入100 mg/L 的抗人TfR mAb和50μmol/L的姜黄素联合作用,不加入药物为空白对照组(0μmol/L),同时设含0.1%DMSO的DMEM 为阴性对照组。
1.3 细胞增殖检测
收集对数生长期肿瘤细胞,用PBS液洗涤2次后,调整细胞密度为5×109个/L,取1 mL 加入1 μL CFSE(终浓度为1μmol/L)置于37℃孵育30 min。加入1mL小牛血清终止染色,再用PBS洗涤3次后接种于24孔培养板中(5×104/孔)。并预留部分染色后的细胞作为母代细胞,40g/L 多聚甲醛固定后4℃避光保存,待上机。待细胞贴壁后按实验分组分别加药干预,重复3孔。作用24h后,收集各组细胞,采用流式细胞仪检测。
1.4 细胞周期检测
收集对数生长期的肿瘤细胞接种于24孔培养板(5×104/孔),待细胞贴壁后按实验分组分别加药干预,重复3孔。作用24h后,收集各组细胞。用PBS液洗涤2 次后,加入预冷的70%乙醇固定细胞4℃过夜。检测前用PBS液洗去固定液,加入0.15 mL的PI综合染液(含50g/L RNA 酶),避光染色30min后,采用流式细胞仪检测。
1.5 细胞凋亡检测
收集对数生长期的细胞接种于24 孔培养板中(5×104/孔),待细胞贴壁后按实验分组分别加药干预,重复3 孔。作用24h 后,收集各组细胞。用PBS液洗涤2次后,按Annexin Ⅴ-FITC 细胞凋亡检测试剂盒说明书操作,采用流式细胞仪检测。
1.6 细胞表面TfR 表达检测
以3×105/孔细胞密度将PC-3 细胞种入6 孔板,常规培养。培养第2天加入不同浓度的姜黄素进行干预,重复3 孔。24h 后弃上清,用PBS 洗2次,胰蛋白酶消化,收集细胞,再用PBS离心洗涤3次。取单个细胞悬液加入FITC标记的鼠抗人TfR mAb,4℃避光孵育30 min,加入PBS 洗涤细胞1次。流式细胞仪检测,记录平均荧光强度。
1.7 数据分析
2 结果
2.1 抗人TfR mAb对雄激素非依赖性前列腺癌细胞生物学行为的影响
如图1~3所示,阴性对照组与抗人TfR mAb作用组的PC-3 细胞增殖指数分别为(7.08±0.20)和(7.38±0.19)(P>0.05),凋亡率分别为(5.34±0.96)%和(4.53±0.87)%(P>0.05),G2/M 期细胞比例分别为(34.27± 1.87)% 和(37.29±1.91)%(P>0.05)。研究提示,抗人TfR mAb单独作用对PC-3细胞增殖、凋亡和细胞周期无显著影响。
2.2 姜黄素对雄激素非依赖性前列腺癌细胞表面TfR 表达的影响
50μmol/L姜黄素作用24h后,流式细胞仪检测雄激素非依赖性前列腺癌细胞表面TfR 的平均荧光强度由(3 614.3±679.6)增高到(6 785.2±624.7)(P<0.05)。研究显示,姜黄素能够显著上调雄激素非依赖性前列腺癌细胞表面TfR 的表达。见图4。

图1 抗人TfR mAb对PC-3 细胞增殖的影响Fig.1 Anti-proliferative effects of TfR mAb on PC-3Cells
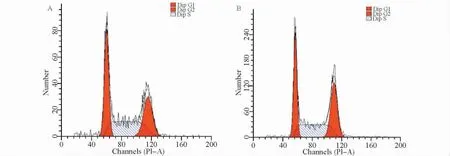
图2 抗人TfR mAb对PC-3 细胞周期的影响Fig.2 The effect of TfR mAb on cell cycle
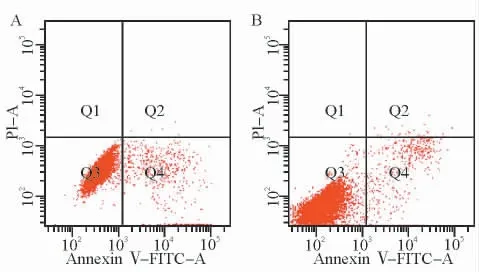
图3 抗人TfR mAb对PC-3 细胞凋亡的影响Fig.3 The effect of TfR mAb on apoptosis of PC-3cells
2.3 抗人TfR mAb增强姜黄素对雄激素非依赖性前列腺癌细胞凋亡的诱导作用
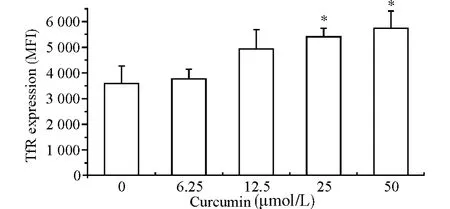
图4 姜黄素对雄激素非依赖性前列腺癌细胞表面TfR表达的影响Fig.4 The impacts of curcumin on the TfR expression in PC-3cells
与阴性对照组相比,50μmol/L 的姜黄素作用后,PC-3细胞的增殖指数明显降低[(7.08±0.20)vs.(4.38±0.19),P <0.05];凋亡率明显提高[(5.34±0.96)%vs.(21.53±2.87)%,P<0.05];G2/M 期细胞比例明显上升[(34.27±1.87)%vs.(57.29±1.91)%,P<0.05]。加入抗人TfR mAb联合作用后,姜黄素对PC-3细胞增殖和细胞周期的影响无显著变化(P>0.05),对PC-3细胞凋亡的诱导效应显著增强(P<0.05),见图5。

图5 抗人TfR mAb增强姜黄素对雄激素非依赖性前列腺癌细胞凋亡的诱导作用Fig.5 Apoptosis-inducing effects of TfR mAb in combination with curcumin on PC-3cells
3 讨论
铁是每个有机体必需的基本物质,组织细胞的生长发育都需要铁的参与。在脊椎动物中主要通过转铁蛋白(Tf)和TfR 来摄取有活性的铁离子,调节细胞内铁的转运。组织细胞摄取铁是通过细胞表面的TfR 介导,以胞吞模式进行,即携带铁的转铁蛋白与细胞表面的TfR 结合形成Tf-TfR 复合体,以胞饮内吞形式进入细胞,当胞内pH 值降低时铁被释放进入细胞质,而Tf-TfR 复合体经胞吐作用重返细胞表面[3]。TfR 是一种Ⅱ型跨膜糖蛋白,是由2个同源二聚体通过2条二硫键交联而成,广泛表达于机体多种细胞,其表达主要是根据细胞内铁水平进行调节[4]。所有的正常细胞都有低水平的TfR表达,肿瘤细胞因增殖较快对铁的需求量增加,其表面TfR 稳定性高表达,是肿瘤生物治疗的特异性靶点。有学者使用微阵列技术研究了TfR 在41株人恶性肿瘤细胞系(包括结肠癌、胃癌、卵巢癌、肺癌、乳腺癌、黑色素瘤、白血病、肾癌和前列腺癌等)中的表达情况,研究发现TfR 在激素非依赖性前列腺癌细胞系中的表达显著高于其它肿瘤细胞系[5]。研究结果提示,TfR 是激素非依赖性前列腺癌生物治疗的理想靶点。抗人TfR mAb可以特异性识别人肿瘤细胞表面TfR 胞外端,且具有较高的亲合力,是较好的肿瘤靶向治疗制剂,具有良好的临床应用前景。
TfR mAb在体外对肿瘤细胞抑制作用的主要机制包括:①封闭转运铁离子的通道,使细胞内与增殖相关的DNA 和蛋白合成功能下降;②通过抑制胞膜离子转运,引起细胞膜电兴奋的传导障碍,使细胞功能紊乱;③抗体封闭细胞表面受体,干扰生长信号传递,启动细胞凋亡机制[6-8]。此外,TfR mAb还可以提高化疗药物的敏感性,存在一定的协同抗瘤作用[9]。但是,TfR mAb 单独作用只能抑制70%左右铁的摄取,并不能完全阻断铁的转运。由于肿瘤细胞的铁库(iron pool)内都有一定量的铁储备,导致TfR mAb单独作用对肿瘤细胞的生物学行为影响有限[10]。本研究显示,抗人TfR mAb单独作用对雄激素非依赖性前列腺癌细胞的生物学行为无显著影响。
姜黄素是从中药姜黄的根茎中提取出来的一种脂溶性酚类色素,药用历史悠久。姜黄素可在体内、外抑制肿瘤的增殖并诱导凋亡,并可通过抑制血管生成达到抗肿瘤侵袭和转移的目的[11-12]。姜黄素可能通过多条信号通路和调节相关肿瘤因子在体外抑制激素非依赖性前列腺癌细胞的增殖并诱导凋亡[13-15]。有文献报道,姜黄素具有铁螯合活性,能够上调肿瘤细胞表面TfR 的表达水平。姜黄素一方面竞争性地与细胞外铁离子结合,降低胞外游离铁的水平;另一方面,姜黄素通过上调TfR 的表达增加肿瘤细胞对铁的利用,促进了肿瘤增殖,从而影响了它的抗瘤效应[16]。本研究亦证实,姜黄素可导致雄激素非依赖性前列腺癌细胞表面TfR 表达增高。因此,在应用姜黄素同时,选用拮抗TfR 的制剂可能发挥协同抗瘤效应。本研究结果显示,抗人TfR mAb可以增强姜黄素诱导雄激素非依赖性前列腺癌细胞凋亡的作用。
本研究提示,应用抗人TfR mAb 可以增强姜黄素对雄激素非依赖性前列腺癌细胞的抑制效应,为姜黄素和抗人TfR mAb的联合应用提供了理论依据。抗人TfR mAb可以增强姜黄素抗瘤效应的具体机制有待进一步研究。
[1] Jiao Y,Wilkinson J 4th,Christine Pietsch E,et al.Iron chelation in the biological activity of curcumin[J].Free Radic Biol Med,2006,40(7):1152-1160.
[2] Jiao Y,Wilkinson J 4th,Di X,et al.Curcumin,a cancer chemopreventive and chemotherapeutic agent,is a biologically active iron chelator[J].Blood,2009,113(2):462-469.
[3] Daniels T R,Delgado T,Rodriguez J A,et al.The transferrin receptor part Ⅰ:Biology and targeting with cytotoxic antibodies for the treatment of cancer[J].Clin Immunol,2006,121(2):144-158.
[4] Daniels T R,Delgado T,Helguera G,et al.The transferrin receptor part Ⅱ:targeted delivery of therapeutic agents into cancer cells[J].Clin Immunol,2006,121(2):159-176.
[5] Wirth G J,Schandelmaier K,Smith V,et al.Microarrays of 41 human tumor cell lines for the characterization of new molec-ular targets:expression patterns of cathepsin B and the transferrin receptor[J].Oncology,2006,71(1/2):86-94.
[6] Crawford E D.Understanding the epidemiology,natural history,and key pathways involved in prostate cancer[J].Urology,2009,73(5Suppl):S4-S10.
[7] Ben-Shlomo Y,Evans S,Patel B,et al.Differences in the epidemiology and presentation of prostate cancer in Black and White men in England:lessons learnt from the process study[J].BJU Int,2009,103(6):723-724.
[8] Wang C Y.Perspectives on the epidemiology of prostate cancer[J].Can J Urol,2009,16(4):4712-4713.
[9] Aggarwal B B,Takada Y,Oommen O V.From chemoprevention to chemotherapy:common targets and common goals[J].Expert Opin Investig Drugs,2004,13(10):1327-1338.
[10] Kurien B T,Scofield R H.Curry spice curcumin and prostate cancer[J].Mol Nutr Food Res,2009,53(7):939-940.
[11] Schutz F A,Oh W K.Neoadjuvant and adjuvant therapies in prostate cancer[J].Urol Clin North Am,2010,37(1):97-104.
[12] 崔群力,孙圣刚.姜黄素通过抗氧化作用拮抗鱼藤酮致PC12细胞损伤的研究[J].华中科技大学学报:医学版,2010,39(1):39-41.
[13] Thangapazham R L,Sharma A,Maheshwari R K.Multiple molecular targets in cancer chemoprevention by curcumin[J].AAPS J,2006,8(3):443-449.
[14] Aggarwal B B.Prostate cancer and curcumin:add spice to your life[J].Cancer Biol Ther,2008,7(9):1436-1440.
[15] Kunnumakkara A B,Anand P,Aggarwal B B.Curcumin inhibits proliferation,invasion,angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins[J].Cancer Lett,2008,269(2):199-225.
[16] Penson D F,Rossignol M,Sartor A O,et al.Prostate cancer:epidemiology and health-related quality of life[J].Urology,2008,72(6Suppl):S3-11.

