转染Ad-hBMP2的脂肪干细胞与壳聚糖/磷酸三钙复合物支架的相容性*
方 忠, 杨 琴, 熊 伟, 李光辉, 廖 晖, 李 锋, 肖 骏
华中科技大学同济医学院附属同济医院骨科,武汉 430030
骨缺损在临床上十分常见,其治疗一直是骨科领域的难题。随着分子生物学理论及技术的发展与成熟,应用组织工程骨修复骨缺损已成为国内外学者广泛认同的发展方向[1-2]。但组织工程骨的种子细胞与载体支架的选择存在较大的争议,我们前期研究证实了脂肪干细胞(adipose-derived stem cell,ADSCs)因其具有来源广泛、易分离培养、分化能力强等优点而被认为是组织工程的最佳种子细胞[3]。本研究进一步探讨ADSCs 与壳聚糖/磷酸三钙(CTCP)复合物支架在体外复合培养的相容性以及其构建组织工程骨的可行性,为构建组织工程骨提供实验基础。
1 材料与方法
1.1 主要仪器和试剂
成年新西兰大白兔,4月龄,体重3.0kg,雌性,购自华中科技大学同济医学院动物实验学部。速眠新(长春市军需大学兽医研究所),Ⅰ型胶原酶、地塞米松、藻酸钠、维生素C(Sigma公司);胰酶、胎牛血清、DMEM-LG、DMFM/F12(Gibco公司),荧光标记小鼠抗兔抗体(CD29-FITC、CD31-FITC、CD34-FITC、CD44-PE、CD45-FITC、CD90-FITC、mouse lgG1-PE和mouse lgG2a-F1TC,BD 公司)。T 载体(Promega 公司),Trizol 试剂、脂质体 Lipofectamine 2000(Invitrogen公司);Advantage polymerase mix、PCR 试剂盒(Clontech公司);RT 试剂盒(Fermentas公司);PCR 纯化试剂盒(Roche公司);限制性内切酶、T4噬菌体DNA 连接酶(TaKa-Ra公司);鼠抗人Ⅰ型胶原蛋白(CollagenⅠ)、骨钙素(BPG)多克隆抗体(Santa Cruz 公司)。质粒pAd-hBMP2由美国哈佛医学院分子骨科中心Oliver博士惠赠;携带β-半乳糖酐酶基因的腺病毒对照载体(Adβgal)由我院妇产科刘英博士惠赠;大肠埃希菌DH5α以及293细胞为本实验室保存。材料壳聚糖(分子量5.0×105,脱乙酰度91.8%);磷酸三钙(美国Sigma公司)。倒置相差显微镜(Nikon公司),扫描电镜(S-520,HITACHI)。
1.2 ADSCs分离、培养与Ad-hBMP2重组腺病毒的制备和转染ADSCs
ADSCs的分离、培养方法参见文献[3]。AdhBMP2重组腺病毒的制备和转染ADSCs参见文献[4]。
1.3 多孔CTCP复合支架的制备
采用二次冷冻干燥法,准确称量5g壳聚糖溶于100mL 1%的冰醋酸,待壳聚糖完全溶解后,再加入1.35g磷酸三钙搅拌30 min使其充分溶解。将终溶液分装于聚四氟乙烯培养皿,-20℃预冷成型,再放入-80℃冰箱过夜,然后置于-56℃冷冻干燥机中持续干燥48h。静置12h 恢复常温、常压后,将材料取出,浸入5%三聚磷酸钠交联90 min,期间要不断翻动,以使钙沉积均匀。交联后的材料再次置-56℃冷冻干燥机中二次冷冻干燥8h。将材料切割成5mm×5mm×1mm 大小,塑料袋密封包装,60Goγ射线照射消毒(2.5kGy,5h),储存于无菌培养瓶中备用。
二次冷冻干燥后的材料质地硬、脆,可被切削成任意形状和大小,将材料浸泡入DMEM 培养液后稍变软,并具有轻微的延展性,采用乙醇替代法测定材料的空隙率。将一定量的复合材料置于一定体积(V1)的乙醇中,循环抽真空脱气泡后,材料和乙醇总体积记为V2,将材料移出,剩余乙醇体积记为V3,则材料孔隙率:P=(V1-V2)/(V2-V3)。我们初步算得材料的孔隙率约为83%。利用扫描电镜进一步测其空隙大小。
1.4 转染Ad-hBMP2的ADSCs接种于CTCP复合支架
取支架材料用PBS 冲洗3 次,再用含双抗的DMEM 培养液浸泡过夜,选择第3 代转染AdhBMP2的ADSCs消化离心,调整细胞密度为1×106/mL,滴入经DMEM 预湿的CTCP支架,置于6孔板中,每孔加入约0.5 mL 细胞,5%CO2恒温37℃培养箱中培养4h 后补加含10%胎牛血清的DMEM 培养液2mL,并常规换液。次日换液,加入骨诱导培养液。
1.5 观察指标
1.5.1 细胞形态学观察 每日于倒置相差显微镜下观察细胞生长及与材料粘附情况。细胞接种CTCP支架培养1 周后,取细胞支架复合物于0.25%戊二醛中固定,梯度乙醇脱水,临界点干燥,表面喷金后扫描电镜下观察。
1.5.2 RT-PCR 法检测Collagen Ⅰ、BGP 的mRNA 表达 在培养第7天及第14天以溶解缓冲液溶解支架载体,离心收集脂肪细胞。以Trizol试剂裂解细胞。抽提细胞总RNA,测定RNA 浓度,用RT 试剂盒将RNA 逆转录为cDNA。然后以cDNA 的第一链作为模板进行PCR 扩增。BGP 上游引物:5′-AGCTCAACCCCAATTGTGAC-3′,下游引物:5′-AGCTGTGCCGTCCATACTTT-3′;CollagenⅠ上游引物:5′-TTCAGCTATGGAGATGACAATC-3′,下游引物:5′-AGAGTCCTAGAGTGACTGAG-3′。PCR 条件为:94℃预变性5 min,随后94℃变性45s,52℃退火45s,72℃延伸45s,共进行30个循环,再72℃延伸10min。PCR产物电泳,显色条带用图像分析系统检测(Alpha Imager 2000)。
1.5.3 Western blot测定Collagen Ⅰ、BGP 蛋白表达 在培养第7天及第14天,以溶解缓冲液溶解CTCP支架料,离心收集细胞。PBS 漂洗ADSCs,加入三去污剂裂解缓冲液收集细胞裂解物,室温下12 000r/min离心10min,收集上清液。以每泳道15μL 加入SDS-聚丙烯酰胺凝胶电泳槽进行电泳;转移至醋酸纤维膜;室温下脱脂奶粉封闭2h,然后加入封闭液和一抗CollagenⅠ(1∶200)多克隆抗体,于摇床上4℃2h,PBS洗涤3次;室温下Tris·HCl溶液孵育10min后,加入封闭液、二抗共同孵育1 h;将滤膜转移到Tris·HCl中温育10min;辣根过氧化物酶显色,拍照。实验重复3次,以β-actin为内参。
2 结果
2.1 ADSCs转染Ad-hBMP2后形态学变化
Ad-hBMP2转染后ADSCs形态规则,生长旺盛,随培养时间延长多角型细胞增多。在荧光显微镜下可见增强型绿色荧光蛋白(EGFP)于转染24h开始有表达,并证实在本实验条件下,病毒转染效率接近70%(图1)。
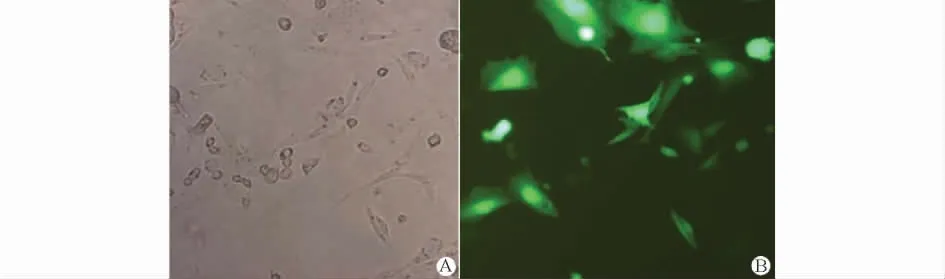
图1 ADSCs转染Ad-hBMP2后倒置相差显微镜下形态及EGFP荧光显影(×400)Fig.1 The morphology of the ADSCs transfected with Ad-hBMP2
2.2 支架材料及与细胞复合后观察
通过扫描电镜观测我们所研制的生物材料CTCP,其孔径大小为100~300μm,孔隙率83%(图2),符合组织工程支架材料的基本要求。
倒置相差显微镜下观察,ADSCs接种到CTCP支架材料上1d,可见材料不透明,无法观察内部细胞生长粘附情况,但见细胞在支架材料边缘粘附,表明细胞已在支架网孔表面贴壁并呈成纤维细胞样生长;复合培养后3d,细胞向材料内表面生长。ADSCs在诱导或基因转染条件下与CTCP支架纤维均展现了十分良好的生物相容性。电镜观察见复合培养3d后,ADSCs沿材料表面爬行生长。细胞接种支架培养7d后,细胞粘附在支架材料表面,孔洞内也有细胞生长,细胞之间通过突起相互连接,融合成片并分泌细胞外基质(图3)。

图2 光镜(A)、电镜(B)显示壳聚糖/磷酸三钙(CTCP)复合物支架孔径大且孔隙率高Fig.2 Ultrastructures of the CTCP scaffold under the light microscopy(A)and electron microscopy(B)
2.3 ADSCs支架载体中特异性骨细胞外基质的CollagenⅠ、BGP表达
RT-PCR、Western blot检测CollagenⅠ、BGP 表达结果显示:共培养7d与14d时细胞载体中的CollagenⅠ、BGP均有表达,且呈增多趋势(图4、图5)。
3 讨论
骨的缺损修复和重建一直是临床骨科所面对的难题之一[5-6],且目前临床上常用的骨移植和人工材料修复方法容易出现许多并发症而使应用受到限制[7-8]。随着上世纪末骨组织工程概念的提出,应用组织工程技术修复骨缺损成为骨科及口腔颌面整形外科的研究热点。组织工程是随着细胞生物学、分子生物学、基因技术、材料科学等高新技术迅速发展而出现的新兴科学,被认为是一场意义深远的医学革命[9-10]。种子细胞、支架材料和可溶性生物活性因子是组织工程学研究的三个要素。其中理想的支架材料需具备以下几个特征:具有高度的生物相容性、可生物降解性和可生物吸收性;同时为了有利于细胞粘附、生长、繁殖、分化,以及移入人体后能执行正常的生理功能,支架应该具有负载骨诱导因子和活性因子的合适表面;支架的内部结构应该是多孔的,并且孔间是相连的网络结构;支架要有必要的力学性能。
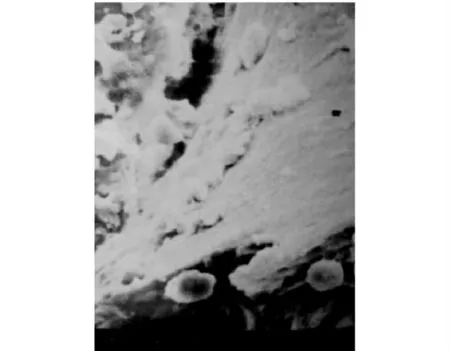
图3 复合培养7d时电镜下ADSCs生长状态(×700)Fig.3 The growth of ADSCs after co-culture for 7days under the electron microscopy(×700)
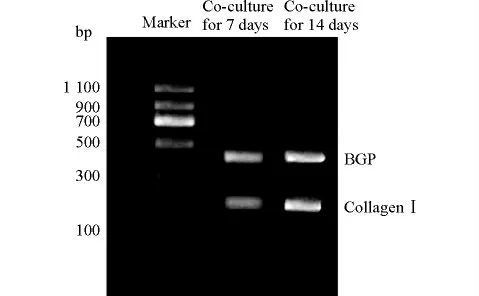
图4 共培养7d与14d 时细胞支架载体中CollagenⅠ蛋白和BGP表达的RT-PCR结果Fig.4 The CollagenⅠprotein and BGP expression in the scaffold after co-culture for 7or 14days detected by using RT-PCR
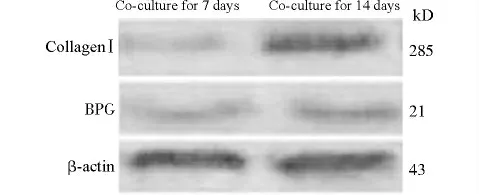
图5 共培养7d与14d 时细胞支架载体中CollagenⅠ蛋白和BGP表达的Western blot结果Fig.5 The CollagenⅠprotein and BGP expression in the scaffold after co-culture for 7days or 14days detected by Western blot
新型生物材料壳聚糖-磷酸三钙(CTCP)支架中的壳聚糖是甲壳类动物的外壳主要成分甲壳素的合成物,是具有生物更新性、生物降解性、生物相容性、无免疫原性、无细胞毒性,还具有生物功能性的天然材料,其化学成分为N-脱乙酰基化合物,属碱性氨基多糖类物质,是一种少见的带正电荷的生物降解性聚合物,在体内酶的作用之下,水解成多聚糖,终产物葡糖胺被机体吸收。其降解产物在早期能刺激膜内成骨和软骨形成,加速愈合过程[11]。壳聚糖还能够刺激和诱导结缔组织和骨再生,促进具有成骨潜能细胞的分化并有利于骨形成[12]。
单纯壳聚糖材料机械性能差,降解速度快,并且其降解产物还会使局部pH 值降低,引起炎症反应。磷酸三钙是一种生物降解性陶瓷材料,化学结构由钙磷构成,与骨基质中的无机盐成分相似,具有良好的生物相容性和骨引导活性,机械性能好[13],但其降解速度慢且降解产物呈碱性[14]。壳聚糖与磷酸三钙复合材料能互相中和,且复合材料的强度、韧性、降解速度都比单一材料有较大提高,早已有学者将这一复合材料应用于骨组织工程[15-16]。扫描电镜下可见利用冷冻干燥法制备的CTCP 支架具有多孔网状结构,材料的孔隙率约83%,孔隙大小100~300μm,且互相通连,材料质地硬、脆,可被切削成任意形状及大小,将材料浸泡入DMEM 培养液后稍变软,并具有轻微的延展性,符合生物材料的基本要求。
本研究利用CTCP 作为转基因ADSCs的载体,就是利用了其生物学特性,为新骨的生长和沉积提供支架和基质,发挥骨传导作用。细胞在CTCP内均匀分布,CTCP 内的大量孔隙为细胞所需营养的渗透提供了基础。由于良好的生物相容性,细胞容易附着,不易被液体冲走,便于局部增殖和分泌,发挥成骨作用。由于BMP-2具有很强的骨诱导作用,所以基因转染的ADSCs既作为成骨的种子细胞,又发挥了诱导作用[17]。虽然有报道认为壳聚糖材料可引起无菌性炎症,但在本实验中仅观察到有少量的炎症细胞,对骨组织的生成没有明显的影响。
我们还发现,当ADSCs与CTCP粘附后,具有向成骨细胞分化的趋势,分泌、表达的骨钙素明显增多,这种作用是与携带的目的基因有关,还是与CTCP的复合材料有关,还有待进一步证实。
总之,新型复合天然生物材料CTCP具有理想的三维多孔结构和良好的生物相容性及骨诱导作用,其与转染Ad-hBMP2的ADSCs有良好的细胞相容性,可作为骨组织工程理想的支架材料。
[1] Zhang L,Rakotondradany F,Myles A J,et al.Arginine-glycine-aspartic acid modified rosette nanotube-hydrogel composites for bone tissue engineering[J].Biomaterials,2009,30(7):1309-1320.
[2] Thein-Han W W,Misra R D.Biomimetic chitosan-nanohydroxyapatite composite scaffolds for bone tissue engineering[J].Acta Biomater,2009,5(4):1182-1197.
[3] 方忠,李锋,熊伟,等.体外分离培养兔脂肪干细胞的生物学特性[J].中国临床康复,2006,10(45):54-56.
[4] 方忠,李锋,游洪波,等.腺病毒介导转染hTGF-β1基因的兔脂肪干细胞向软骨细胞分化的实验研究[J].中华风湿病学杂志,2007,11(4):193-197.
[5] Theler J M.Bone tissue substitutes and replacements[J].Curr Opin Infect Dis,2011,19(4):317-321.
[6] Jayakumar P,Di Silvio L.Osteoblasts in bone tissue engineering[J].Proc Inst Mech Eng H,2010,224(12):1415-1440.
[7] Pirraco R P,Marques A P,Reis R L.Cell interactions in bone tissue engineering[J].J Cell Mol Med,2010,14(12):93-102.
[8] Buck B E,Malinin T L,Brown M D.Bone transplantation and human immunodeficiency virus.An estimate of risk of acquired immunodeficiency syndrome(AIDS)[J].Clin Orthop,1989,(240):129-136.
[9] Calvert J W,Weiss L E,Sundine M J.New frontiers in bone engineering[J].Clin Plast Surg,2003,30(4):641-648.
[10] Deb S,Mandegaran R,Di Silvio L.A porous scaffold for bone tissue engineering/45S5Bioglass derived porous scaffolds for co-culturing osteoblasts and endothelial cells[J].J Mater Sci Mater Med,2010,21(3):893-905.
[11] Park Y J,Lee Y M,Park S N,et al.Platelet derived growth factor releasing chitosan sponge for periodontal bone regeneration[J].Biomateria1s,2000,21(2):153-159.
[12] Zong C,Xue D,Yuan W,et al.Reconstruction of rat calvarial defects with human mesenchymal stem cells and osteoblastlike cells in poly-lactic-co-glycolic acid scaffolds[J].Eur Cell Mater,2010,20(9):109-120.
[13] Madihally S V,Matthew H W T.Porous chitosan scaffolds for tissue engineering[J].Biomaterials,1999,20(12):1133-1142.
[14] Zhang Y,Zhang M.Three-diomensional microporous calcium phosphate bioceramics with nested chitosan sponges for loadbearing bone implants[J].J Biomed Mater Res,2002,61(1):1-8.
[15] Morris H L,Reed C I,Haycock J W,et al.Mechanisms of fluid-flow-induced matrix production in bone tissue engineering[J].Proc Inst Mech Eng H,2010,224(12):1509-1521.
[16] Cunniffe G M,Dickson G R,Partap S,et al.Development and characterisation of a collagen nano-hydroxyapatite composite scaffold for bone tissue engineering[J].J Mater Sci Mater Med,2010,21(8):2293-2298.
[17] 陈亮,彭鄂军,吴柏霖,等.静电纺丝聚乳酸/聚己内酯共混纤维支架与兔脂肪源干细胞的体外生物相容性研究[J].华中科技大学学报:医学版,2011,40(5):513-516.

