脱矿牙本质糊浆联合应用氢氧化钙和微波处理快速形成羟基磷灰石*
薛万林, 龚士强, 周 彬△, 朱光勋, 刘春利, 陈卫民
1 华中科技大学校医院口腔科,武汉 430070
2 华中科技大学同济医学院附属同济医院口腔医学中心,武汉 430030
龋齿是一种常见的牙体感染性疾病,常造成牙体硬组织的缺损。传统的临床处理方法是机械去龋后采用金属、合金、树脂等材料进行修复。这些方法不可避免地损坏到邻近的正常组织,此外,由于修复材料和牙体组织之间热力学膨胀系数的差异,随着时间的延长容易产生继发龋,理想的充填材料应该从结构和化学性能上和天然牙具有高度相似性[1]。本研究中,我们拟采用脱矿牙本质糊浆结合微波照射的方法形成羟基磷灰石,并研究其转化情况,为研制与牙体硬组织结构和成分类似的材料奠定基础。
1 材料和方法
1.1 脱矿牙本质糊浆的预备
取因正畸治疗需要而拔除的新鲜前磨牙,去除根部和牙釉质,流水冷却的情形下,采用金刚石锯切成2mm×2 mm×1.5mm 大小,85% H3PO44℃摇床下处理3d,过滤去除未溶解物质,收集脱矿牙本质糊浆,4℃下储存备用。
按照4∶1 比例,牙本质糊浆中加入H2O2,根据预设定的Ca/P 比1.67,每份2mL 样本中分别加入1.5g 氢氧化钙粉末,另一组中加入1.5g 羟基磷灰石粉末,颗粒大小为2~10μm(Kermel化学试剂公司),从而分别得到以氢氧化钙或羟基磷灰石为钙来源的钙磷复合物[2]。以85%磷酸代替牙本质糊浆作为对照组。
1.2 微波照射处理
实验组和对照组各有一半样品采用微波处理,采用2 450MHz,700W 微波炉(格兰仕公司,中国)进行处理,每次处理20s,降温30s,重复30次,未作处理组置于37℃干燥器中,时间同微波照射处理组。所有样本最终放于冰中冷却30min,37℃下干燥过夜。
1.3 X射线衍射(XRD)分析
采用X 射线衍射仪(Xpert Prp,Phillips,荷兰)进行成分分析,测试以Cu Kα辐射,Kα=1.54nm,扫描范围为15°~50°,扫描速度为4°/min,以Highscore分析软件分析特征峰并分析物相。
1.4 场发射电子显微镜观察
样本碾碎成粉末进行结构分析,粉末粘台,喷金,采用场发射扫描电子显微镜(FEI-Sirion 200,美国)扫描,观察样品形貌。
2 结果
2.1 成分分析
XRD 特征图谱结果显示,以羟基磷灰石为钙来源时,在对照组中,即磷酸溶液中加入羟基磷灰石后,无论是否经过微波处理,均形成磷酸氢钙(CaHPO4,DCPA)。脱矿牙本质糊浆中加入羟基磷灰石后,未经过微波处理形成磷酸氢钙,而经过微波处理后则形成二水磷酸氢钙(CaHPO4·2H2O,DCPD)。见图1。

图1 以羟基磷灰石为钙来源样品的特征XRD图谱Fig.1 X-ray diffraction patterns of the hydroxyapatite pastes
XRD 特征图谱结果显示,以氢氧化钙为钙来源形成的晶体相差异较大,其中对照组,即磷酸溶液中加入氢氧化钙后无论是否经过微波处理,其主要晶相为磷酸氢钙,而脱矿牙本质糊浆中加入氢氧化钙后,未经微波处理的主要晶体相为氢氧化钙,微波处理组则转化成羟基磷灰石。见图2。
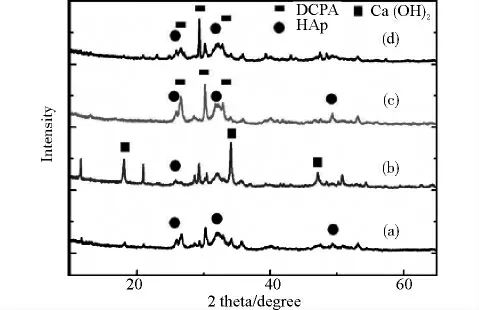
图2 以氢氧化钙为钙来源样品的特征XRD图谱Fig.2 X-ray diffraction patterns of the Ca(OH)2pastes
2.2 形貌分析
图3显示,以羟基磷灰石为钙来源未经过微波照射处理组,其晶体不规则,约1~5μm 大小,经过微波处理组后形成层状晶体。
图4显示,以氢氧化钙为钙来源组形成的晶体较以羟基磷灰石为钙来源组的晶体更为细致和紧密,未经微波处理的呈针状晶体,经过微波处理后呈层片状,但晶体要比羟基磷灰石组小得多。
3 讨论
牙体硬组织是一种无机/有机物质的杂合体,其中无机成分为羟基磷灰石[Ca10(PO4)6(OH)2,HAp]。在牙体硬组织的形成过程中,羟基磷灰石在有机基质的引导和调控下,晶体排列高度有序并具有独特和理想的结构特征,这一形成过程即称之为生物矿化。研究表明,一些有机基质,如釉蛋白、双性纳米纤维、羟基磷灰石结合多肽等可以调控羟基磷灰石形成,并已经成功应用于修复牙釉质的表面脱矿[3-5]。磷酸溶液不但能溶解牙体硬组织中的无机质,而且能溶解一些有机基质[6]。本研究中,在脱矿牙本质糊浆中加入羟基磷灰石或者氢氧化钙,有助于脱矿糊浆中的有机基质调控晶体的相变和排列。研究结果表明,脱矿牙本质糊浆中加入氢氧化钙后,不能形成羟基磷灰石,但是在微波照射的作用下,能实现羟基磷灰石的转化,但是在脱矿牙本质糊浆中加入羟基磷灰石并未发现这一效果,可能与羟基磷灰石在磷酸溶液中稳定存在有关。
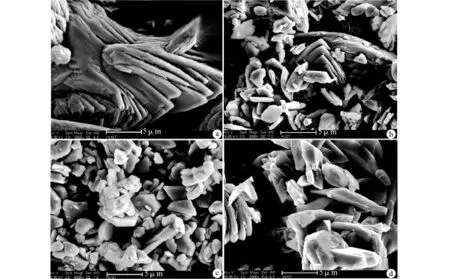
图3 场发射扫描电子显微镜观察以羟基磷灰石为钙来源样品的形貌Fig.3 FESEM images of the hydroxyapatite pastes

图4 场发射扫描电子显微镜观察以氢氧化钙为钙来源样品的形貌Fig.4 FESEM photographs of Ca(OH)2pastes
文献报道羟基磷灰石在强酸作用下形成磷酸氢钙[2],本研究中,在磷酸或者脱矿牙本质糊浆中加入羟基磷灰石后均能形成磷酸氢钙。二水磷酸氢钙是在酸性环境下最稳定的磷酸钙,常应用于牙釉质表面的涂层修复[7],本研究结果表明,微波处理能加速这一过程。
和传统的湿法或者干热法制备羟基磷灰石不同的是,本研究采用微波处理来加速羟基磷灰石的转化。有报道表明,微波处理能形成高度晶化的羟基磷灰石[8]。本研究中,单纯的微波处理或单纯的脱矿牙本质糊浆均不能促使氢氧化钙转化成羟基磷灰石,但在微波照射的作用下,脱矿牙本质糊浆中无论是加入羟基磷灰石为钙来源,还是以氢氧化钙为钙来源均出现了相变,前者形成了在酸性环境下最稳定的二水磷酸氢钙,后者则形成了片状微细的羟基磷灰石。值得注意的是,这种相变也可能和混合顺序不同有关[9]。
本研究显示,在脱矿牙本质糊浆中加入氢氧化钙并经过微波处理后能快速形成羟基磷灰石,且晶体具有颗粒精细、致密并成层片状,这提示牙本质糊浆中可能通过其中的有机基质来调控了晶体转化和形态。本研究探讨了一种新的与牙体硬组织结构、成分类似的新材料合成方法,从而有望应用于牙体硬组织缺损的修复和治疗。
(声明:本研究成果已由华中科技大学同济医院递交了“脱矿牙本质糊浆微波处理快速形成羟基磷灰石“的专利申请。)
[1] Zhou B,Liu Y,Wei W,et al.GEPIs-HA hybrid:A novel biomaterial for tooth repair[J].Medical Hypotheses,2008,71(4):591-593.
[2] Yamagishi K,Onuma K,Suzuki T,et al.Materials chemistry:a synthetic enamel for rapid tooth repair[J].Nature,2005,433(7028):819.
[3] Hartgerink J D,Beniash E,Stupp S I.Self-assembly and mineralization of peptide amphiphile nanofibers[J].Science,2001,294(5547):1684-1688.
[4] Gajjeraman S,Narayanan K,Hao J,et al.Matrix macromolecules in hard tissues control the nucleation and hierarchical assembly of hydroxyapatite[J].J Biol Chem,2007,282(2):1193-1204.
[5] Moradian-Oldak J.The emergence of"nanospheres"as basic structural components adopted by amelogenin[J].J Dent Res,2007,86(6):487-490.
[6] Iijima M,Moriwaki Y,Takagi T,et al.Elongated growth of octacalcium phosphate crystals in recombinant amelogenin gels under controlled ionic flow[J].J Dent Res,2002,81(1):69-73.
[7] Klein C P,de Blieck-Hogemrst J M,Wolke J G,et al.Solubilities of different calcium phosphate ceramic particles in vitro[J].Biomaterials,1990,11(7):509-512.
[8] Liu J,Li K,Wang M,et al.Rapid formation of hydroxyapatite nanostructures by microwave irradiation[J].Chem Phys Lett,2004,396(4-6):429-432.
[9] Mao J,Liu Y,Zhou B,et al.The effect of premixed schedule on the crystal formation of calcium phosphate cement-chitosan composite with added tetracycline[J].J Huazhong Univ Sci Technolog[Med Sci],2008,28(4):483-486.

