颈管细胞及化生细胞在宫颈液基细胞学检查中的临床价值*
陈枝岚, 黄科程, 胡 婷, 杨 茹, 李 雄, 张庆华,, 贾 瑶,沈 健, 王少帅, 唐方徐, 周 航, 马 丁, 王世宣, 李 双△
1 华中科技大学同济医学院附属同济医院妇科肿瘤实验室,武汉 430030
2 广州军区武汉总医院妇产科,武汉 430070
3 武汉市中心医院妇产科,武汉 430014
宫颈癌是世界范围内女性的第2大恶性肿瘤,宫颈癌筛查的目的是通过对早期病变的检出和治疗以降低宫颈癌的发病率和病死率,而有效筛查的前提是获取高质量的标本和细胞学报告。由于宫颈上皮病变源于鳞柱交界处,故宫颈刷片应在此处取材,取到了颈管细胞(endocervical cells,EC)和(或)化生细胞(metaplastic squamous cells,MSC)意味着取到了转化区成分。但是,缺乏颈管细胞及化生细胞的刷片是否有意义,在过去10年一直存在争议。一类观点认为缺乏宫颈细胞说明宫颈取样不足,从而存在较高的假阴性率;另一类观点认为颈管细胞和化生细胞是否存在对子宫颈刷片质量没有影响,因为在没有这2种细胞成分的刷片中仍可检测出细胞学异常[1-2]。国外对颈管细胞和化生细胞在宫颈筛查中的价值进行了大规模的横断面研究和纵向研究,并有一系列的相关报道,而目前国内尚未见颈管细胞及化生细胞在宫颈病变筛查中的临床价值的研究报道。因此,本研究探讨了刷片中颈管细胞及化生细胞存在与否对宫颈细胞学异常检出率的影响,以期引起临床医师对液基细胞学中颈管细胞及化生细胞状态的重视。
1 材料与方法
1.1 材料来源
收集2008年1月~2009年12月同济医院门诊就诊患者的液基细胞学检查结果共28 952份,患者年龄16~86岁,平均年龄38岁,均无盆腔放疗史。
1.2 调查方法
临床医师采用固定样式的扫帚式刷子按规定手法操作。先用无菌干棉球轻轻擦去宫颈表面黏液,再将宫颈细胞刷插入宫颈管内约1cm,保持适当压力,使细胞刷呈扇形,顺时针旋转5~8圈,收集宫颈外口及颈管的脱落细胞,取出细胞刷放入液基细胞保存液中,充分漂洗,使细胞被洗到保存液中,进入保存液中的细胞经自动化移液及梯度离心、细胞沉降等程序化处理制成均匀的薄层涂片并染色,中性树胶封片,由专人阅片。采用薄层液基细胞学(2001年)分级系统[3]进行诊断分类:①未见上皮内病变或癌变(negative for intraepithelial lesion or malignancy,NILM);②意义不明确的不典型鳞状上皮细胞(atypical squamous cells of undetermined signification,ASCUS);③不排除上皮内高度病变的不典型鳞状细胞(atypical squamous cells cannot exclude HSIL,ASC-H);④低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL);⑤高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL);⑥鳞状细胞癌(squamous cell carcinoma,SCC);⑦意义不明的不典型腺上皮细胞(atypical glandular cells of undetermined signification,AGUS)和不典型腺上皮细胞倾向瘤变(atypical glandular cells,favor neoplastic,AGC-fn);⑧腺癌(adenocarcinoma,AC)。因具备颈管细胞或化生细胞都意味着取到了足够量的转化区细胞,因此统计分析时将仅具备颈管细胞或化生细胞的标本合并为EC(+)or MSC(+)组进行分析。细胞学诊断阳性是指ASCUS及以上级别病变。
1.3 统计学处理
用Epi Data 3.0 软件建立数据库,采用SPSS 13.0软件进行统计学分析。样本率的比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 宫颈液基细胞学检测结果
宫颈液基细胞学检测结果见表1。细胞学异常总检出率为3.54%。其中LSIL、HSIL 及SCC 检出率分别为1.11%、0.36%、0.02%。

表1 宫颈液基细胞学检测结果Table 1 Laboratory results for the smears
2.2 细胞学异常按年龄分组分析
各年龄组LSIL检出率较接近,HSIL 主要集中于41岁以上人群。ASCUS+ACS-H 检出率在61岁~组最高,51岁~组次之,31岁~、41岁~组检出率较接近,<31岁组检出率最低。SCC 主要集中在41岁~组。共有2 203人无年龄信息,未列入统计。见表2。
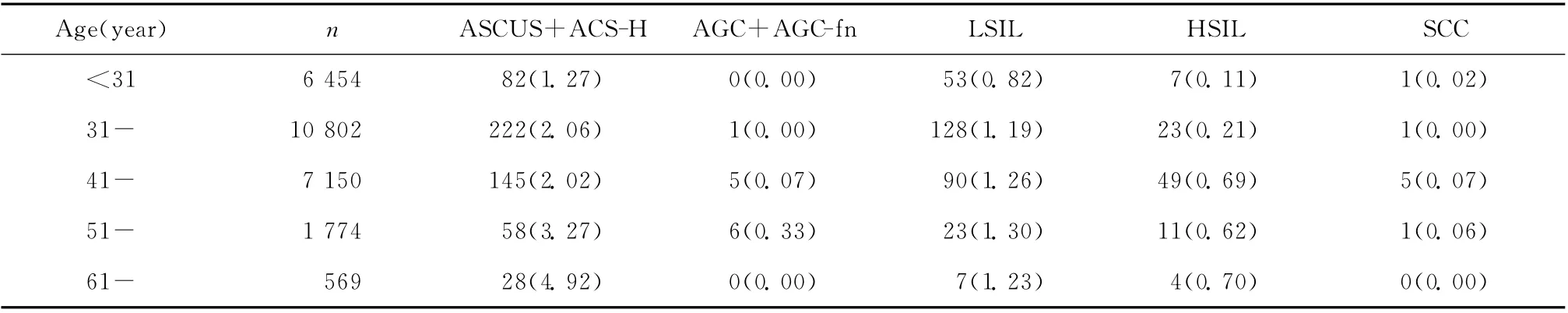
表2 细胞学异常按年龄分组分析结果[例(%)]Table 2 Distribution of cytological diagnoses according to age grouping[n(%)]
2.3 液基细胞标本质量分析
以细胞量≤40%为基本满意,细胞量>40%为满意。EC(+)/MSC(+)组标本质量满意率达89.77%,EC(+)or MSC(+)组次之(77.67%),EC(-)/MSC(-)组为70.42%;3组之间差异有统计学意义(χ2=546.422,P<0.01)。见表3。

表3 液基细胞标本质量分析[例(%)]Table 3 Specimen adequacy by laboratory assessment[n(%)]
2.4 标本中是否存在颈管细胞及化生细胞与细胞学异常检出率的相关性
细胞学异常总检出率在EC(+)/MSC(+)组最高(7.82%),其次是EC(+)or MSC(+)组(5.21%),EC(-)/MSC(-)组检出率最低(1.28%),χ2=465.600,P<0.01。见表4。

表4 标本中是否存在颈管细胞及化生细胞与细胞学异常检出率的相关性分析[例(%)]Table 4 The association between the status of EC/MSC and abnormal cytology detection[n(%)]
2.5 标本中是否存在颈管细胞及化生细胞与患者年龄的相关性
EC(+)/MSC(+)在不同年龄组中以61岁~组比例最高,<31岁组比例最低,年龄组间差异有统计学意义(P<0.01);EC(+)or MSC(+)在51岁~组比例最高,<31岁组比例最低,年龄组间差异有统计学意义(P<0.01);EC(-)/MSC(-)在<31岁组比例最高,61岁~组比例最低,年龄组间差异有统计学意义(P<0.01)。见表5。

表5 标本中是否存在颈管细胞及化生细胞与患者年龄的相关性分析Table 5 Age-associated status of EC/MSC in 10-year age intervals
3 讨论
本次筛查细胞学异常总检出率为3.54%,其中LSIL、HSIL及SCC检出率分别为1.11%、0.36%、0.02%,与资料报道的发展中国家的原始发病率100/10万,而发达国家约4/10万~10/10万基本吻合[4-5]。HSIL主要集中于41 岁以上人群,可疑宫颈鳞癌主要集中在41~50岁组,与宫颈癌发病高峰年龄一致。
现已明确人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌发生的主要病因[6]。获取高质量的标本对细胞学检查具有重要的意义,缺乏颈管细胞及化生细胞的刷片是否有意义,在过去10年一直存在争议。有研究表明SIL 在有颈管细胞/化生细胞的标本中检出率更高[7]。Young[8]的研究未观察到SIL检出率与标本中是否存在颈管细胞/化生细胞间的相关性。Mitchell等[9]发现可见颈管细胞/化生细胞的液基标本中SIL 检出率更高,但提高了颈管细胞/化生细胞的收集率后,SIL 检出率并未随之增加。O’Sullivan等[10]进行的回顾性病例对照研究(retrospective case control)未发现假阴性与标本中无颈管细胞/化生细胞间存在关联。本研究结果显示:细胞学异常总检出率在EC(+)/MSC(+)组最高(7.82%),其次是EC(+)or MSC(+)组(5.21%),EC(-)/MSC(-)组检出率最低(1.28%),差异有统计学意义(P<0.01),与Ribeiro等[7]研究结果相符。
细胞学异常往往需要通过活检进一步证实,因为活检的组织学病检结果能够提供更为有力的证据。Bos等[1]进行了一项回顾性纵向研究(retro-spective longitudinal cohort analysis),通过比较细胞学和组织病理学结果,探讨有无颈管细胞的细胞学诊断阴性标本中浸润性宫颈癌和宫颈癌前病变的发生率是否存在差异,结论是细胞学阴性的妇女在6~8年后发展为HSIL 的概率并不取决于颈管细胞存在状态,即未见颈管细胞者在以后的若干年中宫颈病变发生率并未较可见颈管细胞者增高。Mitchell等[11-12]进行的2项纵向研究结论与之一致。
本研究数据显示在EC(+)/MSC(+)组,HSIL 检出率更高。这可能与高危型和低危型HPV 的不同生物学特性有关。低危型HPV 更倾向于粘附于已分化的鳞状细胞,而高危型倾向于感染鳞柱交界区的细胞[13]。Mitchell等[12,14]推测转化区处于颈管较低位置者宫颈上皮细胞更易于取到,其转化区更易暴露于致病源,发展为SIL 的风险更高,免疫组化检测的结果也证实了这个观点。免疫组化检测发现激素受体阳性的细胞主要位于转化区和颈管外口的基底层和中间层,且转化区未成熟化生细胞激素受体水平较宫颈外口细胞更高。Marusa等[15-16]在校正了未见宫颈细胞/化生细胞组中的假阴性后,计算了SIL的发生率,发现HSIL 或更高级别病变在无颈管细胞组明显下降,因此认为这类妇女为低危人群,其可能对外来刺激如HPV不敏感,也可能其转化区位于颈管的较高部位,或转化区经鳞状上皮化生后成为敏感度较低的上皮。
本研究数据显示EC(+)/MSC(+)组标本满意率(细胞量>40%)达89.77%,EC(+)or MSC(+)组次之(77.67%),EC(-)/MSC(-)组为70.42%,提示标本中颈管细胞及化生细胞是否存在与标本质量相关。因此,在细胞学报告中注明宫颈细胞/化生细胞是否可见对于提高总体样本的质量具有重要意义,可进一步提高人们对样本质量的重视,促使他们使用更好的取材用具,发展和使用更为敏感的细胞学技术[17-20]。对于液基细胞学检查未见颈管细胞/化生细胞的妇女,有无必要提前进行下一次筛查尚存在争议,现在有越来越多的研究不支持对缺乏颈管细胞或化生细胞的患者提前进行下一次筛查,除非有一定的临床指征,包括:①之前有细胞学异常(ASCUS或更严重);②12个月内查出高危HPV 阳性;③有阴道不规则出血;④临床医师无法肉眼看到宫颈或无法从宫颈内口取材;⑤免疫抑制;⑥之前筛查次数少。
为了彻底阐述清楚宫颈细胞、化生细胞在宫颈癌筛查中的作用,今后尚需进行前瞻性纵向研究,并对患者进行较长时间的随访。
[1] Bos A B,van Ballegooijen M,Elske van den Akker-van Marle M,et al.Endocervical status is not predictive of the incidence of cervical cancer in the years after negative smears[J].Am J Clin Pathol,2001,115(6):851-855.
[2] Sidawy M K,Tabbara S O,Silverberg S G.Should we report cervical smears lacking endocervical component as unsatisfactory?[J].Diagn Cytopathol,1992,8(6):567-570.
[3] Soloman D,Davey D,Kurman R,et al.The 2001Bethesda System:terminology for reporting cervical of cervical cytology[J].JAMA,2002,287(16):2114-2119.
[4] Lu C H,Chang C C,Chang M C,et al.Clinical parameters associated with unsatisfactory specimens of conventional cervical smears[J].Diagn Cytopathol,2000,39(2):87-91.
[5] Shen Y,Wang Z H.Total laparoscopic radical hysterectomy for treatment of uterine malignant tumors:analysis of shortterm therapeutic efficacy[J].J Huazhong Univ Sci Technol[Med Sci],2010,30(3):375-378.
[6] Wu S,Chen G,Wang W,et al.Value and feasibility of HPV DNA test in cervical scraping smears[J].J Huazhong Univ Sci Technol[Med Sci],2005,25(4):451-453,467.
[7] Ribeiro A A,Santos Sdo C D,de Souza e Silva S R,et al.Endocervical component in conventional cervical smears:influence on detection of squamous cytologic abnormalities[J].Diagn Cytopathol,2007,35(4):209-212.
[8] Young W.Comparison of transformation zone sampling rates:apotentially useful indicator of smear taker performance[J].Cytopathology,2000,11(2):116-123.
[9] Mitchell H,Medley G.Cytological reporting of cervical abnormalities according to endocervical status[J].Br J Cancer,1993,67(3):585-588.
[10] O’Sullivan J P,A’Hern R P,Chapman P A,et al.A case control study of true-positive versus false-negative cervical smears in women with cervical intraepithelial neoplasia(CIN)Ⅲ[J].Cytopathology,1998,9(3):155-161.
[11] Mitchell H,Medley G.Longitudinal study of women with negative cervical smears according to endocervical status[J].Lancet,1991,337(8736):265-267.
[12] Mitchell H S.Longitudinal analysis of histologic high grade disease after negative cervical cytology according to endocervical status[J].Cancer,2001,93(30):237-240.
[13] Yeoh Gary P S,Tse Melody P Y,Chan K W.Human papillomavirus DNA and liquid-based cervical cytology cotesting in screening and follow-up patient groups[J].Acta Cytol,2006,50(6):627-631.
[14] Leung K M,Lam M,Lee J W,et al.The significance of endocervical cells and metaplastic squamous cells in liquid-based cervical cytology[J].Diagn Cytopathol,2009,37(4):241-243.
[15] Marusa M,Birdsong G.Are cervicovaginal smears which lack an endocervical component more likely to be false negative?[J].Mod Pathol,2001,37(14):56A.
[16] Siebers A G,de Leeuw H,Verbeek A L.Prevalence of squamous abnormalities in women with a recent smear without endocervical cells is lower as compared to women with smears with endocervical cells[J].Cytopathology,2003,14(2):58-65.
[17] Trent Gynaecological Pathology Quality Assurance Group.Inadequate cervical smears:results of an educational slide exchange scheme[J].Cytopathology,1999,10(1):16-24.
[18] Harrison W N,Teale A M,Jones S P,et al.The impact of the introduction of liquid based cytology on the variation in the proportion of inadequate samples between GP practices[J].BMC Public Health,2007,7:191.
[19] Arbyn M,Herbert A,Schenck U,et al.European guidelines for quality assurance in cervical cancer screening:recommendations for collecting samples for conventional and liquidbased cytology[J].Cytopathology,2007,18(3):133-139.
[20] 黄斌,李瑞珍,吴瑞芳,等.HPVL1壳蛋白与hTERC 基因检测及联合分析对宫颈癌筛查的意义[J].华中科技大学学报:医学版,2010,39(4):554-557,561.

