内质网应激介导过氧化氢诱导的心肌细胞凋亡*
孔 曼, 陈 娟, 周 洁, 朱文德, 万丽敏, 熊宇芳, 李子希
1 华中科技大学同济医学院生物化学与分子生物学系,武汉 430030
2 武汉市中心医院检验科,武汉 430014
3 华中科技大学同济医学院附属中西医结合医院检验科,武汉 430070
研究表明,心肌细胞凋亡可参与多种心血管疾病的发生过程,如冠心病、心绞痛、心力衰竭、心肌炎及心脏自身免疫性疾病等[1]。Hamada等[2]研究发现大鼠腹主动脉狭窄所致的持续性压力负荷升高可加重内质网未折叠蛋白反应(unfolded protein response,UPR),诱导内质网应激(endoplasmic reticulum stress,ERS)相关的细胞凋亡,最终导致扩张型心肌病和心力衰竭。在多种致心肌损伤因素的持续作用下,可引起过度ERS,通过CHOP(C/EBP homologous protein)、应激活化蛋白激酶和Caspase-12等内质网凋亡途径相关信号分子引起细胞凋亡[3]。基于上述研究,我们拟通过观察过氧化氢(H2O2)对体外培养的乳鼠心肌细胞凋亡的诱导作用,探讨其可能的信号通路是否与触发ERS调控机制有关。
1 材料与方法
1.1 主要实验材料
细胞株为乳鼠心肌细胞(H9C2),来源于上海细胞典藏中心。DMEM 培养液、胎牛血清由美国Gibco公司提供,伊红和苏木精、碘化丙啶溶液(PI)均购自Sigma 公司。实验中所用抗体购自美国Santa Cruz公司。H2O2购自于北京宏盛苑化工有限公司,为分析纯产品。Annexin Ⅴ-FITC 细胞凋亡检测试剂盒、活性Caspase-12 和活性Caspase-3检测试剂盒购自凯基生物公司。
1.2 实验方法
1.2.1 细胞培养 从液氮罐中取出冻存的H9C2细胞,迅速放入37℃水浴箱中直至融解;放入培养瓶中,加入含10%胎牛血清的DMEM 培养液,放入37℃、5%CO2培养箱中,12h 后换新鲜的培养液;每2~3天传1代,1∶2的比例传代。
1.2.2 细胞行苏木精-伊红染色 按照实验分组铺6孔板,待细胞密度为80%,吸弃上清液,加1 mL 95%乙醇固定40min,加苏木精600μL染核15min,自来水洗后加0.1%盐酸乙醇,分化10~30s,温水返蓝后再加伊红10min,光镜下观察细胞形态。
1.2.3 流式细胞术测细胞凋亡率 使用AnnexinⅤ-FITC细胞凋亡检测试剂盒,按照使用说明通过检测膜磷脂酰丝氨酸(PS)评估细胞凋亡。用不含EDTA 的0.25%胰酶液消化重悬细胞,2 000r/min离心5min,弃上清,PBS洗2次,收集(1~5)×105个细胞;加入500μL 的Binding Buffer悬浮细胞,随后加入5μL AnnexinⅤ-FITC混匀,再加入5μL PI染液混匀,室温避光反应5~15min,于1h内用流式细胞仪进行定量检测。
1.2.4 流式细胞术检测Caspase-12、Caspase-3 的活化 使用活性Caspase-12和活性Caspase-3检测试剂盒,按照使用说明检测活性Caspase-12和活性Caspase-3的荧光强度。用不含EDTA 的胰酶消化收集细胞,每管用0.5mL的BD Cytofix/Cytoperm(1×)溶液重悬细胞,冰置20 min后用0.5 mL 的BD Perm/wash buffer(1×)洗2 遍,加入100μL BD Perm/wash buffer(1×)+20μL 活性Caspase-12和Caspase-3的抗体室温避光放置30min,离心弃上清,再用1.0 mL BD Perm/wash buffer(1×)洗1 遍后,加入0.2 mL BD Perm/wash buffer(1×)重悬细胞,上机检测。
1.2.5 Western blot检测蛋白表达 收集细胞提取蛋白,用BCA 法测得蛋白浓度。取样品蛋白质100μg,SDS-PAGE电泳分离蛋白质,湿转到NC 膜上,然后用5%的脱脂奶粉封闭2h,加入一抗(稀释度:兔抗p-PERK 和CHOP多克隆抗体1∶400;羊抗p-JNK 多克隆抗体1∶400;鼠抗β-actin单克隆抗体1∶10 000)室温下摇动孵育2h或4℃过夜,再加入辣根过氧化物酶标记的二抗后显影。扫描后定量分析。
1.3 统计分析
2 结果
2.1 H2O2 诱导心肌细胞凋亡的作用
我们采用100μmol/L(低浓度)和500μmol/L(高浓度)的H2O2,对心肌细胞给予不同时间(0、4、8、12、24h)的刺激,用流式细胞仪检测心肌细胞的凋亡率。结果显示:100μmol/L H2O2可显著诱导心肌细胞凋亡,细胞凋亡率明显高于500μmol/L(P<0.01),且细胞凋亡率在8h达到高峰,随后细胞坏死率逐渐增加。500μmol/L H2O2处理组虽然有一定的细胞凋亡率,但坏死细胞比例显著上调(图1)。
2.2 H2O2 诱导心肌细胞凋亡的形态学变化
如图2所示,正常组心肌细胞呈梭形,细胞与细胞间排列紧密;100μmol/L H2O2处理组的心肌细胞呈皱缩变形,500μmol/L H2O2处理组心肌细胞失去原有形态,质膜肿胀溶解坏死。
2.3 H2O2 对ERS标志蛋白表达的影响
如图3所示,为进一步探讨H2O2诱导心肌细胞凋亡的可能信号途径,我们采用Western blot检测ERS标志蛋白p-PERK 和CHOP 的表达水平。采用低浓度H2O2(100μmol/L)处理不同时间的心肌细胞作为实验组,未处理组作为对照组,与药物孵育后提取蛋白样品进行Western blot分析。
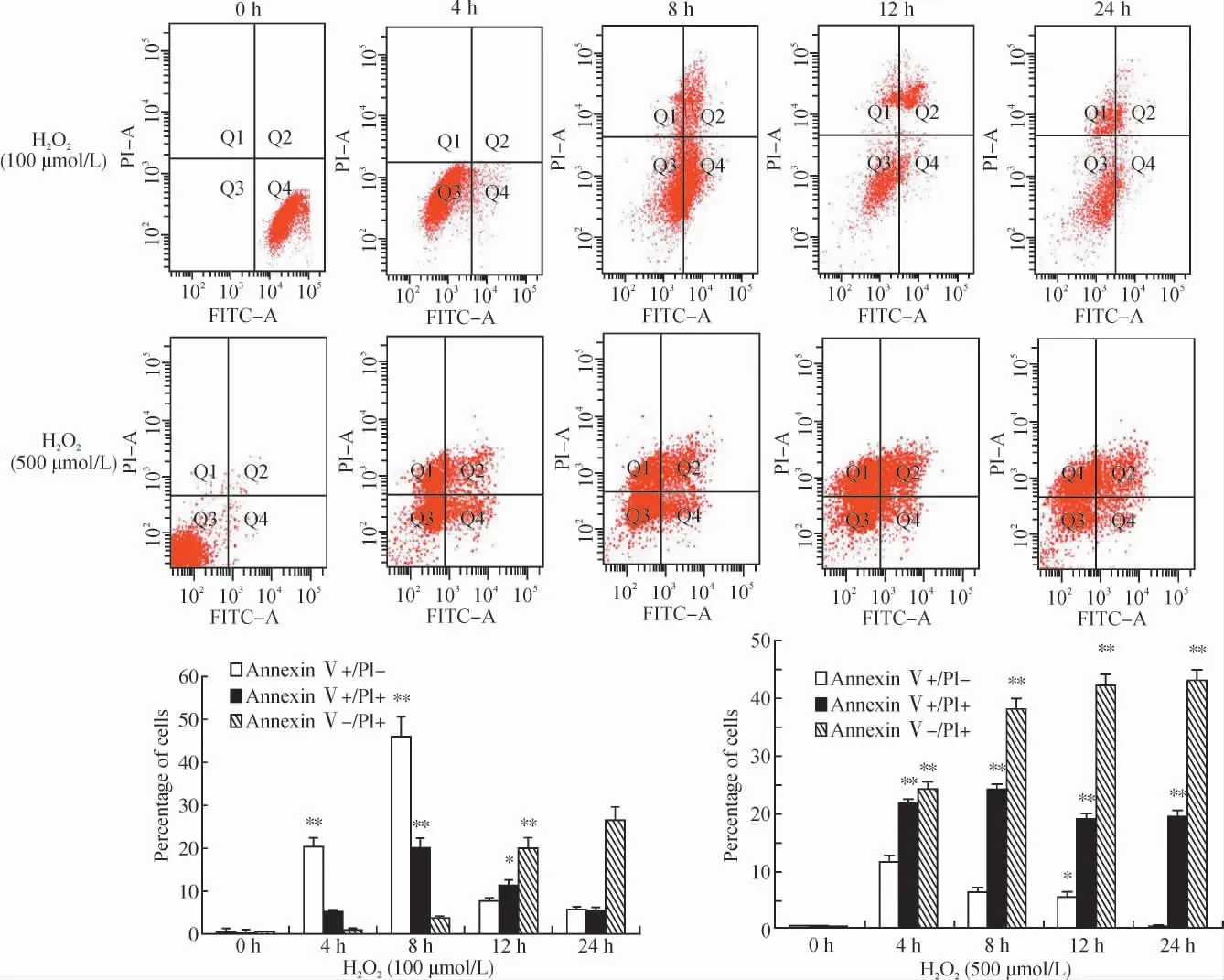
图1 流式细胞术检测H2O2 对心肌细胞凋亡的影响Fig.1 Flow cytometry analyses of cell apoptosis induced by H2O2
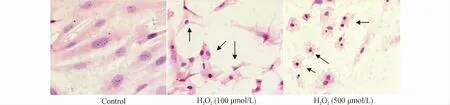
图2 不同浓度H2O2 刺激8h后心肌细胞的形态学变化(苏木精-伊红染色,×40)Fig.2 The morphological changes of myocardial cells induced by H2O2for 8h(HE staining,×40)
结果显示:在上样量一致的情况下,不同时间点H2O2处理组p-PERK 和CHOP 蛋白表达依次增高,至8h达到高峰,12h和24hCHOP蛋白的表达量与8h时间点相比则分别下调了48%和49%,12h和24hp-PERK 蛋白的表达量与8h时间点相比则分别下调了30%和40%。提示:H2O2诱导心肌细胞的凋亡与ERS有关,且在8h作用时间点达到高峰。

图3 H2O2(100μmol/L)处理不同时间心肌细胞ERS标志蛋白的表达Fig.3 The expression of ERS marker proteins induced by H2O2(100μmol/L)in myocardial cells
2.4 化学伴侣PBA(4-phenylbutyric acid)对H2O2 诱导心肌细胞凋亡的影响
由于ERS的诱因之一是错误或未折叠蛋白在内质网内的聚集,而化学伴侣可以使错误或未折叠蛋白进行正确折叠,因此,化学伴侣PBA 是ERS抑制剂。我们将心肌细胞分为4组,即未处理组、PBA(500μmol/L)处理12h组、H2O2(100μmol/L)处理8h组、PBA(500μmol/L)预处理12h+H2O2(100μmol/L)处理8h组。为进一步探讨其机制,我们采用Western blot检测与ERS相关的凋亡信号分子p-JNK 等的蛋白表达水平,采用流式细胞仪检测心肌细胞内荧光标记的活化的Caspase-3 和Caspase-12。结果表明:PBA 预处理后可显著逆转H2O2诱导的p-JNK、p-PERK、CHOP的表达上调;使活化的Caspase-3和Caspase-12的含量显著减少(P<0.01),即ERS抑制剂PBA 可显著逆转H2O2诱导的心肌细胞凋亡(图4、5)。

图4 PBA 对H2O2 诱导的心肌细胞p-PERK、CHOP、p-JNK 蛋白表达的影响Fig.4 The effect of PBA on the expression of ERS marker proteins induced by H2O2in myocardial cells
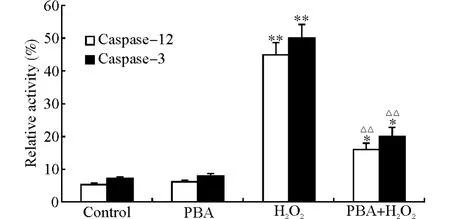
图5 PBA 对H2O2 诱导的心肌细胞Caspase-3和Caspase-12活化的影响Fig.5 The effect of PBA on the activation of Caspase-3 and Caspase-12induced by H2O2in myocardial cells
3 讨论
大量研究表明氧化应激在心血管疾病的发病机制中有重要作用。近年来研究显示:氧化应激与内皮功能障碍等病理生理机制相互作用,共同促进心血管疾病的发生、发展。Lennon等[4]首先发现低浓度的H2O2(10~100μmol/L)可诱导HL-60 细胞发生凋亡,而当H2O2浓度继续升高时,便可导致大量的细胞坏死。此后,对氧化应激介导心肌细胞凋亡进行了大量的研究,发现H2O2或O-2等外源性活性氧均可诱导培养的乳鼠心肌细胞凋亡,同时,由于细胞抗氧化防御系统受损而导致的内源性活性氧生成增加亦可介导心肌细胞凋亡[5]。这些研究结果均表明:氧化应激是心肌细胞凋亡的重要诱导因素。在本实验中,我们的结果显示高浓度的H2O2对细胞的作用是导致细胞坏死,而低浓度的H2O2导致细胞凋亡,与既往文献报道一致。
ERS是由于某种原因导致细胞内质网稳态失衡、生理功能发生紊乱的一种亚细胞器的病理过程[6]。研究表明:ERS反应是细胞的一种自我保护性机制,以恢复内质网稳态,维持细胞生存,但是过强的或长时间的ERS 反应可以引起细胞凋亡[7]。越来越多的研究证实,ERS与心血管疾病的发生关系密切。
Zhao等[8]在小鼠缺血缺氧细胞模型中证实有活性氧的产生,内质网钙泵对氧化损伤敏感,因此认为内质网可能是活性氧攻击的重要目标之一。ERS的早期主要是内质网伴侣分子GRP78、GRP94、CRT 表达上调和PERK-eIF2α磷酸化介导的蛋白合成暂停[9]。因此,心肌缺血早期和心肌肥大代偿阶段主要出现GRP78、CRT 表达和PERK、eIF2α磷酸化的上调,表明细胞通过ERS 调节自稳态失衡,过强和持续的ERS可以通过内质网相关凋亡途径引起细胞凋亡[9]。近年来PERK 在ERS中的作用受到关注,PERK 磷酸化激活后,早期可抑制蛋白合成,晚期则可上调CHOP的表达,活化ERS相关凋亡信号途径。
高表达的CHOP通过上调促凋亡蛋白Bax、下调Bcl-2表达,促进线粒体细胞色素C 释放、凋亡小体形成和Caspases活化从而导致细胞凋亡[10]。我们发现,低浓度H2O2诱导心肌细胞p-PERK 和CHOP表达显著上调。推测:低浓度H2O2作用8h后引起心肌细胞过度ERS,通过CHOP、p-PERK等内质网相关凋亡途径引起细胞凋亡。
Caspase-12存在于内质网膜上,ERS 可引起Caspase-12活化,另外IRE1 与肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor-associated factor 2,TRAF2)结合启动JNK 级联反应,促进Caspase-12在内质网膜上聚集与活化,Caspase-12通过激活Caspase-9、Caspase-3 而诱导细胞凋亡[11-12],其活化过程可不涉及细胞色素C 从线粒体释放,表明Caspase-12通过不同于线粒体凋亡途径的独立信号转导途径介导细胞凋亡。
在本实验中我们发现H2O2诱导心肌细胞的p-JNK、p-PERK、CHOP 高表达,活化Caspase-3 和Caspase-12,加入ERS的抑制剂PBA 后,心肌细胞的凋亡率显著下调,Western blot检测结果显示p-JNK、p-PERK、CHOP的表达也显著降低。由此证实:氧化应激诱导心肌细胞凋亡与促发ERS有关。我们推论:ERS途径可能是H2O2诱导心肌细胞凋亡的信号转导通路之一。
综上所述,我们的研究结果证实低浓度的H2O2可导致心肌细胞凋亡,高浓度的H2O2则导致细胞坏死,ERS的抑制剂PBA 可部分抑制H2O2诱导的心肌细胞凋亡,ERS介导的细胞凋亡途径可能是H2O2诱导心肌细胞凋亡的信号转导通路之一。
[1] 明章银,向继洲,吴基良,等.褪黑素对大鼠心肌缺血/再灌注后细胞凋亡的影响[J].华中科技大学学报:医学版,2003,32(4):358-360.
[2] Hamada H,Suzuki M,Yuasa S,et al.Dilated cardiomyopathy caused by aberrant endoplasmic reticulum quality control in mutant KDEL receptor transgenic mice[J].Mol Cell Biol,2004,24(18):8007-8017.
[3] Peng X,Wu X,Druso J E,et al.Cardiac developmental defects and eccentric right ventricular hypertrophy in cardiomyocyte focal adhesion kinase(FAK)conditional knockout mice[J].Proc Natl Acad Sci U S A,2008,105(18):6638-6643.
[4] Lennon S V,Martins J,Cotter T G.Dose-dependent induction of apoptosis in human tumor cell lines by widely diverging stiumuli[J].Cell Prolif,1991,24(2):203-214.
[5] Kim H J,Cho H K,Kwon Y H.Synergistic induction of ER stress by homocysteine and beta-amyloid in SH-SY5Ycells[J].J Nutr Biochem,2008,19(11):754-761.
[6] Okada K,Minamino T,Tsukamoto Y,et al.Prolonged endoplasmic reticulum stress in hypertrophic and failing heart after aortic constriction:possible contribution of endoplasmic reticulum stress to cardiac myocyte apoptosis[J].Circulation,2004,110(6):705-712.
[7] Li S Y,Ren J.Cardiac overexpression of alcohol dehydrogenase exacerbates chronic ethanol ingestion-induced myocardial dysfunction and hypertrophy:Role of insulin signaling and ER stress[J].J Mol Cell Cardiol,2008,44(6):979-982.
[8] Zhao Z Q,Vinten-Johansen J.Myocardial apoptosis and ischemie preconditioning[J].Cardiovas Res,2002,55(3):438-455.
[9] 滕旭,齐永芬,唐朝枢.内质网应激与心脏疾病[J].生理科学进展,2009,40(2):106-109.
[10] Oyadomari S,Mori M.Roles of CHOP/GADD153in endoplasmic reticulum stress[J].Cell Death Differ,2004,11(4):381-389.
[11] Pahl H L.Signal transduction from the endoplasmic reticulum to the cellnucleus[J].Physiol Rev,1999,79(3):683-701.
[12] 孙蕾,陈蕾,尧青,等.H2O2在戊四氮致痫模型中对海马神经元兴奋毒性的影响[J].华中科技大学学报:医学版,2010,39(6):780-783.

