5-羟色胺1A受体激动剂高通量筛选模型的建立
孙 颖,蔡海燕,沈敬山,朱维良,王贺瑶,郭敏亮
(1.扬州大学生物科学与技术学院,江苏扬州 225009;2.中国科学院上海药物研究所,上海 201203)
抑郁症目前已成为世界第4大疾患,到2020年可能成为仅次于心脏病的第2大疾病[1]。研究表明,抑郁症主要是由于生活压力、基因遗传和一些易感因素所导致的[2]。国内外报道抑郁症患者中50% ~85%可反复发作,每年有15%的抑郁症患者自杀[3],因此抑郁症正成为全球公共健康中的一大主要问题。
5-HT1A受体是5-HT受体家族中第1个被克隆出来的亚型。人类遗传学和图像学研究表明5-HT1A受体与焦虑症、抑郁症、精神分裂症等一系列精神疾病有关,目前临床研究表明,其激动剂能有效改善抑郁症和焦虑症[4]。因此,开发和寻找5-HT1A受体的激动剂具有重要意义,而构建稳定表达人源5-HT1A受体是该受体激动剂筛选的重要方法和手段。
由于5-HT1A受体在胞内可以调节不同的信号通路,针对5-HT1A受体建立稳定细胞株的方法中目前主要有胞内钙信号和cAMP水平的测定[5]。本研究采用化学发光的方法测定胞内cAMP的水平以建立可用于高通量筛选5-HT1A受体激动剂的细胞模型。通过对模型建立过程中工具细胞、共转染质粒比例及化合物孵育时间等方面进行优化,确定模型建立的最佳条件。同时,为了验证化合物在稳定细胞株上的表现活性,实验针对几种经典的5-HT1A受体激动剂展开了相应的研究。
1 材料与方法
1.1 药物和试剂 质粒抽提试剂盒(QIAGEN公司);pcDNA3.1-h5-HT1A受体质粒和pcDNA3.1-pCRE-luc质粒(Stratagene公司);Fugene HD转染试剂(Roche公司);8-OH-DPAT(Tocris公司);Forskolin(Sigma公司);Steady-glo(Promega公司)。
1.2 主要仪器 Flex Station 3酶标仪(Molecular Devices公司);凝胶成像系统(上海天能科技有限公司);电泳设备(上海天能科技有限公司);冷冻离心机(Eppendorf公司);倒置显微镜(Olympus公司);二氧化碳培养箱(Thermo公司)。
1.3 细胞和细胞培养 人胚肾细胞HEK293和中国仓鼠卵巢细胞CHO-K1分别用含10%的胎牛血清(Fatal bovine serum,FBS)的H-DMEM培养基和F12培养基,置于37℃、5%CO2的细胞培养箱培养。
1.4 常规分子生物学方法 感受态细胞制备、质粒转化、质粒扩增和琼脂糖凝胶电泳等常规分子生物学方法参考分子克隆实验指南,第2版(科学出版社,1998)。质粒的抽提制备方法参考QIAGEN公司生产的试剂盒操作流程。
1.5 稳定表达人源5-HT1A受体细胞模型建立方法 实验采用荧光素酶报告基因活性检测方法,将HEK293细胞以2.5×108cells·L-1(每皿4 ml培养基)的密度接种于6 cm培养皿中,37℃、5%CO2条件下培养,当细胞汇合率达到50% ~70%时,pcDNA3.1-h5-HT1A质粒与 pcDNA3.1-pCRE-luc质粒共转染到细胞中继续培养24 h后,将细胞以不同比例稀释到10 cm培养皿中,24 h后加入G418进行筛选,每3天换液,培养基含有G418抗生素,2周后用滤纸片法挑选单克隆,用阳性化合物进行活性验证,根据信号值和信噪比的大小,选择阳性克隆扩大培养,连续传代,并检测活性,观察各代信号值和信噪比,挑选稳定的克隆培养,用于实验研究。
1.6 活性检测方法 细胞接种于96孔板培养24 h,加入5 μmol·L-1Forskolin孵育30 min,然后加入不同浓度的阳性化合物,置于37℃、5%CO2的细胞培养箱继续孵育6 h后,用Steady-glo试剂盒在Flex Station 3酶标仪上检测荧光信号强度。
1.7 统计学处理 实验数据使用GraphPad Prism 5软件处理,剂量依赖曲线通过非线性回归分析中Dose-response-Inhibition的公式拟合而成,进而计算IC50。
2 结果
5-HT1A受体在细胞中主要有cAMP信号通路和磷脂酰肌醇信号通路,前者受体下游偶联Gi蛋白,影响cAMP水平;后者受体偶联Gq蛋白,引起胞内外钙流变化,可采用检测胞内钙离子浓度的方法[6]。本实验采用化学发光的方法检测胞内cAMP,从而检测受体的活性状态。
2.1 工具细胞的选择 建立稳定表达5-HT1A受体的细胞株首先应选择合适的工具细胞。实验室常用的工具细胞有CHO-K1和HEK293。本实验以检测到的化学发光信号强度和灵敏度为指标对两种细胞进行比较和选择。将细胞接种于96孔板中,并对接种密度进行了摸索,CHO-K1细胞接种密度为20 000个/孔,HEK 293细胞接种密度为25 000个/孔(每孔100 μl)。Fig 1显示,A组为质粒瞬转CHO-K1细胞,B组为质粒瞬转HEK 293细胞;与A组相比,B组加阳性激动剂APD356刺激后信噪比较高,因此,在本实验中选择HEK 293细胞作为工具细胞来建立稳转细胞株。

Fig 1 Effect of APD356 acting on two different cells
2.2 质粒共转比例摸索与克隆挑选 为了获得更高的信噪比和灵敏度,实验对h5-HT1A受体质粒和报告基因pCRE-luc质粒共转比例进行了探索。实验设5组转染比例,pcDNA3.1-h5-HT1AR:pcDNA3.1-pCRE-luc分别为 1 ∶1,1 ∶2,1 ∶3,1 ∶4,1 ∶5,结果表明,在阳性激动剂 APD356的刺激下,各组转染比例结果相近,但相对而言,当pcDNA3.1-h5-HT1AR:pcDNA3.1-pCRE-luc比例为1∶3时化合物作用后信噪比最好,为3倍左右,而其他比例为2倍左右(Fig 2)。因此在后面的研究中选择两者的转染比例为1∶3。按上述转染比例进行稳转,挑选到了4个较好的克隆(Fig 3),其中8号和24号信噪比较高,有4~5倍,从而进行扩大培养,而8号克隆在连续传代培养过程中信号逐渐降低,24号克隆信号稳定,因此本实验选择24号克隆进行下一步的研究。
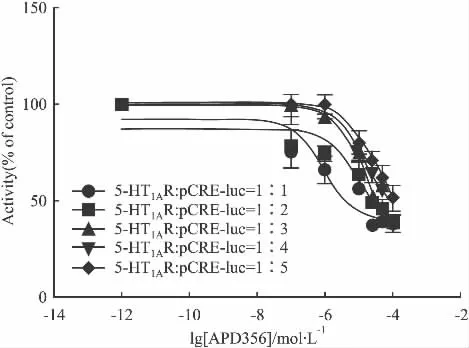
Fig 2 Effect of different plasmid ratios(±s,n=3)
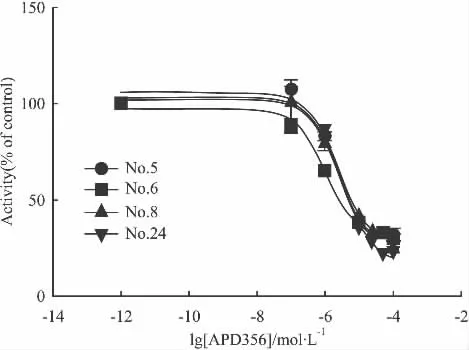
Fig 3Activity of four stable line cells(±s,n=3)
2.3 化合物孵育时间的摸索 由于胞内cAMP的水平调控下游报告基因pCRE-luc的表达,而后者的蛋白质表达水平因时间而变化,因此,为了得到最优检测结果,实验选取了1~7 h的化合物孵育时间进行信号强度检测和比较。具体的细胞转染以及检测过程见实验方法,阳性化合物为25 μmol·L-1的APD356。实验结果表明化合物孵育时间在1~5 h随时间越长作用效果越明显,而信号值在5~7 h内稳定,因此本实验选择最佳孵育时间为6 h(Fig 4)。
2.4 不同激动剂对信号的影响 cAMP信号通路中,5-HT1A受体下游偶联Gi蛋白,在激动剂作用下,胞内cAMP水平降低。而在本实验的体系中,胞内cAMP水平通过报告基因的表达水平得以体现,即当激动剂作用于受体时,报告基因luciferase的表达下降。实验选取了4种经典的5-HT1A受体激动剂进行研究。
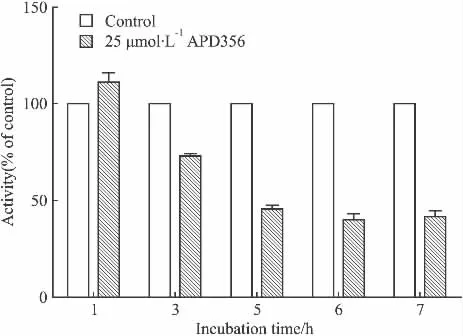
Fig 4 Effect of APD356 with different incubation time
2.4.1 5-HT.HCl5-羟色胺俗称血清素,既是一种重要的神经递质,又是一种血管活性物质,它为5-HT受体的内源性配体。5-HT1A受体偶联Gi蛋白,理论上与其激动剂结合后使cAMP水平降低,但选择5-HT.HCl为阳性药时空白组(加Forskolin)数值较加药组低,即加药组cAMP水平却升高,Fig 5显示 EC50为(532.5 ±1.8)nmol·L-1,与理论推测结果相反,这一结果可能是由于工具细胞HEK 293上存在内源型5-HT受体的其它亚型,这些亚型在5-HT.HCl的刺激下可以升高胞内cAMP水平,而这些亚型对cAMP水平的影响大于5-HT1A受体,因此,最终综合的胞内cAMP水平表现为升高。
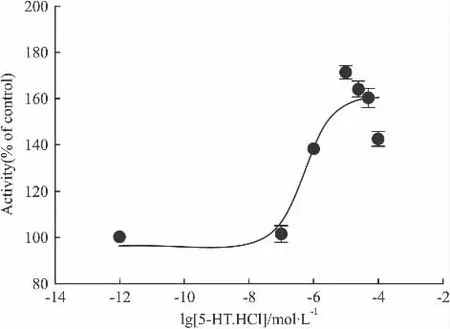
Fig 5 Activity of agonist 5-HT.HCl(±s,n=3)
2.4.2 Flibanserin Flibanserin 为 5-HT1A受体的选择性激动剂,同时是5-HT2A受体的拮抗剂,实验结果表明空白组(加Forskolin)数值较加药组高,而加入不同浓度的化合物于细胞中却发现细胞有不同程度的损伤(Fig 6),因此Flibanserin可能对HEK 293细胞具有毒性。为了验证这一作用,用四甲基偶氮唑盐比色法(MTT),检测了Flibanserin对HEK 293细胞活力的影响。结果显示Flibanserin浓度大于10 μmol·L-1时抑制了HEK 293细胞的生长(Fig 7),而其它几个阳性化合物并没有明显的细胞毒性。因此这个阳性化合物不适合用于以HEK 293细胞作为工具细胞的5-HT1A受体稳定细胞株。
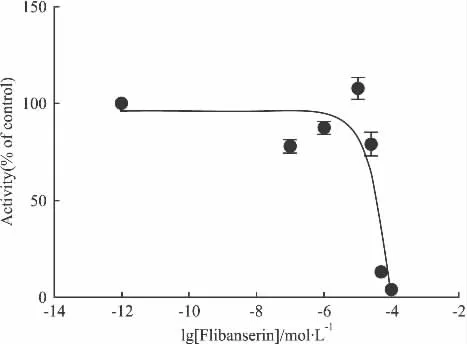
Fig 6Activity of agonist Flibanserin(±s,n=3)
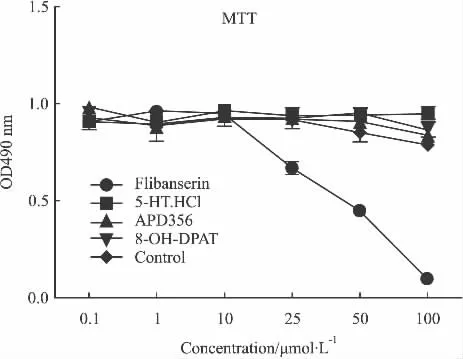
Fig 7Absorbance value of different agonists(±s,n=3)
2.4.3 Lorcaserin(APD356)据文献报道,Lorcaserin(APD356)是5-HT2C受体的激动剂[7],同时 APD356也是5-HT1A受体、5-HT6受体和5-HT7受体的激动剂,它对3者的活性值 Ki值分别为:0.7、2 和 0.64 μmol·L-1[8]。根据文献调研,HEK293细胞上并不存在内源型表达的5-HT2C受体和5-HT1A受体,而内源型表达的5-HT6受体和5-HT7受体偶联Gs蛋白,能使cAMP水平升高[9]。实验结果表明阳性化合物APD356作用于HEK-293-h5-HT1A受体细胞,在Forskolin存在下,剂量依赖性的降低 cAMP信号,IC50为(6.6±1.5)μmol·L-1(Fig 8)。因此,APD356 主要在 5-HT1A受体上发挥了作用,同时也说明了外源转入的5-HT1A受体水平远高于5-HT6受体和5-HT7受体。因此,在该体系中APD356可作为阳性化合物。
2.4.4 8-OH-DPAT 8-OH-DPAT 为 5-HT1A受体的激动剂,文献报道,在Forskolin或其他物质刺激下,5-HT1A受体激动剂在不同细胞中,cAMP变化水平不同[10-11]。本实验以HEK 293细胞作为工具细胞建立的细胞株上发现在Forskolin刺激的情况下,8-OH-DPAT并没有明显的激动作用(Fig 9);而在无Forskolin刺激的情况下,8-OH-DPAT能剂量依赖性地增加本底cAMP的水平(Fig 10),与5-HT1A受体偶联Gi蛋白,受激动后会降低胞内cAMP水平这一机制现象相反。同时,以CHO-K1为工具细胞重复了这一实验,却发现并无此现象,因此推测这一现象与细胞本身有关。研究者发现8-OH-DPAT同时也是5-HT7受体的中等强度的激动剂,而HEK 293细胞内源表达的5-HT7受体偶联Gs蛋白,与配体结合后,增加本底cAMP水平,与对5-HT1A受体的作用相反。然而在上面实验中我们推断外源转入的5-HT1A受体表达水平远高于5-HT7受体,因此,8-OH-DPAT在 HEK 293-h5-HT1A受体细胞中的作用可能还存在其他机制。
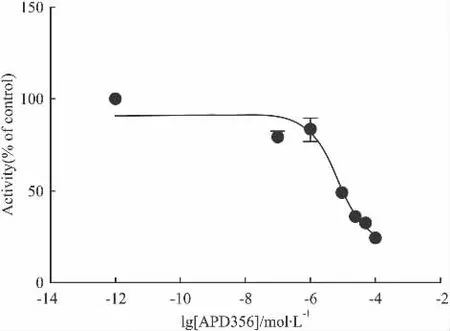
Fig 8Activity of agonist APD356(±s,n=3)
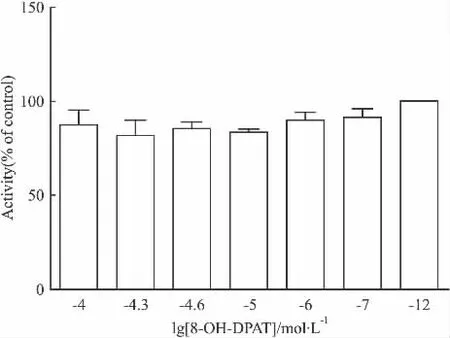
Fig 9Activity of agonist 8-OH-DPAT(±s,n=3)
总结以上结果,在建立稳转细胞株时为了排除工具细胞内源表达的蛋白带来的干扰,需要选择合适的阳性化合物进行验证。在本实验中建立的HEK293-h5-HT1A受体细胞株可选用APD356可作为阳性化合物。
2.5 稳定细胞株的建立和化合物筛选 综合以上优化条件,建立了稳定表达5-HT1A受体细胞株(HEK293-h5-HT1AR),该细胞株连续传代12代,信号值和信噪比较稳定。Fig 11显示了激动剂APD356对5-HT1A受体的激动作用。利用该稳定细胞模型,对实验室的60多个化合物进行了筛选,并对活性化合物在只转染pcDNA3.1-pCRE-luc质粒的HEK293空细胞上进行了验证,结果显示化合物96H在HEK293-h5-HT1AR细胞株上显示对5-HT1A受体有激动效应,IC50为(4.3 ±1.5)μmol·L-1,而在无受体转染的空细胞上没有明显作用(Fig 12),初步判定该化合物可能是5-HT1A受体激动剂。
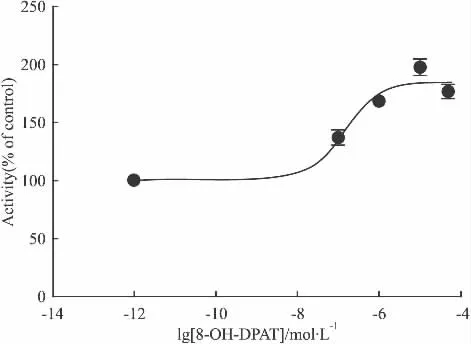
Fig 10 Activity of agonist 8-OH-DPAT without Forskolin(±s,n=3)
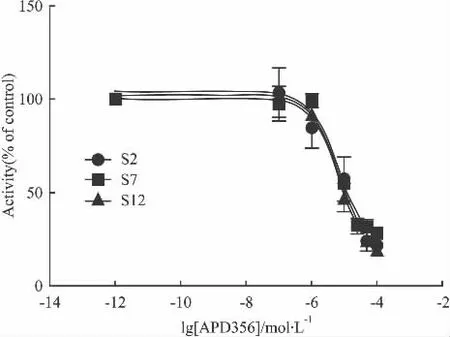
Fig 11 Activity of APD356 in different generations of stable line cells(±s,n=3)
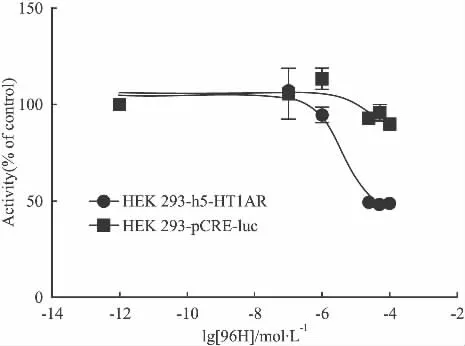
Fig 12 Activity of compound 96H
3 讨论
抑郁症已成为是一种因脑生化改变所致的疾病,临床表现为情绪低落、悲观、睡眠障碍,严重者有自伤和自杀冲动。中枢去甲肾上腺素、5-羟色胺、多巴胺等单胺类神经递质含量过低及其受体功能低下等都被认为是引起抑郁症的原因[12]。抗抑郁药是目前治疗抑郁症最常规的处方药。用于抑郁症治疗的药物主要有3类:(1)三环类抗抑郁药(TCA);(2)单胺氧化酶抑制剂(MAOI);(3)选择性5-HT再摄取抑制剂(SSRI)[12]。但是这3类药物都有各自的不足之处,因此开发研究新型抗抑郁药迫在眉睫。
动物水平研究发现,5-HT1A受体调节抑郁和焦虑行为,其受体敲除(KO)的小鼠模型在整个生命周期中都表现出焦虑和抑郁现象[13]。5-HT1A受体是一个重要的靶标,它在精神疾病如抑郁症焦虑症的治疗过程中发挥着重要作用。5-HT1A受体与激动剂结合后,可以降低精神紊乱现象,因此,5-HT1A受体激动剂的研究具有重大开发价值。
在新药研发过程中,构建高通量筛选模型对新药的发现起着至关重要的作用,它直接影响着药物研发的速率[14]。对于5-HT1A受体,由于其在胞内可以调节不同的信号通路,针对5-HT1A受体建立稳定细胞株的方法中目前主要有胞内钙信号和cAMP的测定。在cAMP信号通路中,5-HT1A受体下游偶联Gi蛋白,激动剂与受体结合后能降低胞内cAMP水平,从而降低报告基因pCRE-luc的表达。基于这一原理,本实验通过化学发光的方法建立了稳定表达5-HT1A受体的细胞株,同时对筛选体系进行了优化。首先,根据检测得到的信号值和灵敏度确定了工具细胞类型和质粒转染比例;其次,由于在cAMP的刺激下报告基因pCRE-luc的表达量受时间的影响,实验比较了化合物不同的孵育时间对信号的影响,选择了最优化合物孵育时间为6 h;最后,在此次实验中发现,阳性化合物的选择至关重要,一方面要考虑该阳性化合物对于细胞的毒性,例如本实验中选择性激动剂Flibanserin,它对HEK-293具有细胞毒性,不适合作为阳性对照;另一方面还要考虑该化合物是否是该细胞其它内源型受体的配体以及其他因素的干扰,例如5-HT1A受体的激动剂8-OH-DPAT,在实验过程中发现并没有出现预想的实验现象,其原因可能是受内源表达5-HT7受体和其他因素的影响,显然该化合物不适用于在该体系中作为阳性化合物。总结以上各种因素,实验确定了最佳条件:选择HEK-293为工具细胞,5-HT1A受体和pCRE-luc质粒的转染比例为1∶3,而化合物的孵育时间选择6 h,阳性化合物选择APD356。
本研究表明在建立稳定株的过程中工具细胞的选择和阳性对照的选择相当重要,通过上述实验,我们成功地建立了一个稳定表达5-HT1A受体的细胞株并且确定了筛选平台的最佳条件。该稳定细胞株经多次传代验证该模型信号稳定,可用于高通量筛选。同时,基于这一模型,我们筛选了60多个化合物发现了一个5-HT1A受体激动剂,因此本研究对5-HT1A受体激动剂的发现和研究具有重要的参考意义。
[1]刘佳莉,苑玉和,陈乃宏.抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193-6.
[1]Liu J L,Yuan Y H,Chen N H.Research process in treatment of depression[J].Chin Pharmacol Bull,2011,27(9):1193-6.
[2]Richardson-Jones J W,Craige C P,Guiard B P,et al.5-HT1Aautoreceptor levels determine vulnerability to stress and response to antidepressants[J].Neuron,2010,65(1):40-52.
[3]刘效巍,许 晶.5-羟色胺受体与抑郁症[J].临床精神医学杂志,2002,12(6):375-6.
[3]Liu X W,Xu J.The serotonin receptor and depression[J].J Clin Psych,2002,12(6):375-6.
[4]Pucadyil T J,Kalipatnapu S,Chattopadhyay A.The serotonin1A receptor:a representative member of the serotonin receptor family[J].Cell Mol Neurobiol,2005,25(3-4):553-80.
[5]Khawaja X Z,Smith D L,Nawoschik S P,et al.WAY-100635 antagonist-induced plasticity of 5-HT1Areceptors:regulatory differences between a stable cell line and anin vivonative system[J].J Neurochemistry,2006,98(1):134-45.
[6]Albert P R,Lembo P,Storring J M,et al.The 5-HT1Areceptor:signaling,desensitization,and gene transcription[J].Neuropsychopharmacology,1996,14(1):19-25.
[7]Thomsen W J,Grottick A J,Menzaghi F,et al.Lorcaserin,a novel selective human 5-hydroxytryptamine2C agonist:in vitroandin vivopharmacological characterization[J].J Pharmacol Exp Ther,2008,325(2):577-87.
[8]U.S.Food and Drug Administration.Lorcaserin:receptor pharmacology,selectivity,and toxicology[J].Arena Pharm,2010.
[9]Johnson M S,Lutz E M,Firbank S,et al.Functional interactions between native Gs-coupled 5-HT receptors in HEK-293 cells and the heterologously expressed serotonin transporter[J].Cellular Signalling,2003,15(8):803-11.
[10]Javier M E,Oficialdegui A M,Silvia P S,et al.New 1-Aryl-3-(4-arylpiperazin-1-yl)propane Derivatives,with dual action at 5-HT1Aserotonin receptors and serotonin transporter,as a new class of antidepressants[J].J Med Chem,2001,44(3):418-28.
[11]Liu Y F,Ghahremani M H,Rasenick M M,et al.Stimulation of cAMP synthesis by Gi-coupled receptors upon ablation of distinct Gai protein expression[J].J Biol Chem,1999,274(23):16444-50.
[12]陈芳萍,李运曼,刘国卿.5-HT1A受体激动剂类抗抑郁药的研究与开发[J].药学进展,2003,27(4):213-6.
[12]Chen F P,Li Y M,Liu G Q.Research and development of 5-HT1Areceptor agonists,a new class of antidepressants[J].Progr Pharm Sci,2003,27(4):213-6.
[13]Heisler L K,Chu H M,Brennan T J,et al.Elevated anxiety and antidepressant-like responses in serotonin 5-HT1Areceptor mutant mice[J].Neurobiology,1998,95:15049-54.
[14]孙 哲,吕秋军.基于检测报告基因的药物筛选方法研究进展[J].中国药学杂志,2000,35(8):507-10.
[14]Sun Z,Liu Q J.Research progress of drug screening technology on reporter gene detection[J].Chin Pharm J,2000,35(8):507-10.

