内皮素-1活化ROCK/SLUG诱导人卵巢癌细胞发生上皮向间充质转分化
张阿丽,张 弓,彭 晋,王全胜,马 欢,钟亚华,周福祥,谢丛华
(1.武汉大学中南医院放化疗科,武汉大学中南医院肿瘤生物学行为湖北省重点实验室,湖北省肿瘤医学临床研究中心,湖北武汉 430071;2.华中科技大学同济医学院附属协和医院中西医结合科,湖北武汉 430022)
卵巢癌是妇科恶性肿瘤的首要致死原因,2010年美国新报告卵巢癌患者21 880人,全年有13 850例卵巢癌患者死亡[1]。上皮细胞向间充质细胞转型(epithelial to mesenchymal transition,EMT)可使癌细胞获得迁移、侵袭和转移的能力,从而在肿瘤转移中有重要的作用。因为内皮素-1(endothelin-1,ET-1)及内皮素受体(ETAR)在卵巢癌原发灶和转移灶中高表达[2],而且在肿瘤细胞中,ET-1/ETAR 自分泌通路通过诱导其纤维样和侵袭表型,从而促进肿瘤细胞EMT。ROCK为Rho GTPases的下游效应分子,可以调节细胞骨架的组装以及细胞黏附斑的形成,在EMT中起重要作用[3]。转录因子SLUG在卵巢癌细胞EMT中也起重要作用[4]。目前,ROCK与SLUG的关系,以及它们在ET-1诱导上皮卵巢癌细胞发生EMT中的作用还未见报道。本研究以人卵巢癌细胞SK-OV-3和CaOV3为研究对象,通过给予ET-1刺激或激活ROCK等,观察该细胞侵袭能力及EMT表型相关基因的改变以及转录因子SLUG的变化,探讨ROCK/SLUG通路在ET-1诱导上皮卵巢癌细胞EMT中的作用。
1 材料与方法
1.1 细胞与抗体 人卵巢癌细胞SK-OV-3,CaOV3购自武汉大学生物医学保藏中心,培养在含1% 青-链霉素和10%FBS的RPMI 1640(美国Invitro-gen公司)中。兔抗纤连蛋白(fibronectin,FN)抗体,鼠抗β-actin抗体和兔抗ROCK抗体(美国Santa Cruz公司),鼠抗 E-cadherin抗体(美国 Zymed公司)。
1.2 细胞免疫荧光染色 培养在含10%FBS的RPMI 1640中的SK-OV-3和CaOV3(1×105/孔)生长在盖玻片上24 h,无血清过夜后,用ET-1(美国MP Biomedicals公司)处理24 h,在-20℃用甲醇固定20 min,用5%正常羊血清封闭,β-tubulin抗体(美国Zymed公司,1∶100)4℃孵育过夜,PBS漂洗后,FITC标记的二抗室温孵育1 h后,用Nikon E-clipse E600荧光显微镜观察细胞形态及β-tubulin微管蛋白的表达,细胞核用PI染色。
1.3 Boyden小室体外侵袭实验 Boyden小室体外侵袭实验用于确定细胞的体外穿过基质胶Matrigel的能力,方法参见文献[5]。实验设计①:SK-OV-3和CaOV3无血清培养过夜后,用100 nmol·L-1ET-1刺激10 h后固定并用Diff-quick染色(美国VWR Scientific公司),每个孔计数5个视野的细胞数均数,每个孔设3个复孔。实验设计②:SK-OV-3和CaOV3无血清培养过夜后,用100 nmol·L-1ET-1刺激,同时加入ROCK抑制剂Y27632(LY),或单用ROCK显性激活的突变体转染,同时设无处理的细胞为对照组,24 h后固定并用Diff-quick染色(美国VWR Scientific公司),每孔计数5个视野的细胞均数,每个孔设3个复孔。
1.4 蛋白的提取和Western blot检测 实验设计①:SK-OV-3和CaOV3无血清培养过夜后,用100 nmol·L-1ET-1刺激24 h收集样本,以未刺激的细胞为对照组。用RIPA裂解液(美国Pierce公司)提取细胞蛋白,参照我们前期的方法[6],Western blot检测E-cadherin和纤连蛋白(fibronectin,FN)的表达;实验设计②:SK-OV-3和CaOV3种在6孔板中无血清过夜后,用100 nmol·L-1ET-1刺激,同时加入ROCK抑制剂Y27632(LY),或单用ROCK显性激活的突变体转染,同时设无处理的细胞为对照组。用RIPA裂解液(美国Pierce公司)提取细胞蛋白,参照我们前期的方法[6],Western blot检测ROCK和FN的表达。
1.5 总RNA提取和实时定量PCR检测 实验方案①:SK-OV-3和CaOV3种在6孔板中无血清过夜后,用100 nmol·L-1ET-1 刺激,分别在 0,3,6,12,24 h收集细胞,检测SLUG、Snail和Twist转录水平;实验方案②:SK-OV-3和CaOV3种在6孔板中无血清过夜后,用100 nmol·L-1ET-1刺激,同时加入或不加 1 μmol·L-1ET-1 受体拮抗剂(endothelin A receptor,ETAR)(美国 Calbiochem 公司),24 h 后收集细胞,检测SLUG转录水平;实验方案③:SK-OV-3和CaOV3种植在6孔板中无血清过夜后,转染ROCK的显性激活突变体后,分别在0,24,48,72 h收集细胞,检测SLUG和E-cadherin的转录水平。
用TRIzol试剂(美国Gibco公司)提取细胞的总RNA。总RNA用RNA逆转录酶(美国Invitrogen公司)逆转录,并在第1链CDNA中加入寡核苷酸引物。应用SYBR-Green的方法进行real-time PCR,以GAPDH为内参照。PCR条件:95℃ 1 min,55℃ 1 min,and 72℃ 1 min,30个循环。引物序列如下:GAPDH:sense 5'-TTAGCACCCCTGGCCAAGG-3'Antisense5'-CTTACTCCTTGGAGGCCATG-3';SLUG:sense5'-TGATGAAGAGGAAAGACTACAG-3'antisense5'-GCTCACATATTCCTTGTCACAG-3';Snail:sense 5'-CGAAAGGCCTTCAACTGCAAAT-3'antisense 5'-ACTGGTACTTCTTGACATCTG-3';TWIST:sense 5'-GGAGTCCGCAGTCTTACGAG-3'Antisense 5'-TCTGGAGGACCTGGTAGAGG-3';ROCK:sense 5'-GATGGATTGGATGCTTTGGTTTA-3'Antisense5'-GCTGAACAACCCAAGGACTA-3';E-cadherin:sense 5'-AGAATGACAACAAGCCCGAAT-3'antisense 5'-CGGCATTGTAGGTGTTCACA-3'。
1.6 报告基因分析 SK-OV-3和CaOV3种在6孔板中无血清过夜后,瞬时转染1.5 μg含SLUG启动子的pGL3 basic质粒与15 ng Renilla质粒(promega)。它们共转染 ROCK的显性激活突变体[7](由美国宾西法尼亚大学生物工程系Chen CS教授惠赠)或者与ROCK抑制剂Y27632共同孵育。24 h后,使用荧光素酶报告检测试剂盒 (美国Promega公司)检测荧光素酶与Renilla的荧光值,用Luciferase荧光值/Renilla荧光值代表荧光素酶的活性。结果以±s表示,每组实验重复3次。
2 结果
2.1 ET-1诱导SK-OV-3和CaOV3细胞形态,βtubulin微管蛋白,以及EMT标志蛋白的变化 用100 nmol·L-1ET-1孵育 SK-OV-3和 CaOV3细胞24 h,共聚焦显微镜观察胞质中β-tubulin微管蛋白的变化。发现细胞失去上皮细胞的形态而变得有较长,较多的伪足,胞质中β-tubulin微管蛋白(免疫荧光染色为绿色)被拉长,呈现为纤维细胞的表型(Fig 1A)。Boyden小室体外侵袭实验表明暴露给ET-1增加了细胞的体外侵袭力(Fig 1B);给予100 nmol·L-1ET-1刺激SK-OV-3和CaOV3细胞24 h,发现ET-1处理后Fibronectin表达量增加,是对照组的3倍多;而E-cadherin的表达降低。这些结果表明ET-1刺激影响了SK-OV-3和CaOV3 EMT基因的表达变化以及EMT相关形态的改变(Fig 1C)。
2.2 ET-1促进SK-OV-3和CaOV3细胞转录因子SLUG的转录 在ET-1诱导SK-OV-3和CaOV3细胞EMT的同时,我们用实时定量PCR检测E-cadherin的转录抑制因子如SLUG、Twist及Snail的表达变化。如Fig 2A和B,ET-1刺激24 h后,SLUG mRNA表达水平增加,但是Snail mRNA的水平没有变化,而Twist mRNA水平下降。为了进一步证实ET-1对SLUG mRNA的表达影响,我们分析了给予100 nmol·L-1ET-1 处理细胞 3、6、12、24 h 不同时间点情况下,SLUG mRNA的表达。结果发现ET-1作用3 h后SLUG mRNA水平即开始增加,在24 h时达到了最高点。而且,ET-1诱导SLUG mRNA的增加可以完全被ETAR拮抗剂BQ123所阻断(Fig 2C和D)。这些结果表明在E-cadherin 3个主要的转录抑制因子中,SLUG是唯一一个能被 ET-1/ETAR刺激信号上调的因子。
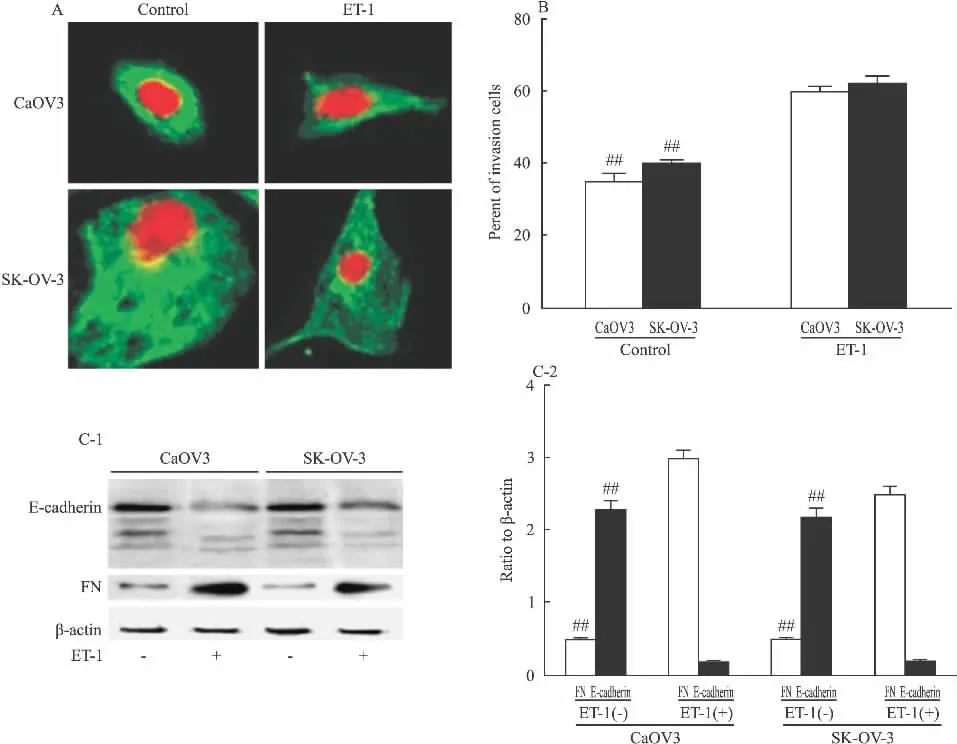
Fig 1 ET-1 induced morphologic and related gene changes of EMT in CaOV3 and SK-OV-3 cells
2.3 ET-1活化 ROCK 促进 SK-OV-3和 CaOV3细胞EMT 为探讨ET-1是否通过活化ROCK促进SK-OV-3和CaOV3细胞EMT,我们用ET-1或ET-1联合ROCK抑制剂Y27632或联合使用ROCK的显性激活突变体处理SK-OV-3和CaOV3细胞后检测ROCK和间充质标记基因Fibronectin蛋白表达。如Fig 3A和B所示,在未处理组细胞,ROCK和Fibronectin的蛋白表达水平较低,当ET-1处理后,ROCK和Fibronectin蛋白表达水平迅速升高;ROCK抑制剂Y27632能抑制ET-1对ROCK和Fibronectin蛋白表达的促进作用。而当ET-1与ROCK显性激活突变体联合使用时,ROCK和Fibronectin蛋白表达明显增加;如Fig 3C所示,Boyden小室体外侵袭实验表明:ET-1处理SK-OV-3和CaOV3细胞后,其侵袭力明显增加,而ROCK的抑制剂Y27632能抑制其增加,转染ROCK显性激活突变体能促进ET-1诱导的侵袭力增加。这些结果表明,ET-1通过活化ROCK诱导SK-OV-3和CaOV3细胞发生EMT,增强其侵袭力。
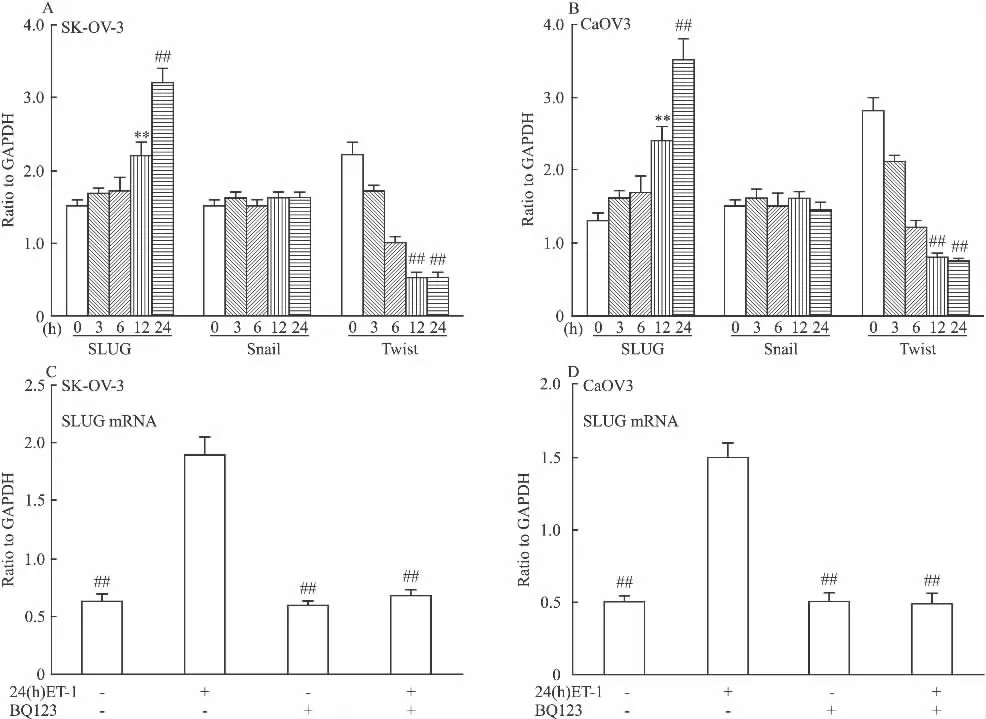
Fig 2 ET-1 increases the level of SLUG mRNA in SK-OV-3 and CaOV3 cells
2.4 ROCK上调 SK-OV-3和 CaOV3细胞中SLUG的转录启动子活性,促进SLUG转录,抑制E-cadherin转录 由于ROCK与上皮性肿瘤细胞的侵袭相关,我们假设ROCK可能在转录水平激活SLUG并抑制上皮细胞标志基因E-cadherin转录。如Fig 4A和B,实时定量PCR结果提示,ROCK显性激活突变体转染后24 h,SLUG mRNA水平增加,在转染后48 h达到最高,同时E-cadherin mRNA减少;为确定SLUG是否为ROCK的下游靶基因,我们克隆SLUG启动子序列到荧光素酶(luciferase)基因的上游。荧光素酶分析提示,ROCK激活引起SLUG启动子活性增加2.5倍,ROCK抑制剂Y27632的明显减少了SLUG启动子活性(Fig 4C)。该结果表明,ROCK通过上调SLUG启动子活性增加了SLUG的转录水平。

Fig 3 ET-1 induced EMT of CaOV3 and SK-OV-3 cells by active ROCK(±s,n=3)
3 讨论
约80%的卵巢癌为上皮来源的,上皮性卵巢癌被认为是由正常卵巢上皮转型而来,具有高度的侵袭和转移能力。当上皮性肿瘤获得侵袭表型即向间充质细胞表型转化,此病理过程称为EMT。EMT促进了肿瘤细胞的运动和侵袭,是与肿瘤进展及转移相关的重要细胞过程。
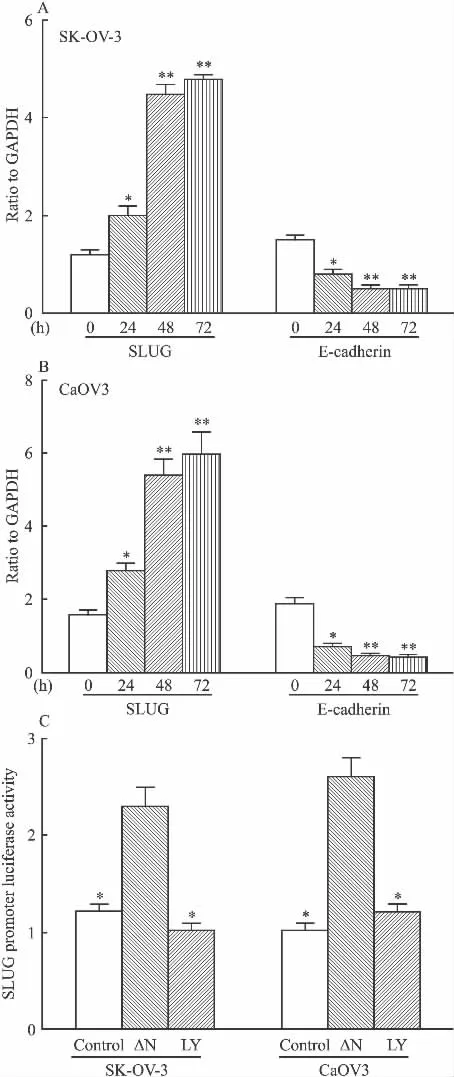
Fig 4 ROCK increases SLUG mRNA synthesis by up-regulation of SLUG promoter activity,and then inhibits E-cadherin mRNA in CaOV3 and SK-OV-3 cells(±s,n=3)
基于以下证据,本研究首次报道 ET-1活化ROCK/SLUG通路,诱导人卵巢癌细胞发生EMT。①ET-1与细胞ETAR结合,改变了许多关键基因的表达,包括下调上皮细胞标志蛋白E-cadherin的表达,上调间充质细胞标志蛋白Fibronectin的表达,同时增强人卵巢癌细胞的侵袭力。②ET-1诱导了E-cadherin的主要抑制基因SLUG的转录和SLUG蛋白的表达;而且,ETAR拮抗剂BQ123消除了ET-1对SLUG的诱导作用。③ ET-1通过活化ROCK信号诱导人卵巢癌细胞EMT发生。因为转染ROCK显性激活突变体可与ET-1共同诱导EMT,反之,ROCK抑制剂Y27632,阻断了ET-1对EMT的诱导作用。④ROCK通过上调SLUG基因转录启动子活性促进SLUG基因的转录,同时抑制上皮细胞标志E-cadherin的转录。这些表明在ET-1诱导人卵巢癌细胞发生EMT过程中,SLUG是ROCK下游靶基因,ROCK/SLUG通路在ET-1诱导人卵巢癌细胞发生EMT中起重要作用。因为上皮性肿瘤进展的两个基本特征是丧失正常上皮的结构以及和微环境的相互作用[3],所以本研究阐明了ET-1是通过活化ROCK/SLUG信号通路,从而促进人卵巢癌细胞发生EMT以及恶性进展与转移。
E-cadherin的功能缺失被认为是EMT的关键步骤。E-cadherin的缺失也导致上皮级性的完全丧失。E-cadherin的缺失可因基因突变,染色体缺失,蛋白酶的剪切或者上皮cadherin基因(epithelial cadherin gene,CDH1)启动子的沉默而引起[8]。CDH1启动子的沉默可因DNA高度的甲基化而引起或者转录因子如SLUG,Snail Twist与CDH1启动子区的E-box结合而抑制 CDH1启动子的活性[9-11]。SLUG、Snail为锌指结合蛋白,属于 Snail超家族成员[12]。在上皮细胞中外源性表达SLUG,Snail会引起EMT,表现为迁移和侵袭特征,此现象在卵巢癌中也观察到[4]。本研究表明,ET-1诱导人卵巢癌细胞发生EMT时,伴有SLUG mRNA的上调,但是Snail mRNA的表达没有变化。虽然两个转录因子来自于相同的家族,但是可能会在不同的肿瘤环境和特殊的细胞类型中发挥不同的作用[9]。
Rho/ROCK信号通路涉及到多种癌细胞的运动和侵袭[13-14],包括人卵巢癌细胞[15-16]。SLUG 可以抑制上皮细胞表型基因 Cadherin的表达[17],促进间充质细胞表型基因如 Fibronectin的表达[18]。本研究发现,ET-1诱导 SLUG蛋白的表达可由ROCK抑制剂Y27632所逆转,相反,ROCK的显性激活突变体可与ET-1协同增加SLUG的表达,而且ROCK活化能上调SLUG基因的转录;本研究也观察到ROCK抑制剂Y27632或ROCK的显性激活突变体可以调节人卵巢癌细胞EMT相关蛋白如E-cadherin、Fibronectin的表达。
总之,本研究显示,ET-1通过活化ROCK/SLUG信号通路,从而促进人卵巢癌细胞发生EMT,这表明抑制ROCK/SLUG活化,有可能逆转人卵巢癌的侵袭与转移。
[1]Jemal A,Siegel R,Xu J,Ward E.Cancer statistics,2010[J].Cancer J Clin,2010,60(5):277-300.
[2]Salani D,Di Castro V,Nicotra M R,et al.Role of endothelin-1 in neovascularization of ovarian carcinoma[J].Am J Pathol,2000,157(5):1537-47.
[3]Bhowmick N A,Ghiassi M,Bakin A,et al.Transforming growth factor-beta1 mediates epithelial to mesenchymal transdifferentiation through a RhoA-dependent mechanism[J].Mol Biol Cell,2001,12(1):27-36.
[4]Kurrey N K,K A,Bapat S A.Snail and Slug are major determinants of ovarian cancer invasiveness at the transcription level[J].Gynecol Oncol,2005,97(1):155-65.
[5]Cano A,Pérez-Moreno M A,Rodrigo I,et al.The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression[J].Nat Cell Biol,2000,2(2):76-83.
[6]王全胜,张阿丽,李仁康,等.高糖通过SGK1通路促进人肾小球系膜细胞合成结缔组织生长因子[J].中国药理学通报,2007,23(8):1015-20.
[6]Wang Q S,Zhang A L,Li R K,et al.High glucose stimulates synthesis of CTGF in HMC via SGK1 signaling pathway[J].Chin Pharmacol Bull,2007,23(8):1015-20.
[7]Bhadriraju K,Yang M,Alom Ruiz S,et al.Activation of ROCK by RhoA is regulated by cell adhesion,shape,and cytoskeletal tension[J].Exp Cell Res,2007,313(16):3616-23.
[8]Li Q,Mattingly R R.Restoration of E-cadherin cell-cell junctions requires both expression of E-cadherin and suppression of ERK MAP kinase activation in Ras-transformed breast epithelial cells[J].Neoplasia,2008,10(12):1444-58.
[9]Bolós V,Peinado H,Pérez-Moreno M A,et al.The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions:a comparison with Snail and E47 repressors[J].J Cell Sci,2003,116(Pt 3):499-511.
[10]Batlle E,Sancho E,Francí C,et al.The transcription factor snail is a repressor of E-cadherin gene expression in epithelial tumour cells[J].Nat Cell Biol,2000,2(2):84-9.
[11]Yang J,Mani S A,Donaher J L,et al.Twist,a master regulator of morphogenesis,plays an essential role in tumor metastasis[J].Cell,2004,117(7):927-39.
[12]Nieto M A.The snail superfamily of Zinc-finger transcription factors[J].Nat Rev Mol Cell Biol,2002,3(3):155-66.
[13]Itoh K,Yoshioka K,Akedo H,et al.An essential part for Rho-as-sociated kinase in the transcellular invasion of tumor cells[J].Nat Med,1999,5(2):221-5.
[14]Manning TJ Jr,Parker J C,Sontheimer H.Role of lysophosphatidic acid and rho in glioma cell motility[J].Cell Motil Cytoskeleton,2000,45(3):185-99.
[15]Sawada K,Morishige K,Tahara M,et al.Alendronate inhibits lysophosphatidic acid-induced migration of human ovarian cancer cells by attenuating the activation of rho[J].Cancer Res,2002,62(21):6015-20.
[16]Zhao Y,Zong Z H,Xu H M.RhoC expression level is correlated with the clinicopathological characteristics of ovarian cancer and the expression levels of ROCK-I,VEGF,and MMP9[J].Gynecol Oncol,2010,116(3):563-71.
[17]Park S H,Cheung L W,Wong A S,et al.Estrogen regulates Snail and Slug in the down-regulation of E-cadherin and induces metastatic potential of ovarian cancer cells through estrogen receptor alpha[J].Mol Endocrinol,2008,22(9):2085-98.
[18]Olmeda D,Montes A,Moreno-Bueno G,et al.Snai1 and Snai2 collaborate on tumor growth and metastasis properties of mouse skin carcinoma cell lines[J].Oncogene,2008,27(34):4690-701.

