改性铝土矿载体负载Ru催化剂上的水煤气变换制氢
江莉龙 马永德 曹彦宁 杨 阳 魏可镁
(福州大学化肥催化剂国家工程研究中心,福州350002)
改性铝土矿载体负载Ru催化剂上的水煤气变换制氢
江莉龙*马永德 曹彦宁 杨 阳 魏可镁
(福州大学化肥催化剂国家工程研究中心,福州350002)
采用水热法对天然铝土矿进行改性,获得高比表面积的铝土矿(bauxite)载体.用等体积浸渍法制备了Ru含量为1.0%-4.0%(质量分数,下同)的Ru/bauxite催化剂和Ru含量为2.0%的Ru/Al2O3催化剂,以水煤气变换反应为探针反应,考察了催化剂性能.利用X射线荧光元素分析(XRF)、X射线粉末衍射(XRD)、低温N2物理吸附、H2程序升温还原(H2-TPR)以及CO程序升温脱附(CO-TPD)等对载体和催化剂样品进行表征.结果表明,不同Ru含量的Ru/bauxite催化剂具有优异的水煤气变换制氢性能,优于Ru/Al2O3催化剂.其原因是铝土矿本身含有的Fe2O3与负载的Ru之间发生了相互作用,降低了Fe2O3还原温度,提高了对CO的吸附能力且降低了CO的脱附温度,进而提高了催化剂的水煤气变换反应性能.
∗Corresponding author.Email:jll@fzu.edu.cn;Tel:+86-591-83731234-8201.
The project was supported by the Natural Science Foundation of Fujian Province,China(2011J01036),Foundation of Fujian Provincial Department of Education,China(JA09012),Talents Foundation of Fuzhou University,China,and Technology Development Foundation of Fuzhou University,
China(2010-XQ-05).
福建省自然科学基金(2011J01036),福建省教育厅基金(JA09012),福州大学人才启动基金及福州大学科技发展基金项目(2010-XQ-05)资助
铝土矿;Ru/铝土矿催化剂;水煤气变换;制氢
1 引言
烃类化合物的水蒸汽重整与水煤气变换反应组合是廉价制取氢气的主要方式.经过90多年的研究和实践,工业化的铁铬系、铜锌系和钴钼系等变换催化剂已基本定型.近年来车用质子交换膜燃料电池(PEMFC)的兴起,使传统的水煤气变换反应得到了新的应用.1-3然而现有的铁铬系、铜锌系和钴钼系等变换催化剂固有的缺点很难满足PEMFC体系对水煤气变换催化剂的要求.4-6
针对这一情况,国内外对新型水煤气变换催化剂,特别是变换催化剂的载体进行了大量的研究. Panagiotopoulou等7研究了一系列以Pt、Rh、Ru和Pd等为活性组分负载于不同载体上的水煤气变换催化剂,以CO转换频率来评价其活性,发现催化剂的活性并不是由活性组分的负载量、分散度和晶粒度决定,很大程度上是由载体的性质决定.特别是对于Ru和Pt催化剂,将它们负载于“可还原型”载体(TiO2,CeO2,La2O3和YSZ)上的活性要比在“非还原型”载体(Al2O3,MgO和SiO2)上高1-2个数量级.因此,在变换催化剂载体的研究中,主要集中在具有氧化还原性质的金属氧化物,如Fe2O3、8,9La2O3、10,11CeO2、11-14ZrO215-17等,这些金属氧化物具有可产生介稳态吸附氧原子和氧化被吸附的CO并放出氢的功能,可用于燃料电池变换催化体系的负载型金属催化剂载体.而对于活性组分Ru的研究中,Domka等18最早开始研究Ru/Fe2O3的催化性能,对Ru/Fe2O3及将Ru负载在其它载体的催化剂制备方法和性能进行了详细的研究,认为Ru/Fe2O3保持了铁系高温变换催化剂原有的耐热性,并显示出更好的低温活性.Utaka等19比较了Ru负载于CeO2、La2O3、MgO、Nb2O3、Ta2O5、TiO2、V2O5、ZrO2的水煤气变换催化活性,在400°C用H2还原后,其中以Ru/V2O5活性最高,且没有甲烷生成.华南平等20采用溶胶法制备RuO2溶胶,然后以MgAl2O4为载体,用一步沉淀法制备了嵌埋式纳米Ru.表征结果说明,Ru纳米粒子均匀分散在载体内部,催化反应活性中心通过载体上形成的细微孔道与反应物接触,向催化剂中添加适量的K2O和La2O3助剂可以有效地提高其催化活性.
上述研究均是将Ru制成超细粒子高度分散负载于高熔点氧合物载体上来提高其耐热性并保持其活性,这些研究均是通过人工设计、调控合成具有不同纳米粒径、形貌的载体和催化剂,而利用天然矿物载体负载Ru制备该类型催化剂研究相对较少.天然铝土矿比表面积低,难以将其直接作为催化剂的载体.但因其含有的不同化学成分可将其改性为催化剂载体的天然条件,如Al2O3具有大比表面积的特性,SiO2对改善氧化铝的热稳定性具有很好的功效,而含有的Fe2O3是许多化学反应的催化剂,其它一些成分如TiO2、MgO可作为某些催化剂的天然助剂.为此,本论文利用天然铝土矿,采用水热法对天然铝土矿进行改性,获得了高比表面积的铝土矿.并以其为载体,以Ru为活性组分,等体积浸渍法制备了不同Ru含量的Ru/铝土矿催化剂,应用于水煤气变换反应中.期望提供一种新的水煤气变换制氢催化剂的简便方法.
2 实验部分
2.1 载体及催化剂的制备
载体制备:采用福建省漳浦县的天然铝土矿,筛分成0.838-0.889 mm的颗粒,称取30 g,用蒸馏水清洗表面的粉尘后,置于100 mL带聚四氟乙烯内衬的高压反应釜内,加入50 mL去离子水.经170°C水热反应48 h后,冷却,过滤,110°C干燥4 h.冷却,置于马弗炉中,550°C焙烧4 h后,冷却,得到改性后铝土矿,标记为bauxite.
催化剂制备:在室温下将改性后铝土矿作为载体,用一定浓度的RuCl3(分析纯,昆明贵研铂业股份有限公司)水溶液进行等体积浸渍,然后在红外灯下80-120°C照射60 min,烘干后,制得金属Ru的理论含量分别为1%、2%、3%和4%(质量分数,以空白载体为基准)的Ru/bauxite催化剂.所得催化剂记为Ru1、Ru2、Ru3和Ru4.采用Al2O3(工业级,中国铝业山东铝业分公司)作载体制备2%Ru/Al2O3催化剂作为活性对比样品.
2.2 载体及催化剂的表征
采用荷兰PHILPS Magix pw2424 X射线荧光元素分析(XRF)仪(Rh靶,X光管最大功率为2.4 kW)测定天然铝土矿石中各元素的相对含量.
采用荷兰Panalytical公司的X射线粉末衍射(XRD)仪测定样品的物相组成,X射线源为Co靶, Kα入射波长0.1790 nm,管电流40 mA,管电压40 kV,扫描步长为0.02°,扫描速率为0.60(°)·min-1.
采用Ominsorp 100cx气体吸附孔径测定仪(美国Micrometrics公司)测定催化剂的比表面积和孔结构:样品(经烘干预处理)用量为0.10 g,在120°C抽真空预处理4 h,以N2为吸附质,在液氮温度下(77 K)测得吸脱附曲线.依据吸脱附曲线的吸附支采用BET法计算比表面积,脱附支采用BJH法计算孔体积和孔分布.

表1 改性前后铝土矿化学组成Table 1 Chemical compositions of natural bauxite and modified bauxite
H2-TPR实验在美国Mciromeritics Autochem 2910型自动吸附仪进行.称取0.1 g催化剂,先用高纯氦气在200°C吹扫1 h,降至室温,继续吹扫至基线平稳.然后用10%(体积分数)H2-Ar混合气进行实验,气体流速为30 mL·min-1,升温速率10°C· min-1,升温至800°C,尾气经冷阱脱水后,耗氢量用热导检测器(TCD)跟踪记录.CO程序升温脱附(CO-TPD)实验在美国Mciro-meritics Auto-chem 2910型自动吸附仪进行.称取催化剂样品0.1 g,以10%H2-Ar程序升温还原至450°C,恒温1 h后,切换为10%(体积分数)CO-He吹扫1 h,然后降至室温.再用高纯氦气吹扫至基线平稳,在氦气气氛中进行程序升温脱附,升温速率为10°C·min-1,气体流量30 mL·min-1,由室温升至450°C,记录程序升温脱附谱.
2.3 水煤气变换反应活性评价
Ru/bauxite催化剂的水煤气变换活性在由北京卫星厂航盾新技术有限公司组装的自动化一氧化碳变换催化剂活性评价装置(CO-CMAT9001)上进行.
催化剂的装填量为0.5 mL,活性测试前,用10%(体积分数)H2-N2混合气对催化剂进行还原,还原程序为:室温-200°C,升温速率为3°C·min-1,在200°C停留90 min;200-400°C,升温速率为3°C·min-1,在400°C停留240 min;450-200°C (测试温度),降温速率1.5°C·min-1.然后改通10% CO-N2原料气,并使其流经恒温82°C的水浴罐,生成水煤气变换反应气进行活性测试.活性测试条件为:常压,空速10000 h-1,水蒸汽和干气体积比为1: 1,反应温度范围为200-400°C,升温速率3°C· min-1,温度间隔50°C,每个测试温度点保持时间为4 h.出口气体中CO含量通过Shimadzu GC-8A型气相色谱仪检测.催化剂的活性用CO的转化率表示: X(CO)=(1-Vo/Vi)/(1+Vo)×100%,式中,Vi和Vo分别为原料气中和出口气中CO的体积分数.
3 结果与讨论
3.1 改性前后铝土矿组成分析
采用XRF对改性前后铝土矿的化学组成进行分析,结果如表1所示.
3.2 改性前后铝土矿XRD图
图1为改性前后铝土矿的XRD图.从图中可以看出,天然铝土矿主要有三水铝石(gibbsite,Al(OH)3)、高岭石(kaolinite,Al2O3·2SiO2·2H2O)和氧化铁(Fe2O3)的特征峰.经水热反应并焙烧后,改性后铝土矿的衍射峰变化明显,天然铝土矿中的高岭石和三水铝石的特征峰消失,出现了明显的Al2O3和Fe2O3特征峰.文献21认为,高岭石在热处理过程中,会发生脱水分解反应,在失去化学结合水的同时,本身晶体结构也受到破坏,生成无定形偏高岭土.其反应式为:Al2O3·2SiO2·2H2O→Al2O3·2SiO2+2H2O.因此,高岭石特征峰消失.而三水铝石经热处理后,也发生脱水分解反应,转化为Al2O3.
3.3 改性前后铝土矿的表面织构
天然铝土矿和改性后铝土矿的表面织构分析见表2和图2.表2结果表明,改性后铝土矿和天然铝土矿比较,比表面积增大了2.7倍,为153 m2·g-1;孔容增加;平均孔径由原矿的15.29 nm减小为改性后铝土矿的4.82 nm,表明天然铝土矿中的高岭石和三水铝石在焙烧脱水后,在晶相转变过程中内部缺陷增多,从而使改性后铝土矿比表面积和孔容增加.
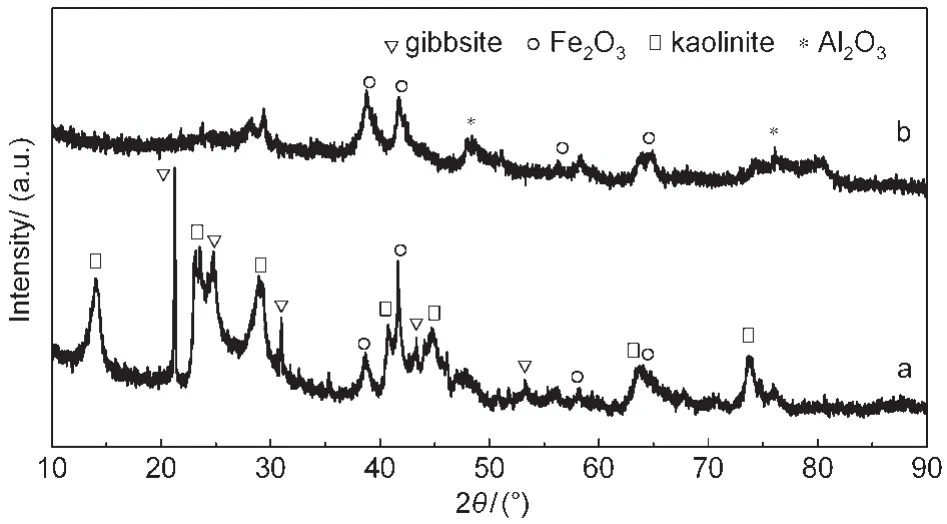
图1 天然铝土矿(a)和改性后铝土矿(b)的XRD图Fig.1 XRD patterns of(a)natural bauxite and (b)modified bauxite
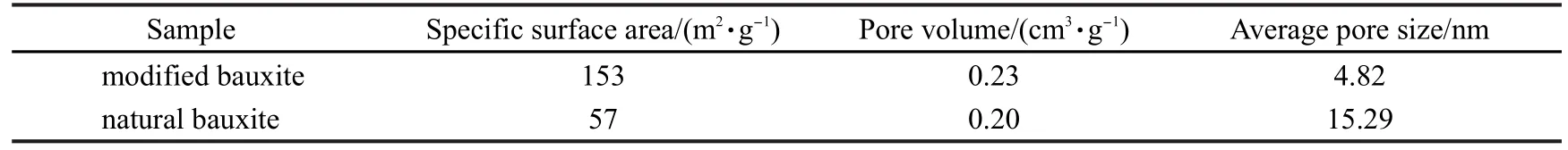
表2 改性后铝土矿和天然铝土矿比表面积和孔结构数据Table 2 Specific surface area and pore structure data of natural bauxite and modified bauxite
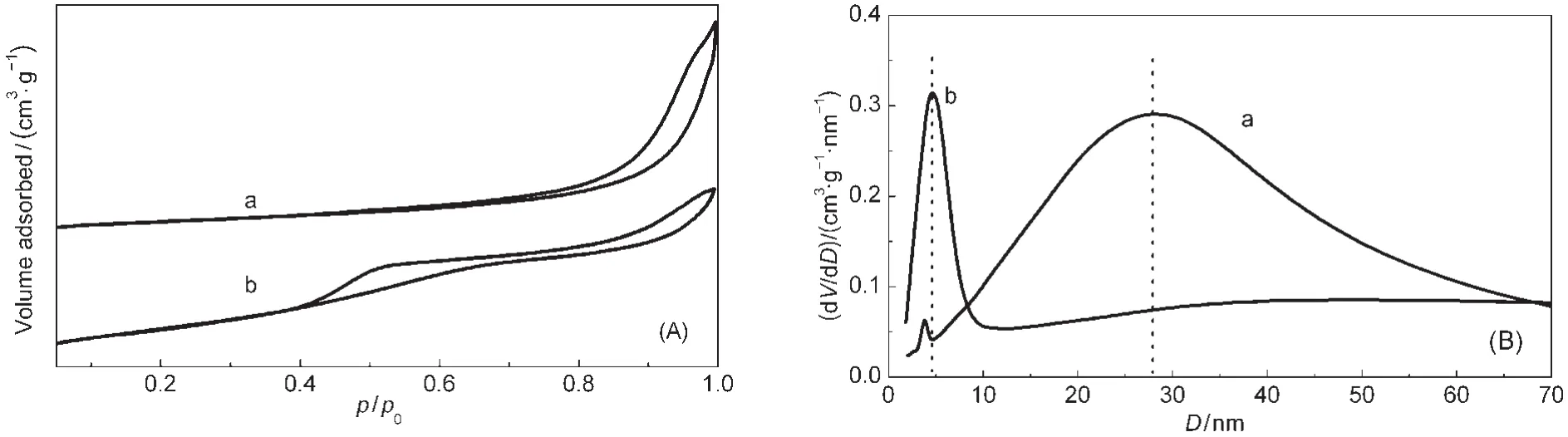
图2 天然铝土矿(a)和改性后铝土矿(b)的低温N2吸脱附曲线(A)和孔径分布曲线(B)Fig.2 Nitrogen adsorption-desorption isotherms(A)and pore-size distribution(B)of natural bauxite(a)and modified bauxite(b)
图2表明,天然铝土矿和改性后铝土矿的吸脱附曲线均具有明显的滞后环,等温线均属IUPAC分类中的IV型,滞后环为H3型.22吸脱附曲线的高压端吸附量大,表明改性后铝土矿具有明显的介孔特征.这种滞后环一般由层板状颗粒聚集而成两端开放的堆积孔或片状粒子堆积形成的狭缝孔.改性后铝土矿也是狭缝孔,区别于天然铝土矿的粒子堆集,应是一些类似由层状结构产生的孔.
采用BJH方法根据脱附曲线计算得到两个样品的孔径分布,如图2所示,天然铝土矿的最可几孔径在30 nm左右,可归结为片状结构的高岭石和三水铝石的堆积孔,另外也存在少量直径为3 nm左右的孔.改性后铝土矿最可几孔径则主要集中在4 nm附近,呈现较窄的单一分布.
3.4 催化剂的水煤气变换反应活性评价结果
图3为改性后铝土矿、不同Ru含量催化剂和2%Ru/Al2O3的催化剂的水煤气变换性能评价结果.图中表明,改性后铝土矿本身具有一定的水煤气变换反应性能,且随温度的升高而逐渐增加,其原因为铝土矿本身含有的Fe2O3是水煤气变换反应的催化剂.23不同Ru含量催化剂的CO转化率随温度的升高而提高,随Ru含量的增加而提高.以Ru4样品的活性最佳.催化剂Ru3和Ru4在300°C达到CO的平衡转化,而催化剂Ru1和Ru2在350°C也达到CO的平衡转化.表明催化剂具有良好的催化性能和热稳定性能.
2%Ru/Al2O3催化剂的CO转化率也随温度的升高而提高,但催化剂Ru2在反应温度区间内的活性均优于2%Ru/Al2O3样品,且Ru2在350°C达到CO的平衡转化.表明Ru2比2%Ru/Al2O3具有更好的催化性能和热稳定性能.其原因可能为铝土矿本身含有的Fe2O3是水煤气变换反应的催化剂,且活性组分Ru可能和载体发生协同作用,有利于提高催化剂的水煤气变换反应性能.
3.5 催化剂的XRD图
图4为改性后铝土矿和不同Ru负载量的Ru/ bauxite催化剂样品的XRD图.图中表明,改性后铝土矿具有明显的Fe2O3和Al2O3特征峰.不同Ru含量的Ru/bauxite催化剂样品,也有明显的Fe2O3和Al2O3的特征峰,和改性后铝土矿差别不明显.未出现明显Ru的特征峰,表明Ru高度分散在载体中或和载体发生了相互作用.

图3 不同Ru含量对Ru/bauxite催化剂上的水煤气变换反应性能的影响Fig.3 Influences of different Ru loadings on water-gas-shift activity on Ru/bauxite catalystsThe mass fractions of Ru in the Ru/bauxite catalysts are 1%(Ru1), 2%(Ru2),3%(Ru3),4%(Ru4),respectively.
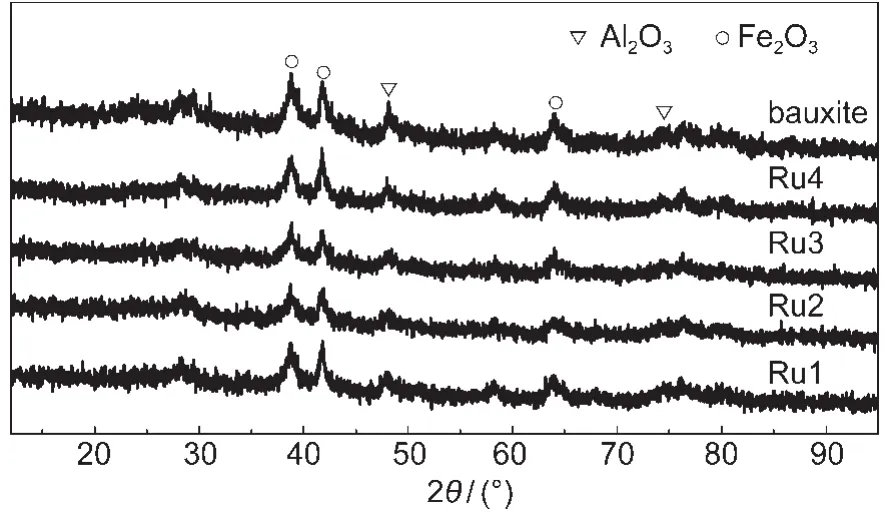
图4 不同样品的XRD图谱Fig.4 XRD patterns of the different samples
3.6 催化剂的表面织构
表3为不同Ru含量的Ru/bauxite催化剂样品的表面织构数据.数据表明,Ru/bauxite催化剂样品与改性铝土矿载体对比,比表面积有所下降,应主要是由于负载引起的变化.不同催化剂样品比表面积和孔容随Ru负载量的增加逐渐减小,但减小不明显;平均孔径则随Ru负载量的增加而逐渐增大,表明部分Ru进入了载体的微孔,堵塞了一些特别小的孔,因此造成孔容有所减小,而使平均孔径增大.结合活性表征结果,表面织构的变化不是影响不同Ru含量催化剂样品性能的主要因素.此外,表中还可看出,催化剂Ru/Al2O3比Ru2的比表面积大81 m2· g-1,但后者的各温度点的催化性能均好于前者,特别是300°C后的活性明显好于前者.因此,表面织构的变化不是影响催化性能的主要因素.
3.7 H2-TPR谱图

图5 改性后铝土矿和不同Ru负载量的催化剂样品的H2-TPR谱图Fig.5 H2-TPR profiles of modified bauxite and catalysts with different Ru loadings
图5为改性后铝土矿和不同Ru负载量的催化剂的H2-TPR谱图.表4为图5中还原峰α和β还原峰面积的量化数据计算结果.由图可见,改性后铝土矿在410和640°C处有两个明显的耗氢峰.结合铝土矿的XRF分析结果可知,铝土矿中能被H2还原的成分主要是Fe2O3,文献24,25报道,Fe2O3在H2中的还原是分步进行的:Fe2O3→Fe3O4→FeO→Fe.因此410°C左右的还原峰可归属为Fe2O3还原为Fe3O4,而640°C左右的还原峰可归属为Fe3O4进一步还原为FeO和Fe的过程.
负载活性组分Ru后,不同Ru负载量的催化剂的H2-TPR谱图均出现五个耗氢峰.相比较于改性后铝土矿,载体中原归属于Fe2O3还原为Fe3O4的410°C大还原峰则分解为两个峰γ(343°C)和η (416°C),且随着Ru负载量的增加,还原温度也向低温方向有所移动,峰面积也有所增加;原归属于Fe3O4还原为FeO和Fe的640°C还原峰向低温方向移至575°C(θ峰),还原温度降低了65°C左右;表明负载的Ru促进了载体中Fe2O3的还原.26

表3 不同样品的表面织构参数Table 3 Surface texture parameters of the different samples
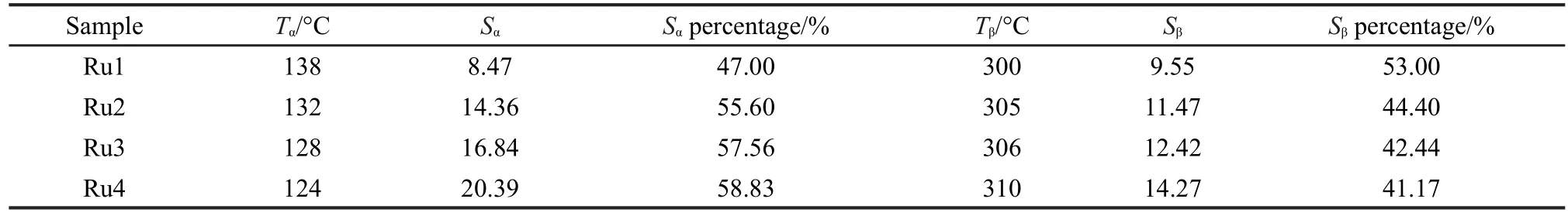
表4 Ru/bauxite催化剂的H2-TPR图谱的量化数据Table 4 Quantified data for H2-TPR profiles of Ru/bauxite catalyst
不同Ru负载量的催化剂图谱中温度较低的两个还原峰α和β可归属于Ru氧化物的还原.文献24报道,在90°C左右出现的Ru的还原峰归属于附着在载体表面的游离的Ru氧化物还原,而在较高温度出现的Ru还原峰所对应的Ru物种则与载体存在着一定的相互作用,相互作用越强,还原温度越高.因此125°C左右的α峰可归属于载体表面的游离的Ru氧化物的还原,300°C左右的β峰则归属于Ru与载体中的Fe2O3发生相互作用后的还原.
由图可知,随着Ru负载量的增加,α峰的温度逐渐向低温方向移动(由138°C移至124°C),而且还原峰的面积也有所增加(见表4).β峰的温度则随着Ru负载量的增加逐渐升高,逐渐与Fe2O3的γ还原峰存在合并的趋势,虽然峰面积有所增加,但这种与载体存在强相互作用的Ru氧化物在被还原的Ru物种中所占的比例随着Ru负载量的增加而降低(见表4),这与Wang、26Basinska27和Li28等的实验结果是一致的.结合文献26,29-31,可认为正是这种活性组分Ru与改性后铝土矿中的Fe2O3组分间的相互作用,不仅促进活性组分的还原,而且能够抑制活性组分的迁移和流失,防止催化剂的烧结.
3.8 CO-TPD谱图
图6为铝土矿载体和不同Ru负载量的催化剂CO-TPD谱图.图中显示,改性后铝土矿有两个CO脱附峰,分别位于100和250°C.100°C处的弱脱附峰,对应于改性后铝土矿对CO的弱化学吸附或物理吸附,32250°C左右的脱附峰对应于改性后铝土矿中不同价态的Fe氧化物对CO的吸附.不同Ru含量的催化剂均有一个大的非对称脱附峰,位于160°C左右,表明在Ru/bauxite催化剂中形成了新的活性中心,结合H2-TPR结果分析,这个大的非对称的脱附峰应是Ru、Ru-O-Fe和Fe-O等的还原态共同组成的活性中心,而这共同的活性中心使得CO吸附量明显增多且更易发生脱附,进而提高了催化剂的水煤气变换反应性能.
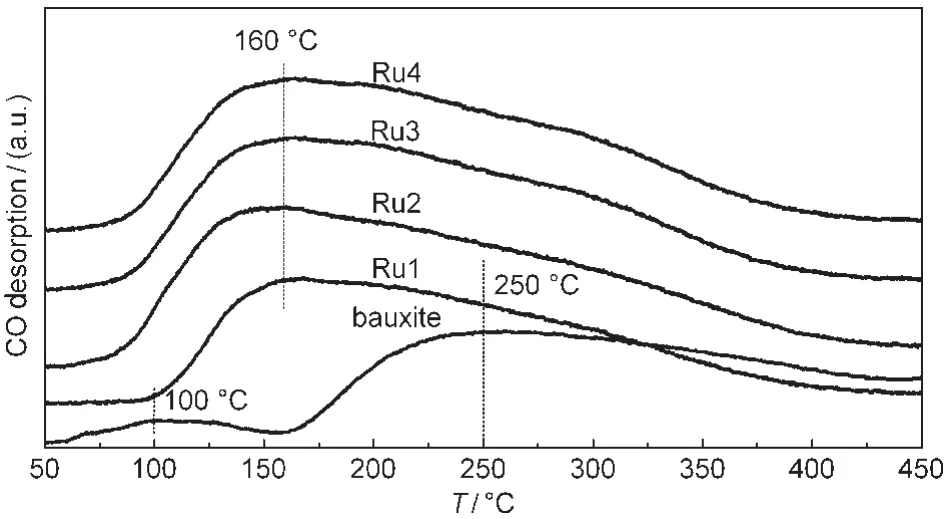
图6 改性后铝土矿和不同Ru负载量的催化剂样品的CO-TPD谱图Fig.6 CO-TPD profiles of bauxite and catalysts with different Ru loadings
4 结论
采用水热法对天然铝土矿进行改性,获得了具有介孔结构、高比表面积的铝土矿载体,其比表面积、孔容和平均孔径分别为153 m2·g-1、0.23 cm3·g-1和4.82 nm.研究了以改性后铝土矿为载体的不同Ru含量的Ru/bauxite催化剂的结构和水煤气变换反应性能,发现催化剂Ru/bauxite具有比催化剂Ru/ Al2O3更好的水煤气变换反应性能和热稳定性,表面织构的变化不是催化剂Ru/bauxite优于Ru/Al2O3的主要因素.主要原因为Ru能与铝土矿载体中的Fe2O3发生相互作用,促进了Fe2O3的还原,降低了Fe2O3还原温度,且能提高CO的吸附量和降低CO脱附峰温.
(1)Amphlett,J.C.;Mann,R.F.;Peppley,B.A.Int.J.Hydrog. Energy 1996,21(8),673.
(2) Hou,Z.J.;Yu,H.M.;Yi,B.L.;Han,M.Electrochemistry 2000, 6(4),379. [侯中军,俞红梅,衣宝廉,韩 明.电化学,2000, 6(4),379.]
(3) Han,J.;Kim,I.S.;Choi,K.S.J.Power Sources 2000,86(1), 223.
(4) Li,S.Y.;Zhou,X.Q.Coal Chem.Ind.2007,2,31. [李速延,周晓奇.煤化工,2007,2,31.]
(5)Yao,C.Z.;Zhang,X.Y.;Wang,L.C.;Cao,Y.;Dai,W.L.;Fan, K.N.;Wu,D.;Sun,Y.H.Acta Chim.Sin.2006,64(3),269. [姚成漳,张新荣,王路存,曹 勇,戴维林,范康年,吴 东,孙予罕.化学学报,2006,64(3),269.]
(6) Li,L.;Zhan,Y.Y.;Chen,C.Q.;She,Y.S.;Lin,X.Y.;Zheng,Q. Acta Phys.-Chim.Sin.2009,25(7),1397. [李 雷,詹瑛瑛,陈崇启,佘育生,林性贻,郑 起.物理化学学报,2009,25(7), 1397.]
(7) Panagiotopoulou,P.;Kondarides,D.I.Catal.Today 2006,112, 49.
(8) Venugopal,A.;Scurrell,M.S.Appl.Catal.A 2004,258,241.
(9) Khan,A.;Chen,P.;Boolchand,P.;Smirniotis,P.G.J.Catal. 2008,253(1),91.
(10) Kam,R.;Selomulya,C.;Amal,R.;Scott,J.J.Catal.2010,273, 73.
(11) Meunier,F.C.;Reid,D.;Goguet,A.;Shekhtman,S.;Hardacre, C.;Burch,R.;Deng,W.J.Catal.2007,247(2),277.
(12) Jacobs,G.;Patterson,P.M.;Graham,U.M.;Crawford,A.C.; Davis,B.H.Int.J.Hydrog.Energy 2005,30(11),1265.
(13) Gunawardana,P.;Lee,H.C.;Kim,D.H.Int.J.Hydrog.Energy 2009,34(3),1336.
(14) Linganiso,L.Z.;Jacobs,G.;Azzam,K.G.Appl.Catal.A 2011, 394(1),105.
(15) Zane,F.;Trevisan,V.;Pinna,F.;Signoretto,M.;Menegazzo,F. Appl.Catal.B 2009,89(1),303.
(16) Li,J.;Chen,J.L.;Song,W.;Liu,J.L.;Shen,W.J.Appl.Catal. A 2008,334,321.
(17) Graf,P.O.;de Vlieger,D.J.M.;Mojet,B.L.;Lefferts,L. J.Catal.2009,262(2),181.
(18) Basińska,A.;Domka,F.Catal.Lett.1993,22(4),327.
(19) Utaka,T.;Okanishi,T.;Takeguchi,T.;Kikuchi,R.;Eguchi,K. Appl.Catal.A 2003,245,343.
(20) Guo,X.Y.;Hua,N.P.;Du,Y.K.;Yang,P.Chin.J.Catal.2007, 28(2),137.[郭晓勇,华南平,杜玉扣,杨 平.催化学报, 2007,28(2),137.]
(21)Wei,C.D.;Ma,H.W.;Yang,D.F.Bull.Chin.Ceram.Soc. 2005,33(1),77281.[魏存弟,马鸿文,杨殿范.硅酸盐通报, 2005,33(1),77281.]
(22) Sing,K.S.W.;Everett,D.H.;Haul,R.A.W.Pure Appl.Chem. 1985,57(4),603.
(23) Lloyd,L.;Ridler,D.E.;Twigg,M.V.Catalyst Handbook,2nd ed.;Wolfe:London,1989;pp 283-333.
(24) Venugopal,A.;Aluha,J.;Mogano,D.;Scurrell,M.S.Appl. Catal.A 2003,245(1),149.
(25) Jozwiaka,W.K.;Kaczmarek,E.;Manieckia,T.P.;Ignaczaka, W.;Maniukiewicz,W.Appl.Catal.A 2007,326(1),17.
(26) Wang,W.;Ran,R.;Shao,Z.P.Int.J.Hydrog.Energy 2011,36, 755.
(27) Basinska,A.;Józwiak,W.K.;Góralski,J.;Domka,F.Appl. Catal.A 2000,190,107.
(28) Li,J.M.;Huang,F.Y.;Weng,W.Z.Catal.Today 2008,131, 179.
(29) Menon,P.G.Chem.Rev.1994,94,1021.
(30) Nagai,Y.;Hirabayashi,T.;Dohmae,K.J.Catal.2006,242,103.
(31) Nagai,Y.;Dohmae,K.;Ikeda,Y.;Takagi,N.Angew Chem.Int. Edit.2008,47,9303.
(32)Pan,Z.Y.;Dong,M.H.;Meng,X.K.;Zhang,X.X.;Mu,X.H.; Zong,B.N.Chem.Eng.Sci.2007,62(10),2712.
September 19,2011;Revised:December 19,2011;Published on Web:December 27,2011.
Modified Bauxite Supported Ruthenium Catalysts for Hydrogen Evolution in the Water-Gas Shift Reaction
JIANG Li-Long*MA Yong-De CAO Yan-Ning YANG Yang WEI Ke-Mei
(National Engineering Research Center of Chemical Fertilizer Catalyst,Fuzhou University,Fuzhou 350002,P.R.China)
Hydrothermally treated bauxite with high surface area was used as a ruthenium-based catalyst support.A series of Ru/bauxite and 2.0%(mass fraction)Ru/Al2O3catalysts were prepared by incipientwetness impregnation.The loading content of ruthenium in the Ru/bauxite catalysts was varied from 1.0% to 4.0%.The catalysts were thoroughly characterized by X-ray fluorescence(XRF),low temperature N2physical adsorption,X-ray diffraction(XRD),H2temperature-programmed reduction(H2-TPR),and CO temperature-programmed desorption(CO-TPD).The performances of the catalysts for the water-gas shift reaction were also investigated.The results indicated that Ru/bauxite catalysts possess an excellent ability to evolve hydrogen in the water-gas shift reaction.This was attributed to the interaction between Ru and Fe2O3in the modified bauxite,which could decrease the reduction temperature of Fe2O3,and also improve the adsorption-desorption behavior and decrease the desorption temperature of Ru/bauxite catalysts for CO molecules,resulting in higher activity in the water-gas shift reaction.
Bauxite;Ru/bauxite catalyst;Water-gas shift;Hydrogen evolution
10.3866/PKU.WHXB201112271
O643

