硫酸溶液中电化学改性石墨电极对Fe3+/Fe2+的电催化性能与准电容特性
孙亚萍 范新庄 芦永红 徐海波,*
(1中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,山东青岛266100; 2中国科学院金属研究所,沈阳110016)
硫酸溶液中电化学改性石墨电极对Fe3+/Fe2+的电催化性能与准电容特性
孙亚萍1范新庄2芦永红1徐海波1,*
(1中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,山东青岛266100;2中国科学院金属研究所,沈阳110016)
通过循环伏安(CV)、恒电流充放电和电化学阻抗谱(EIS)等测试方法,研究了电化学改性石墨电极对硫酸溶液中Fe3+/Fe2+的电催化性能与准电容特性.结果表明:由于电化学改性石墨电极表面存在大量的含氧活性官能团,使其对Fe3+/Fe2+的氧化还原反应具有极高的电催化性能,并具有可逆反应过程特征.在含有0.5 mol· L-1Fe3++0.5 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中,其表观面积比电容是不含铁离子硫酸溶液的1.808倍,达到2.157 F·cm-2;同时,铁离子浓度的增大也能够进一步提高其电容量.Fe3+/Fe2+电对的加入增加了充放电时间,有效提高了电化学电容器(EC)的电容存储容量和高功率特性.电化学阻抗谱测试同样证实体系具有明显的电容特性.因此,可以利用电化学改性石墨电极表面的含氧活性官能团和溶液中Fe3+/Fe2+的氧化还原特性来共同储存和释放能量.
电化学改性石墨电极;铁离子;电催化;电化学电容;准电容
1 引言
电化学电容器(EC),又名超级电容器,作为一种新型储能装置,已引起广泛关注.根据储能机理不同,电化学电容器可分为双电层电容器、赝电容器(也叫准电容器)和混合电容器.1近年来,提出了一种基于薄液层中氧化还原电对的新概念电化学电容器,2它改变了由电极材料提供准电容的固有模式,利用惰性电极表面薄液层内的氧化还原电对进行存储和释放能量.从根本上讲,这也是一种形式的准电容.此外,碳材料作为电极,也可应用于氧化还原液流电池,3,4尤其在钒液流电池(VRB)中广泛应用.5,6相同点是,它们均将能量存储在电解液中,充电时电能转换为活性物质的化学能,放电时液相中的化学能转化为电能,整个过程不涉及固相反应和固相离子传输,因此几乎无循环寿命限制;此外,由于依靠体系中液相氧化还原电对之间的电化学反应来实现能量转换,因而具有比EC更高的比能量.
碳材料表面的物理结构、化学成分和预处理方法决定了电极表面的电化学过程动力学.研究表明,含氧官能团对电极过程的影响主要有以下五个方面:电催化效应,润湿性,化学吸附,双电层和电阻效应.7,8根据McCreery分级理论,7,9Fe3+/Fe2+在电极表面的氧化还原过程受羰基基团数量的影响.李强等10对Fe3+/Fe2+在多孔炭纳米孔隙中的电化学行为及准电容效应的研究发现:单电极的比能量可达174 mAh·g-1,并有着良好的循环稳定性,证明Fe3+/ Fe2+是一种很有前途的EC氧化还原电解液.最近, Fan等11-13研究发现,电化学氧化处理后的石墨电极表面含有大量的羟基、羰基和羧基等含氧官能团,它们之间可逆的氧化还原反应使电极主要以准电容特性为主,比电容可达179.7 F·g-1,是一种有前景的准电容器电极材料.因此,我们发明了一种新型的氧化还原反应电化学电容器,14其能量转换机制为:利用电化学改性石墨电极表面的含氧活性官能团及薄液层中电偶对的可逆氧化还原反应来共同储存和释放能量,从而在保持功率特性前提下获得更高的比能量密度.
基于上述思想,本文采用循环伏安(CV)、电化学阻抗和恒电流充放电测试方法,对电化学改性石墨电极(MGE)在含有铁离子的硫酸溶液中的电化学行为及准电容特性进行了探讨研究.
2 实验
无孔石墨板(2 cm×2 cm×0.08 cm,上海弘枫石墨制品有限公司)经1000目砂纸打磨、酒精和蒸馏水冲洗后,放入Flat Cell K0235(AMETEK Princeton Applied Research,USA)三电极电解池中.1 cm2的石墨板做工作电极,参比电极为饱和甘汞电极(SCE),辅助电极为10 cm2的铂片.参考前期研究工作,11-13石墨电极(GE)在2.0 mol·L-1H2SO4溶液中的电化学活化工艺参数为:施加200 mA的阳极和-120 mA的阴极阶跃电流,活化时间分别为300和100 s,循环3次后得到MGE.
将GE和MGE分别在含有0.1 mol·L-1Fe3++ 0.1 mol·L-1Fe2+、0.5 mol·L-1Fe3++0.5 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液和不含铁离子的2.0 mol· L-1H2SO4空白溶液中自然浸泡15 min,然后分别进行电化学阻抗、循环伏安和恒电流充放电测试.其中,电化学阻抗的测试频率范围为10 mHz-10 kHz,扰动电压为±5 mV;CV测试电位区间为-0.2-1.0 V,测试前需在-0.2 V电位下预极化200 s;充放电测试电位区间为-0.2-1.0 V.文中所有电极电位均相对于SCE.
CV测试的电容量按公式(1)15计算:

其中,C为电容量,U1、U2分别为扫描区间的最低电位和最高电位,ΔU为扫描电位区间,v为扫描速率, i(U)为不同电位下的电流密度.
恒电流充放电测试的电容量按公式(2)16计算:

其中,i为充放电电流密度,t为充放电时间.电化学活化及测试均在EG&G PAR Model 2263(Princeton, USA)上进行.
3 结果与讨论
3.1 CV测试
图1为GE和MGE分别在0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液和MGE在2.0 mol·L-1H2SO4溶液中的CV曲线,扫描速率为50 mV·s-1.从图中曲线a可以看出,MGE对硫酸溶液中Fe3+/Fe2+电对具有明显的电催化活性,在0.43 V左右产生一对强的氧化还原峰,且氧化还原峰的对称性和可逆性较好.而未活化石墨电极(曲线b)的电流响应非常小,峰电位相差很大,可逆性较差.在空白H2SO4溶液中(曲线c),MGE在0.4 V附近出现一对对称的氧化还原峰,对应于表面含氧活性官能团羟基(还原态)、羰基(半氧化态)和羧基(全氧化态)之间的连续氧化还原反应10:

通过对比图1中曲线a、c发现:含Fe3+/Fe2+的硫酸溶液中氧化还原峰电位更正一点,峰强也有较大提高.这是由于Fe3+/Fe2+的标准电极电位(0.53 V(vs SCE))17与MGE表面活性含氧基团的氧化还原峰电位相近,从而使两个氧化还原反应过程耦合,导致在0.43 V附近形成一对尖锐的氧化还原峰.此外, Pupkevich等18研究发现石墨材料表面的羰基官能团对Fe3+/Fe2+具有较强的电催化活性.而MGE表面含有大量的羰基官能团,12这也是MGE对Fe3+/Fe2+具有较强电催化作用的原因所在.
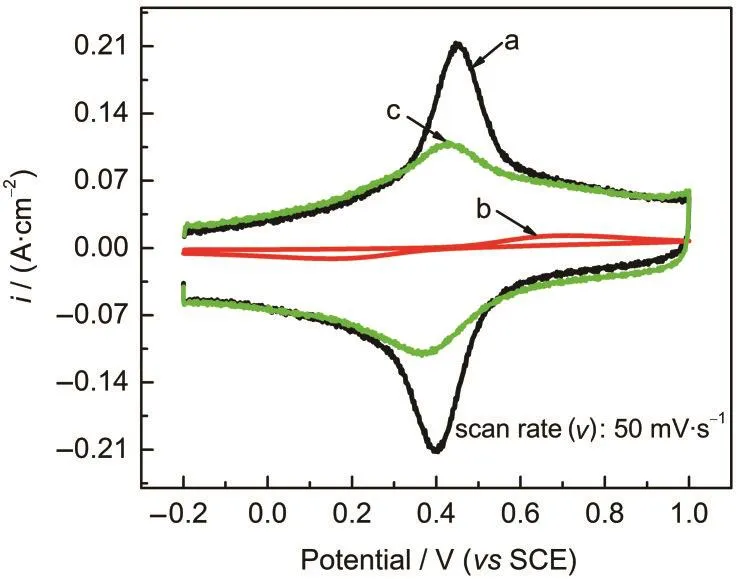
图1 MGE(a)和GE(b)在含有0.1 mol·L-1Fe3++0.1 mol· L-1Fe2+的2.0 mol·L-1H2SO4溶液中以及MGE在2.0 mol· L-1H2SO4溶液中(c)的CV曲线Fig.1 CV curves of MGE(a)and graphite electrode(GE) (b)in 2.0 mol·L-1H2SO4solution containing 0.1 mol·L-1 Fe3+and 0.1 mol·L-1Fe2+,as well as MGE in 2.0 mol·L-1 H2SO4solution(c)
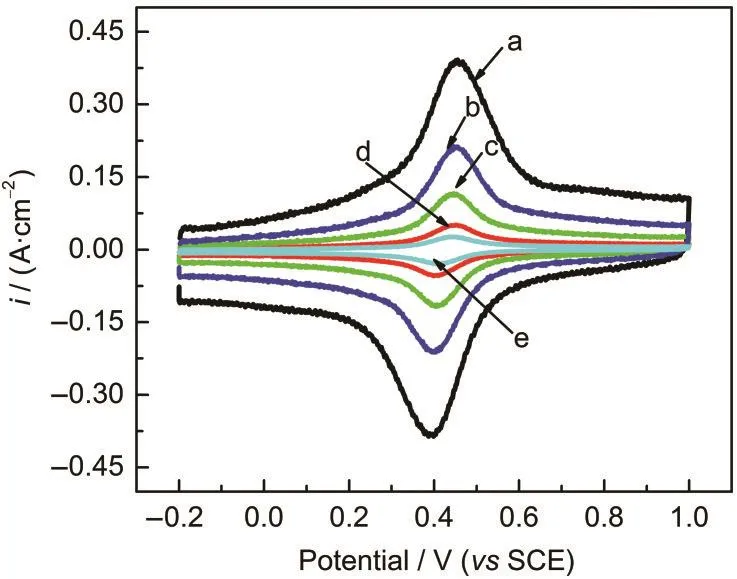
图2 不同扫描速率下MGE在含有0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中的CV曲线Fig.2 CV curves of MGE in 2.0 mol·L-1H2SO4solution containing 0.1 mol·L-1Fe3+and 0.1 mol·L-1Fe2+tested at different scan ratesv/(mV·s-1):(a)100,(b)50,(c)25,(d)10,(e)5
为进一步研究电催化性能,在不同扫描速率(5-100 mV·s-1)下对MGE在含有0.1 mol·L-1Fe3++ 0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中进行CV测试,结果如图2所示.从图中可以看出,同一扫描速率下氧化峰和还原峰的峰值电流基本相等,且随扫描速率的增大而增加,但氧化峰和还原峰的峰电位差明显与扫描速率无关.根据式(1)可以计算出,当扫描速率为50 mV·s-1时,其比电容可达1.381 F· cm-2,而空白硫酸溶液中的比电容仅为1.193 F· cm-2.
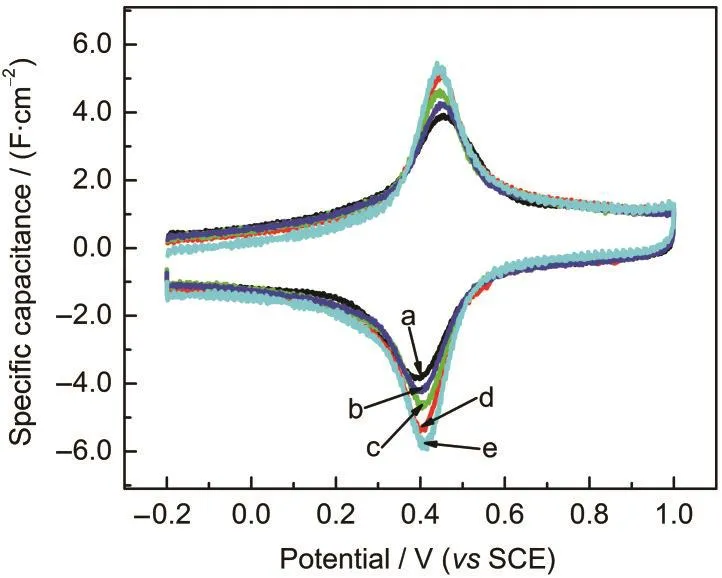
图3 不同扫描速率下MGE在含有0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中的比电容-电位曲线Fig.3 Specific capacitance-potential curves of MGE in 2.0 mol·L-1H2SO4solution containing 0.1 mol·L-1Fe3+and 0.1 mol·L-1Fe2+tested at different scan ratesv/(mV·s-1):(a)100,(b)50,(c)25,(d)10,(e)5
基于公式(1)可由图2进一步得到不同扫描速率下的比电容-电位曲线(图3).由图3可知,虽然MGE本身具有良好的倍率特性,但Fe3+/Fe2+之间的氧化还原反应明显受扩散过程的影响.若扫描速率过快,溶液本体中的铁离子来不及扩散到电极表面,导致表面反应物浓度降低,电容值减小;当扫描速率较慢时,溶液中的铁离子就有充足的时间扩散到电极表面,氧化还原反应充分进行,电容值较大.总体上,MGE在含有Fe3+/Fe2+的H2SO4溶液中具有较高的电容量,可以用来作为二次电源使用.
为了进一步研究峰电位处的氧化还原反应,考察了氧化峰电流与扫描速率之间的关系.图4是MGE在含有0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中的氧化峰电流(ipk)和扫描速率平方根(v1/2)的关系曲线.由图4可知,MGE在此含铁离子的H2SO4溶液中的氧化峰峰电流与扫描速率平方根具有良好的线性关系,其线性相关系数为,r=0.99619,线性回归方程为,

因此,可以认为该电位下的氧化还原反应为可逆反应,是由物质传输扩散控制的快电子转移过程.19,20
图5为MGE在含不同浓度铁离子的硫酸溶液中的CV曲线,扫描速率为50 mV·s-1.由图可以看出,Fe3+/Fe2+电对的浓度由0.1 mol·L-1增加到0.5 mol·L-1时,电流响应由213 mA·cm-2上升到427 mA·cm-2,氧化还原峰电位差基本不变.由公式(1)可以计算得到,扫描速率为50 mV·s-1时,MGE在含有0.5 mol·L-1Fe3++0.5 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中的表观面积比电容为2.157 F·cm-2,是空白硫酸溶液的1.808倍.显然,较高的铁离子浓度有助于电容量的大幅度提高.
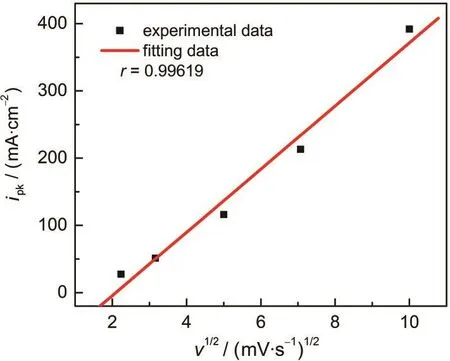
图4 MGE在含有0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中的氧化峰电流与扫描速率平方根之间的关系Fig.4 Relationship between the oxidation peak currents of MGE in 2.0 mol·L-1H2SO4solution containing 0.1 mol·L-1Fe3+and 0.1 mol·L-1Fe2+and the square root of scan rates
3.2 恒电流充放电测试
图6为在含有0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中,MGE在不同电流密度下的充放电响应曲线.从图中可以看到,不同电流密度下的充放电曲线具有良好的对称性,斜率有明显的变化,出现缓冲缓放的现象,大大增加了其充放电时间.在充电开始阶段,电压上升很快,中间出现一个变化相对平缓的平台,之后上升幅度再次加快.这说明MGE在含有Fe3+/Fe2硫酸溶液中具有明显的准电容特性.21此外,即使充放电电流密度高达100 mA·cm-2,充放电曲线仍基本对称,说明MGE在含Fe3+/Fe2+硫酸溶液中具有优良的高功率特性,适合大电流充放电.由公式(2)计算可得到,当充电电流密度为50 mA·cm-2时,MGE的表观面积比电容为1.386 F·cm-2,与前面循环伏安测试的结果基本一致.
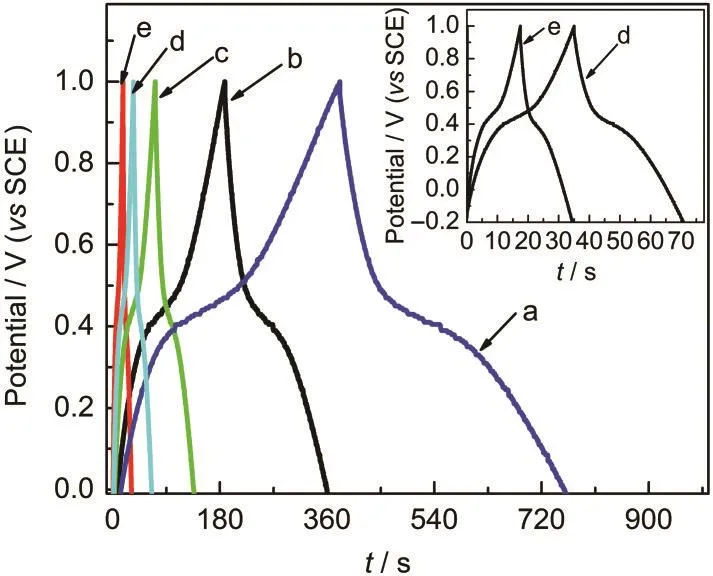
图6 MGE在0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol· L-1H2SO4溶液中不同电流密度下的充放电响应曲线Fig.6 MGE charge-discharge curves in 2.0 mol·L-1 H2SO4solution containing 0.1 mol·L-1Fe3+and 0.1 mol·L-1 Fe2+at different current densitiesi/(mA·cm-2):(a)5,(b)10,(c)25,(d)50,(e)100
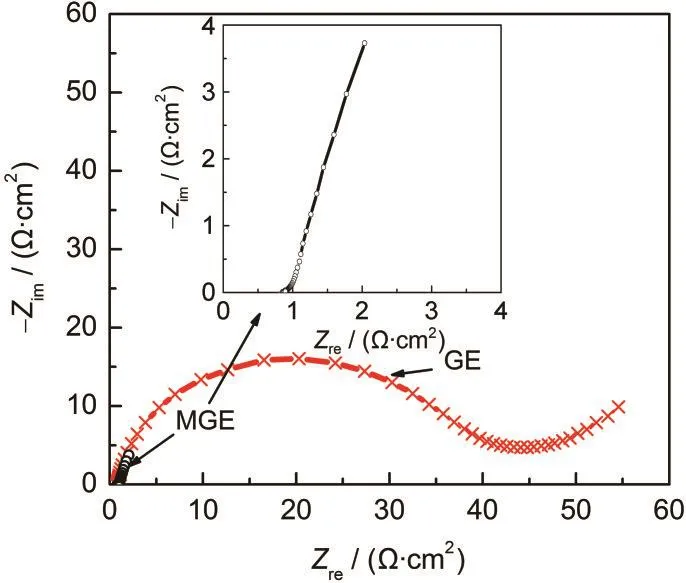
图7 开路电位下MGE(包括放大图)与GE分别在0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4中的Nyquist阻抗谱图Fig.7 Nyquist plots of MGE(including the enlarged diagram)and GE measured at open potential in 2.0 mol·L-1H2SO4solution containing 0.1 mol·L-1Fe3+and 0.1 mol·L-1Fe2+
3.3 电化学阻抗谱
图7为在含有0.1 mol·L-1Fe3++0.1 mol·L-1Fe2+的2.0 mol·L-1H2SO4溶液中,MGE与GE在开路电位(MGE,447 mV(vsSCE);GE,449 mV(vsSCE))下的交流阻抗图谱.由图可以看出,GE的Nyquist曲线为高频区的半圆和低频区的扩散尾,半圆弧的直径高达40 Ω·cm2,说明电荷转移电阻较大,不具备电容特性.而MGE的阻抗谱图近似呈一条垂直于实轴的直线,具有典型的电化学电容特性;22同时,实部阻抗很小,表明电极反应速度极快,虚部阻抗也较小,说明电容较大.从MGE的阻抗谱的局部放大图可以看到高频区有一个四分之一圆弧,这对应于电极表面的双电层过程,它对频率的响应要远远大于准电容过程;23同时,低频区虚部阻抗的近似垂直增长也说明MGE在含铁离子的H2SO4溶液中具有典型的电容性质,这主要对应于电极表面自身含氧活性官能团之间及其薄液层中Fe3+/Fe2+电对的法拉第氧化还原反应过程.24
4 结 论
使用循环伏安、恒电流充放电和电化学阻抗谱的方法研究了MGE在含有Fe3+/Fe2+电对的H2SO4溶液中的电催化作用及其准电容性能.结果表明:MGE对H2SO4溶液中的Fe3+/Fe2+电对具有明显的电催化活性和较高的准电容特性,其表观面积比电容是空白硫酸溶液的1.808倍,达到2.157 F·cm-2.而且,增大铁离子浓度能够进一步提高其电容量.加入Fe3+/Fe2+电对使得充放电曲线出现对称的缓充缓放现象,大大增加了其充放电时间,有效地提高了电化学电容器的电容存储容量.电化学阻抗谱测试同样证实了体系具有明显的电容特性.因此,利用MGE对Fe3+/Fe2+的电催化作用及准电容性能,有望用来构建一种全新的电化学储能体系.
(1) Patrice,S.;Yury,G.Nature Materials 2008,7,845.
(2)Tian,Z.W.;Dong,Q.F.;Zheng,M.S.;Lin,Z.G.Based on Liquid Phase ElectrochemicallyActive Material for Super Capacitor.CN Patent 200610087625.1,2006-11-22. [田昭武,董全峰,郑明森,林祖赓.基于液相中的电化学活性物质的超级电容器:中国,200610087625.1[P].2006-11-22.]
(3) Bae,C.H.;Roberts,E.P.L.;Dryfe,R.A.W.Electrochim.Acta 2002,48,279.
(4) Moraw,F.;Fatih,K.;Wilkinson,D.;Girard,F.Adv.Mater.Res. 2007,15-17,315.
(5) Hagg,C.M.;Skyllas-Kazacos,M.J.Appl.Electrochem.2002, 32,1063.
(6) Qian,P.;Zhang,H.M.;Chen,J.;Wen,Y.H.;Luo,Q.T.;Liu,Z. H.;You,D.J.;Yi,B.L.J.Power Sources 2008,175,613.
(7) Chen,P.H.;McCreery,R.L.Anal.Chem.1996,68,3958.
(8) Banks,C.E.;Davis,T.J.;Wildgoose,G.G.;Compton,R.G. Chem.Commun.2005,829.
(9) McCreery,R.L.Electroanalytical Chemistry;Bard,A.J.Ed.; Dekker:New York,1991;Vol.17,pp 221-374.
(10) Li,Q.;Li,K.X.;Sun,G.H.;Fan,H.;Gu,J.N.Acta Phys.-Chim.Sin.2006,22,1445.[李 强,李开喜,孙国华,范 慧,谷建宁.物理化学学报,2006,22,1445.]
(11)Xu,H.B.;Fan,X.Z.;Lu,Y.H.;Zhong,L.;Kong,X.F.;Wang, J.Carbon 2010,48,3300.
(12) Fan,X.Z.;Lu,Y.H.;Xu,H.B.;Kong,X.F.;Wang,J.J.Mater. Chem.2011,21,18753.
(13) Fan,X.Z.;Lu,Y.H.;Kong,X.F.;Xu,H.B.;Wang,J.Acta Phys.-Chim.Sin.2011,27,887. [范新庄,芦永红,孔祥峰,徐海波,王 佳.物理化学学报,2011,27,887.]
(14) Xu,H.B.;Yan,C.W.;Lu,Y.H.;Liu,J.G.ARedox Reaction Electrochemical Capacitor.CN Patent 201110028479.6,2011. [徐海波,严川伟,芦永红,刘建国.一种氧化还原反应电化学电容器:中国,201110028479.6[P].2011.]
(15) Conway,B.E.Electrochemical Supercapacitors:Scientific Fundamentals and TechnologicalApplications;Kluwer Academic/Plenum Publishers:New York,1999;pp 200-225.
(16)Ye,J.S.;Liu,X.;Cui,H.F.;Zhang,W.D.;Sheu,F.S.;Lim,T. M.Electrochem.Commun.2005,7,249.
(17) Gu,Q.C.New Chemical Table;Jiangsu Science&Technology Publishing House:Nanjing,1998;pp 1287-1316.[顾庆超.新编化学用表.南京:江苏科技出版社,1998:1287-1316.]
(18) Pupkevich,V.;Glibin,V.;Karamanev,D.Electrochem. Commun.2007,9,1924.
(19)Hu,C.G.;Wang,W.L.;Wang,S.X.;Zhu,W.;Li,Y.Diamond Relat.Mater.2003,12,1259.
(20) Hamann,C.H.;Hamnett,A.;Vielstich,W.Electrochemistry; Chemical Industry Press:Beijing,2010;pp 201-207;translated by Chen,Y.X.,Xia,X.H.,Cai,J.Y.[卡尔·H.哈曼,安德鲁·哈姆内特,沃尔夫·菲尔施蒂希.电化学.陈艳霞,夏兴华,蔡俊译,译.北京:化学工业出版社,2010:201-207.]
(21) Li,L.X.;Song,H.H.;Zhang,Q.C.;Yao,J.Y.;Chen,X.H. J.Power Sources 2009,187,268.
(22) Frackowiak,E.;Beguin,F.Carbon 2001,39,937.
(23) Sipahi,M.;Parlak,E.A.;Gul,A.;Ekinci,E.;Yardim,M.F.; Sarac,A.S.Prog.Org.Coat.2008,62,96.
(24) Hu,C.C.;Wang,C.C.J.Electrochem.Soc.2003,150,A1079.
November 7,2011;Revised:December 19,2011;Published on Web:December 27,2011.
Electrocatalytic Performance and Pseudo-Capacitive Characteristics of Modified Graphite Electrode with Fe3+/Fe2+in H2SO4Solution
SUN Ya-Ping1FAN Xin-Zhuang2LU Yong-Hong1XU Hai-Bo1,*
(1Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,College of Chemistry and Chemical Engineering,Ocean University of China,Qingdao 266100,Shandong Province,P.R.China;2Institute of Metal Research, Chinese Academy of Sciences,Shenyang 110016,P.R.China)
The electrocatalytic performance and pseudocapacitive characteristics of a modified graphite electrode(MGE)with Fe3+/Fe2+in H2SO4solution were studied by cyclic voltammetry(CV),constant current charge-discharge measurements,and electrochemical impedance spectroscopy(EIS).The results showed that the MGE had high electrocatalytic activity and good reversible characteristics for the redox reaction of Fe3+/Fe2+because of a large quantity of oxygen-containing functional groups on the MGE surface.The apparent area-specific capacitance of the MGE in 2.0 mol·L-1H2SO4solution containing 0.5 mol·L-1Fe3+and 0.5 mol·L-1Fe2+reached 2.157 F·cm-2,which was almost double that in 2.0 mol·L-1H2SO4without Fe3+/ Fe2+.Meanwhile,increasing the concentration of iron ions increased the capacitance of the MGE.The addition of Fe3+/Fe2+made the charge-discharge curves more symmetric and change more slowly,which increases the charge-discharge time,and effectively improves the capacitive energy storage and high power performance for an electrochemical capacitor(EC).The obvious capacitive characteristics were confirmed by EIS,and are attributed to the oxygen-containing functional groups on the MGE and the Faraday redox reaction of Fe3+/Fe2+in the thin electrolyte layer.Therefore,the oxygen-containing functional groups on the MGE surface and redox reaction of Fe3+/Fe2+can be used together for energy storage and release.
Modified graphite electrode;Iron ion;Electrocatalysis;Electrochemical capacitor; Pseudo-capacitance
10.3866/PKU.WHXB201112272
O646
∗Corresponding author.Email:xuwangri@163.com;Tel:+86-532-66782510.
The project was supported by the Doctor Foundation of Shandong Province,China(BS2010NJ018,BS2011NJ019)and Fundamental Research Funds for the Central Universities,China(201022006).
山东省博士基金(BS2010NJ018,BS2011NJ019)和中央高校基础科研基金(201022006)资助项目

