利用响应面分析法优化鼠李糖乳杆菌产胞外多糖的发酵工艺
任大勇,章检明,曹 婧,刘宏锋,焉慧洁,杨嫦娥,秦艳青,沈明浩
(1.吉林农业大学食品科学与工程学院,长春 130118;2.吉林大学畜牧兽医学院,长春 130062)
胞外多糖(Exopolysaccharides,EPS)是由多数细菌与少数酵母菌及丝状真菌在生长代谢过程中分泌到细胞壁外的水溶性多糖,按其结构可分为同多糖(由一种单糖构成)和杂多糖(由两种以上单糖构成)[1]。EPS对微生物本身具有重要功能,如保护细胞免受脱水损伤以及噬菌体吞噬、为微生物提供营养、稳定细胞渗透压、增加菌体对肠黏膜的黏附性、参与细胞信号传递等[2]。
乳酸菌(Lactic acid bacterium,LAB)是公认的食品级微生物(GRAS),具有多种生理功能,与其他细菌相比,乳酸菌分泌的EPS安全性更高,以肠膜明串珠菌(L.mesenteroides)开发的右旋糖酐已得到广泛应用[3]。近几年,新的乳酸菌EPS的开发与研究成为热点,产EPS的菌株主要有乳杆菌、乳球菌、链球菌、明串珠菌属、双歧杆菌等菌属[4]。乳酸菌EPS是由有分支或无分支的重复单元组成,每个重复单位中含有3~8个单糖或单糖衍生物,通常是D-葡萄糖、D-半乳糖和L-鼠李糖,有时在重复单元中也会出现其他己糖和戊糖。现有研究证明,EPS具有多种重要的生理功能,如抗肿瘤、降胆固醇、增强机体免疫功能等[5-6]。
虽然乳酸菌EPS应用前景广阔,但其产量较低,应用受到了一定的限制。因此,提高EPS的产量成为目前研究的热点。通过筛选优良菌种,优化发酵条件,或对菌种进行改良可以在一定程度上提高胞外多糖的产率。其中,优化发酵条件(培养基成分和生长条件)是提高EPS产量的重要途径[7]。响应面分析法(Response surface methodology,RSM)是通过对响应面等值线的分析寻求最优工艺参数,采用多元二次回归方程来拟合多种因素与响应值之间函数关系的一种统计方法[8]。RSM广泛应用于优化微生物培养基和提取工艺等方面。本研究以前期筛选的产EPS的鼠李糖乳杆菌为对象,以培养温度、培养时间、pH、培养基组成(酵母粉、柠檬酸氢二铵、磷酸氢二钾)和接种量为因素进行优化实验。通过Plackett-Burman法从众多因素中筛选出影响EPS产量的三个重要因素,再用Box-Behnken法建立响应面模型,以获得最高的EPS产量。
1 材料与方法
1.1 试剂与菌种 主要试剂:酵母粉、柠檬酸氢二铵、磷酸氢二钾、三氯乙酸、无水乙醇、聚乙二醇(PEG 20000)、苯酚、葡萄糖、浓硫酸。菌种:鼠李糖乳杆菌(Lactobacillus rhamnosus),由吉林农业大学食品学院毒理学教研室保存。
1.2 培养基 MRS培养基:蛋白胨10.0 g/L、牛肉膏8.0 g/L、酵母粉4.0 g/L、葡萄糖20.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸氢二铵2.0 g/L、乙酸钠5.0 g/L、硫酸镁0.2 g/L、硫酸锰0.04 g/L、吐温-80 1.0 mL。
1.3 材料与设备 超净工作台、高压蒸汽灭菌锅、恒温培养箱、高速冷冻离心机、精密pH计、精密电子天平、透析袋、722型可见分光光度计。
1.4 EPS的提取工艺 取菌种5 mL接于100 mL MRS培养基中,37℃恒温培养24 h,将培养液在6000 r/min、10℃条件下离心15 min去除菌体。向收集的培养上清液中加入三氯乙酸至终浓度为8%,充分搅拌后于4℃静置过夜,离心(10000 r/min,4℃,20 min)去除蛋白质,收集上清液。向上清液中加入3倍体积90%的乙醇,于4℃静置过夜。小心吸出上清液,向其中加入无水乙醇进行洗涤,直至溶液为无色为止。用蒸馏水溶解洗涤所得的沉淀,并移至透析袋中透析2 d,每天换水3次。用PEG 20000浓缩透析袋中的溶液至25 mL以下,用苯酚-硫酸法[9]测定多糖含量。
1.5 Plackett-Burman试验设计 本研究选取培养温度、培养时间、pH值、酵母粉、磷酸氢二钾、柠檬酸氢二铵和接种量7个因素,应用软件Design-Expert 8.0进行Plackett-Burman设计,从而筛选出影响EPS产量的3个主要因素。
1.6 最陡爬坡试验设计 根据Plackett-Burman法筛选出的显著因子效应大小设计它们的步长,进行最陡爬坡试验设计,寻找最大产区。
1.7 Box-Behnken优化试验设计 根据Plackett-Burman试验结果,应用软件Design-Expert 8.0对筛选的三个主要因素进行Box-Behnken优化设计,同时固定其他非关键因素。
2 结果
2.1 Plackett-Burman试验设计结果 Plackett-Burman设计因子水平表及结果分别见表1和表2。采用Design-Expert软件对表2中的EPS产量数据进行回归分析,得到各影响因子的偏回归系数及其重要性(表3)。由表3可知,酵母粉对鼠李糖乳杆菌产EPS影响最大,重要性为6.73。其次为培养温度,重要性为1.92。接种量、柠檬酸氢二铵、pH值、磷酸氢二钾和培养时间对EPS产量的影响依次降低,重要性分别为 1.18、1.08、0.79、0.72 和0.32。酵母粉、接种量、磷酸氢二钾和培养时间对EPS产量的影响为正相关;培养温度、柠檬酸氢二铵、pH对EPS产量的影响为负相关。故选取三个最重要的因素(酵母粉、培养温度和接种量)做进一步优化试验。

表1 Plackett-Burman设计因子水平

表2 Plackett-Burman试验设计结果
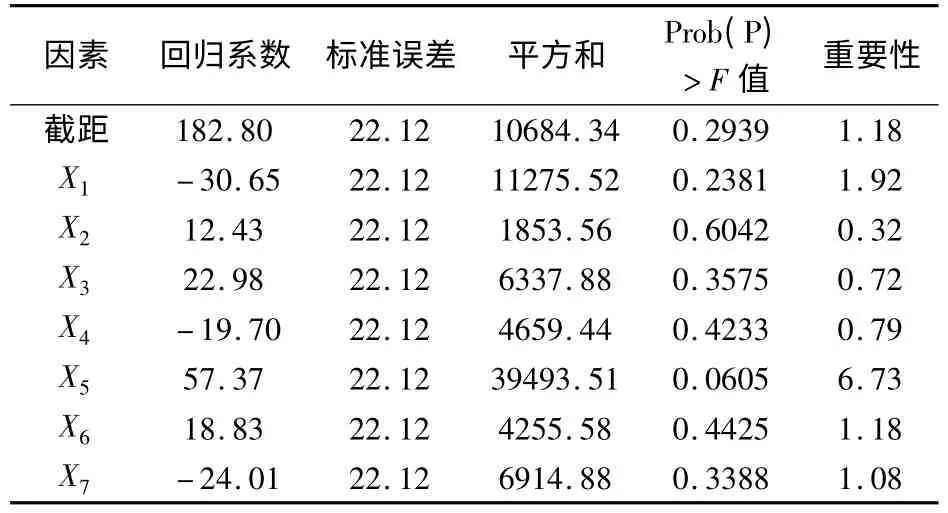
表3 偏回归系数及影响因子的显著性分析
2.2 最陡爬坡试验结果 响应面拟合方程只有在考察的临近区域里才能充分近似真实情况,故应先逼近最大产区后再建立有效的拟合方程。根据Plackett-Burman试验筛选出的3个影响EPS产量的重要因素,运用最陡爬坡试验找出EPS产量最大的区域。最陡爬坡试验结果见表4。由表4可知,当培养温度为30℃、酵母粉为30 g/L、接种量为6%时,EPS产量最大,当条件处于其两边或更远时产量逐渐下降。由此可以确定EPS产量最大值的条件应当在培养温度为30℃、酵母粉为30 g/L、接种量为6%附近区域。
2.3 Box-Behnken优化设计结果 根据最陡爬坡试验结果,将培养温度为30℃、酵母粉为30 g/L、接种量为6%作为中心条件采用Box-Behnken法进一步优化,各因素水平见表5,优化设计结果见表6。采用Design-Expert软件对表6中的EPS产量数据进行分析,得到模拟曲线,对应的模拟方程为:Y=354.05-4.65X1+9.27X5-4.53X6+18.88X1X5+13.87X1X6-9.49X5X6-22.80X21-47.00X25-28.66X26。此模拟方程的拟合度为93.43%,说明试验数据能较好的预测EPS的实际产量。对模拟方程进行方差分析,结果见表7。由表7可知,模拟方程的P<0.05,说明模拟方程对EPS产量的影响是显著的。模拟方程的一次项和交叉项对EPS产量的影响均不显著,而二次项显著,其中酵母粉的二次项为极显著,其余为显著。这说明各因素与EPS产量的关系并不是简单的线性关系,而是一个复杂的二次关系。
表4 最陡爬坡试验结果

表5 Box-Behnken设计各因素水平

表6 Box-Behnken设计及结果
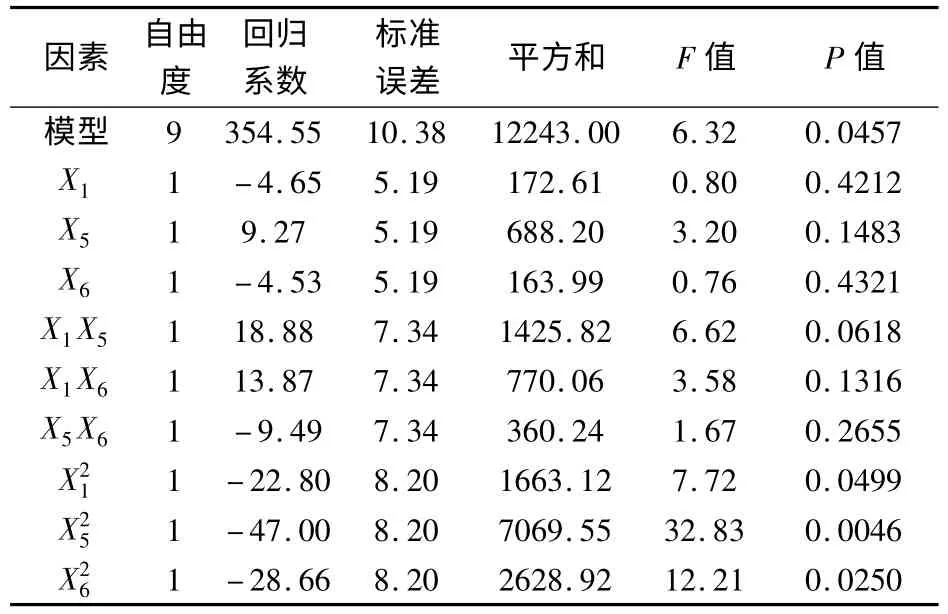
表7 方程中各参数的回归系数
2.4 响应面分析 根据模拟方程,运用Design-Expert软件绘制各因素交互作用对EPS产量影响的响应面曲线图(图1)。由图1A可知,接种量固定为6%时,当温度不变,EPS产量随酵母粉的增加先增后减;当酵母粉不变时,EPS产量随温度的升高而减少,这与Plackett-Burman试验中温度呈负相关的结论相一致。由图1B可知,温度固定为30℃,当酵母粉不变时,EPS随接种量的增加先增后减,当接种量不变时,EPS产量随酵母粉的增加先增后减;由图1C可知,酵母粉固定为30 g/L时,当温度不变,EPS产量随接种量的增加而减少;当接种量不变,EPS产量随温度的增加而减少。响应面曲线存在着EPS产量最大值,运用软件预测出产EPS产量最大的条件是:温度29.7℃、酵母粉30.45 g/L、接种量5.76%,EPS产量可达到354.97 mg/L。

图1 各因素交互作用对EPS产量影响的响应面曲线图
2.5 回归模型的验证 为了验证响应面法是否具有实用性和可靠性,根据筛选出的最佳发酵条件为实验条件,进行了两次平行实验,EPS产量分别为349.59 mg/L和352.26 mg/L。实验值和理论值基本一致,说明响应面法具有较好的实用性和可靠性。
3 讨论
乳酸菌胞外多糖(EPS)是乳酸菌在生长代谢过程中分泌到细胞壁外常渗于培养基的一类糖类化合物,根据结构可分为同多糖和杂多糖[1]。乳酸菌EPS的形成除了有利于改善产品的黏度和质地外,还具有降血脂、免疫调节和抗肿瘤等功能[5-6]。因此乳酸菌EPS作为微生物多糖的一个重要来源成为近年来的研究热点。
乳酸菌同多糖的生物合成是在细胞外进行的。特异性的糖基转移酶参与合成反应,并由蔗糖提供能量。乳酸菌杂多糖的生物合成是在细胞质中进行的,其过程比较复杂,涉及多种酶的参与。葡萄糖是杂多糖生物合成所需的糖源,在细胞内可转化为葡萄糖-6-磷酸,这是合成EPS的关键中间产物,再经磷酸葡萄糖变位酶形成葡萄糖-1-磷酸,后经dTDP葡萄糖焦磷酸化酶生成EPS前体——糖核苷酸。糖核苷酸最终聚合成具有重复单元的EPS,并通过细胞膜转移分泌到细胞外[10]。目前重复单元的聚合机制以及聚合体的分泌输出机制仍不清楚。
乳酸菌EPS的产量与菌种有密切关系[2]。菌株不同,EPS的合成能力差别很大,而同一菌株发酵条件不同,EPS的产量也有明显差异。此外,培养基的成分(碳源、氮源、无机盐等)和生长条件(温度、pH、接菌量、培养时间等)也是影响EPS产量的重要因素[11],且不同营养条件和环境条件下产生的EPS的化学结构和生理功能也有差异[12]。
培养基中氮源对乳杆菌胞外多糖产量有较大影响。半合成培养基中添加蛋白胨、酵母氮源和酵母提取物能提高乳杆菌EPS的产量[13]。矿物质也是影响乳杆菌EPS的重要因素[14],本研究选用应用广泛的磷酸氢二钾进行研究,结果影响不显著,说明矿物质与菌株之间具有特异性关系,有效的矿物质还需要进一步筛选。发酵时间也是影响EPS产量的重要因素之一[9-10],一般认为稳定期相比对数生长期能生产更多的EPS,但随着培养时间进一步延长,总产量会降低,这可能与培养基中营养成分的减少有关,因此本研究选取26~48 h进行研究。温度对乳酸菌EPS合成的影响因菌株、培养条件不同而有差异[9-10]。一些菌株在相对较低的温度下有利于EPS的合成,这可能是由于在较低温度下,细胞壁的合成较慢,从而使较多的磷酸类异戊二烯用于EPS的合成。本研究的最适发酵温度为29.7℃,低于菌体最适生长温度37℃,与前人结果一致。不同菌株和培养条件下的EPS合成的最适pH不同。研究证明,乳酸菌产EPS的最适pH值在6~7左右,因此本研究选择pH 5.9~7.1范围进行研究。接种量是影响EPS产量的另一个重要因素,本研究选取三个梯度,结果表明接种量在6%时产量最高。
虽然乳酸菌EPS产量依赖于菌种本身特性,但通过优化产EPS的最适培养条件,可以在一定程度上提高产量。由于影响EPS产量的因素较多,各种因素并不是孤立地起作用,而是相互影响和相互依赖的关系,给条件优化带来一定困难。虽然正交实验设计也可找出最优条件组合,但它难以直观地判别优化区域。响应面分析方法也是一种最优化方法[8],是研究多种因素间交互作用的回归分析方法,此方法能给出直观的图形,因而也能凭直觉观察其最优化点,它是将体系的响应(EPS产量)作为多个因素(发酵温度、氮源、接种量等)的函数,运用图形技术将这种函数关系显示出来,可以直观地分析各因素对响应值(EPS产量)的影响,以及各因素之间的交互作用。要构造这样的响应面,必须通过大量的试验数据(表6)建立一个合适的数学模型,再用此数学模型作图(图1)。
本研究首先采用Plackett-Burman法筛选出影响EPS产量的3个重要因素,再用最陡爬坡试验找出EPS产量最大的区域,最后用Box-Behnken法做出响应面曲线图。结果表明,鼠李糖乳杆菌产EPS最佳条件为温度29.7℃、酵母粉30.45 g/L、接种量5.76%,此时EPS产量最大,为354.97 mg/L。
[1]Kleerebezem M,Hols P,Bernard E,et al.The extracellular biology of the lactobacilli[J].FEMS Microbiol Rev,2010,34(2):199-230.
[2]Welman A D,Maddox I S.Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J].Trends Biotechnol,2003,21(6):269-274.
[3]Sutherland I.A sticky business.Microbial polysaccharides:current products and future trends[J].Microbiol Today,2002,29:70-71.
[4]Ruas-Madiedo P,Gueimonde M,Margolles A,et al.Exopolysaccharides produced by probiotic strains modify the adhesion of probiotics and enteropathogens to human intestinal mucus[J].Journal of Food Protection,2006,69(8):2011-2015.
[5]Liu C F,Tseng K C,Chiang S S,et al.Immunomodulatory and antioxidant potential of Lactobacillus exopolysaccharides[J].J Sci Food Agr,2011,91(12):2284-2291.
[6]Abd El-Gawad I,El-Sayed E,Hafez S,et al.Inhibitory effect of yoghurt and soya yoghurt containing bifidobacteria on the proliferation of Ehrlich ascites tumour cells in vitro and in vivo in a mouse tumour model[J].Brit J Nutr,2004,92(1):81-86.
[7]Gamar-Nourani L,Blondeau K,Simonet J M.Influence of culture conditions on exopolysaccharide production by Lactobacillus rhamnosus strain C83[J].J Appl Microbiol,1998,85(4):664-672.
[8]Bas D,Boyac i H.Modeling and optimization I:Usability of response surface methodology[J].J Food Eng,2007,78(3):836-845.
[9]冯美琴,邢家溧,张 琦,等.植物乳杆菌胞外多糖发酵条件的优化[J].食品科学,2011,(23):215-219.
[10]李盛钰,曾宪鹏,杨贞耐.提高乳酸菌胞外多糖产量的途径[J].食品与生物技术学报,2009,(3):289-293.
[11]Ai L,Zhang H,Guo B,et al.Preparation,partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J].Carbohyd Polym,2008,74(3):353-357.
[12]Ruas-Madiedo P,Hugenholtz J,Zoon P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].Intern Dairy J,2002,12(2/3):163-167.
[13]De Vuyst L,Degeest B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiol Rev,1999,23(2):153-177.
[14]Cerning J,Bouillane C,Landon M,et al.Isolation and characterization of exopolysaccharides from slime-forming mesophilic lactic acid bacteria[J].J Dairy Sci,1992,75(3):692-699.

