重组溶血素蛋白用于单增李斯特菌快速检测的效果
郭宏华 刘 娟 刘百歌 张晓静 晁 阳 何成彦 张学英
(吉林大学中日联谊医院,吉林 长春 130033)
单增李斯特菌是李斯特菌属中致病性最强的,是人类最重要的食源性病原菌〔1〕,也是引起人类和动物李斯特菌病的主要致病菌,可造成多种动物如猪、鸡等畜禽死亡,人感染后可造成脑膜炎、新生儿败血症、早产、死胎、脓肿、心内膜炎、单核细胞增多等疾病,死亡率很高,可高达30% ~40%〔2〕。近年来在世界上很多国家也报道了由于污染单增李斯特菌而发生的食物中毒事件〔3〕。因此,建立LM的快速检测方法,对人类健康和食品生产具有重要意义和应用前景。目前单增李斯特菌的检测主要依靠传统的分离培养和生化鉴定,需要的时间长,检出率较低〔4〕;其他检测方法如PCR方法、基因探针等都存在特异性不足〔5〕。本实验拟改进该菌的检测方法,进一步提高检测的特异性、灵敏度、重现性及稳定性。
1 材料与方法
1.1 材料 单增李斯特菌标准菌种(54001、54002株)购于北京鼎国生物制剂公司,实验室低温保存;小鼠骨髓瘤NS-1细胞,吉林大学中日联谊医院实验室保存,BALB/C小鼠由吉林大学医学部动物室提供。RPMI 1640、胎牛血清(GIBCO),HAT、HT、PEG 4000(SIGMA)均购于大连宝生物制剂公司。抗体亚类测定试剂盒为SIGMA公司产品。
1.2 方法
1.2.1 单增李斯特菌体表面抗原的提取 细菌接种于TSBYE培养基中培养16~18 h后,10 000 r/min离心10 min收集菌体,PBS洗3次后,将菌体悬浮于SDS缓冲液中,在常温下孵育1 h,10 000 r/min离心10 min,收集上清提取液,去离子水透析48 h,在595 nm处比色,得吸光度,查标准曲线,得到蛋白浓度,-80℃冻存。
1.2.2 动物免疫方案 将收集培养的李斯特菌溶于生理盐水中,经甲醛固定,PBS洗6次,保存于-20℃备用。取1×108溶于100 μl PBS中初次免疫小鼠,腹腔注射。1个月后进行第二次免疫,菌体量同初次免疫;融合前3 d加强免疫,剂量减为原来的一半。
1.2.3 细胞融合
1.2.3.1 培养骨髓瘤细胞NS-1 融合前骨髓瘤细胞用8-AG培养基筛选其活性。骨髓瘤细胞培养于RPMI 1640培养液中,细胞在指数增长期状态下进行融合。
1.2.3.2 制备饲养细胞 将小鼠拉颈处死,用75%酒精浸泡3~4 min。用手术剪将小鼠腹部剪开一小口,剥开皮肤,露出腹腔,用酒精棉消毒,用无菌注射器注入5~6 ml预冷的培养液,反复冲洗,吸出冲洗液。冲洗液放入离心管中离心5~6 min,用20%小牛血清培养液混悬,将细胞数调整至1×105/ml,将细胞液接种于96孔板中。置37℃条件下培养。
1.2.3.3 脾细胞的制备 免疫过的血清抗体滴度高的Balb/c鼠,拉颈处死。将小鼠放在75%酒精中浸泡消毒,取出固定于板上,在无菌条件下取脾,用血清培养液冲洗2次。把脾脏移入盛有无血清培养液的匀浆器中研磨,用无血清培养液冲洗,做成脾细胞悬液,用毛细管将悬液移入小试管中离心,去上清,悬浮于不完全培养液中,计数细胞量。
1.2.3.4 细胞融合 取小鼠脾细胞与骨髓瘤细胞按10∶1比例混合,在 50 ml离心管中用不完全培养液洗1次后经1 000 r/min离心7 min,弃上清,吸净残留液体,轻弹离心管底使沉淀的细胞团块略松动,同时加入50%PEG 1 ml,1 min内加完。加预热的不完全培养液,停止PEG的作用。每隔2 min,匀速加入1 ml,直至加到10 ml,轻轻混匀,1 000 r/min离心6 min。去掉离心后融合细胞的上清液,用10%小牛血清培养液轻轻混悬,将融合细胞混合悬液加入到含有饲养细胞的96孔板中,100 μl/孔,37℃,5%CO2孵箱培养。
1.2.4 ELISA法进行杂交瘤细胞的筛选培养 脾细胞和骨髓瘤细胞经PEG处理后形成多种细胞的混合体,只有脾细胞与骨髓细胞形成的杂交瘤细胞才有意义。杂交瘤细胞在HAT选择培养液中可以生长繁殖。前几天用HAT培养液培养融合细胞,第8天后每天半量换HAT培养液,维持10 d后换一般培养液。当细胞铺满管底1/5时,开始检测特异性抗体,用ELISA筛选出阳性克隆。
筛选方法:将每孔100 μl细胞培养液加入到细菌表面抗原包被好的酶标板上,同时以免疫小鼠血清为阳性对照(1∶1 000稀释)、正常小鼠血清为阴性对照(1∶1 000稀释),每孔100 μl,37℃孵育1 h,PBS洗3次,加入 HRP酶标记的兔抗鼠 IgG 100 μl,室温孵育1 h;弃酶标二抗,PBS洗4次;加底物显色剂50 ml/孔,室温避光反应30 min;每孔加入2 mol/L H2SO4终止反应;酶标仪OD450 nm处测定,测定值高于阴性对照3倍以上者为阳性。
1.2.5 阳性杂交瘤细胞的克隆化培养 经两次检测均为阳性的杂交瘤细胞,采用有限稀释法进行亚克隆化。克隆前1 d制备饲养细胞层(同细胞融合),将要克隆的杂交瘤细胞从培养孔内轻轻吹干,计数。调整细胞为3~10个细胞/ml。取前一日准备的饲养细胞层的细胞培养板,每孔加入稀释细胞100 μl。孵育于37℃、5%CO2孵箱中。在第7天换液,以后每2~3 d换液1次。8~9 d可见细胞克隆形成,及时检测抗体活性。将阳性孔的细胞移至24孔板中扩大培养。每个克隆尽快冻存。
1.2.6 单克隆抗体的大量生产 取健康BALB/c小鼠,每只腹腔注射0.5 ml高压灭菌的液体石蜡,10 d后往小鼠腹腔注射杂交瘤细胞。接种细胞10 d待小鼠腹部变大、濒临死亡时收集腹水至离心管中,1 500 r/min,离心10 min,吸取上清,去掉脂肪层分装后贮存于-20℃冰箱,进一步纯化。
1.2.7 单克隆抗体的纯化 收集到的小鼠腹水用饱和硫酸铵溶液滴加至溶液浓度为33%,过夜,离心,去上清,PBS透析除盐。
1.2.8 单克隆抗体类和亚类的鉴定 离心处理样品,用PBS按照1∶1 000比例稀释腹水样品和阴性对照品。取100 μl分别包被到ELISA板中,每种样品一列,每列6个孔,取PBS为空白对照,酶标板置于室温1 h。用PBST洗板3次,分别加入同型试剂 IgA、IgM、IgG1、IgG2a、IgG2b、IgG3(Sigma公司生产),将每种亚型抗体分别加入到空白孔、阴性对照和腹水样品孔中,每孔100 μl,室温放置30 min。PBST洗板3次,每孔加入1∶500稀释的HRP标记的马抗羊二抗(北京鼎国生物技术责任公司),每孔100 μl,室温放置15 min。PBST 洗板3 次,每孔加入底物液 100 μl,放置 10 min 后加 50 μl终止液,用酶标仪在490 nm处读数记录。
1.2.9 杂交瘤细胞的核型分析 取处于对数生长期的杂交瘤细胞,加入秋水仙素到培养液中,使其终浓度为0.5 μg/ml,在培养箱中继续培养4~6 h。收集细胞,1 000 r/min离心5 min,弃去上清,将37℃预温0.075 mol/L的KCL溶液加入,放置培养箱中静置20~30 min。往细胞悬液中加入新鲜配制的醋酸-甲醇固定液1 ml,用吸管轻轻吹打,1 000 r/min离心5 min。把上清液弃去,缓慢加入新鲜固定液5 ml,用吸管轻轻吹打,静置20~30 min,1 000 r/min离心5 min,吸出大部分上清,留1 ml左右。取2~3滴细胞悬液,从较高处距离向预冷的载玻片滴加,在室温中自然干燥。常规Giemsa染色,镜下计数染色体。
2 结果
2.1 抗单核李斯特菌单克隆抗体特异性的鉴定 共进行10次细胞融合,融合率为32%(1 065/3 360)。通过初筛,与单增李斯特菌呈强阳性反应、大肠埃希菌呈阴性反应孔为193孔。进一步鉴定此193个样品与下表所列菌种的反应性,筛选出与其无交叉反应的产抗单核李斯特菌单克隆抗体的杂交瘤细胞株,命名为2F5、5H1 和8F9。
2.2 杂交瘤细胞的核型 筛选出的产抗单核李斯特菌单克隆抗体的细胞系2F5、5H1和8F9,经常染色体染色可见染色体数显著增加,为杂交瘤细胞。见图1。
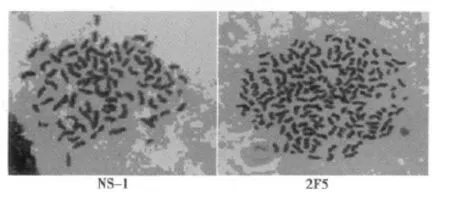
图1 杂交瘤细胞核型
2.3 单克隆抗体类与亚类 经间接ELISA方法测定,2F5、5H1和8F9单克隆抗体类型分别为IgG2b、IgG3、IgM,检测样品OD490值分别为 0.742、1.072、2.064。
3 讨论
李斯特菌在上世纪90年代被列为4大重要的致病菌之一〔6〕。WHO食品安全工作计划已将单增李斯特菌列为重点监测的食源性病菌之一〔7,8〕。目前,检测单增李斯特菌传统的方法是分离培养和生化鉴定,检测时间长,灵敏度不高,不利于疾病的预防和控制。所以,为了改进单增李斯特菌的检测方法,建立对该菌快速检测是很必要的。
本研究利用产单核李斯特菌菌体蛋白免疫动物Balb/c小鼠,多次反复经背部皮下多点注射,每次注射应定量,并注重接种的时间间隔,适当添加弗氏佐剂。经过一段时间的饲养后,选择血清抗体滴度高的接种动物,在无菌情况下处死,取出脾脏剪碎、分离、离心取其悬浮细胞置入培养皿中,备用。再另取纯系小鼠的骨髓瘤细胞放进培养皿中,加入一些饲养细胞(如巨噬细胞)促使其生长,在该混合液中有多种细胞。经过细胞融合实验,提取目的细胞——杂交瘤细胞,进行HAT选择培养获得纯代杂交瘤细胞。在众多的杂交瘤细胞中,有的不表达免疫球蛋白,有的表达其他类型的球蛋白。因此,要用特异性的检测方法——酶联免疫吸附试验(ELISA)从众多的细胞中筛选出阳性杂交瘤细胞。有限稀释法将目的杂交瘤细胞分离成单个细胞,让其克隆化形成细胞株,再转移至其他培养基中扩大培养。为了大量地获得抗体,还需要经过小鼠腹腔接种,诱导小鼠腹水,然后从腹水中分离提纯抗体。从小鼠腹水中获取的单克隆抗体,通过亲和层析方法进行纯化,可获得纯化的单克隆抗体,该抗体纯度较好、效价较高。与过去传统的方法比较,提高了实验方法的灵敏性、准确性、特异性和标准化。
单克隆抗体只与抗原分子上某一个表位(即抗原决定簇)相结合,利用这一特性可把它作为研究工作中的探针,可以从分子、细胞和器官的不同水平上,研究抗原物质的结构与功能的关系,并可从理论上阐明其机制。如用荧光物质标记单抗作为探针,能方便地确定与其结合的相应生物大分子(蛋白质、核酸、酶等)在细胞中的位置和分布。本研究旨在研制抗单增李斯特菌单克隆抗体,为今后进一步检测单克隆抗体奠定基础。
1 Yundong Chi-Zhang,Kit L Yam.Effective control of Listeriamonocytogenes by combination of nisin formulated and slowly released into a broth system〔J〕.Intern J Food Microbiol,2004;90:15-22.
2 熊国华,于 莉,曹际娟,等.单增李斯特菌免疫胶体金试纸条快速检测〔J〕. 中国公共卫生杂志,2008;24(2):248-9.
3 王海燕,刘中学,刘 虹,等.视频中单增李斯特菌快速、敏感、特异PCR检测方法的建立〔J〕.检验检疫学刊,2006;(1):3-6.
4 吴清平,李善志,张菊梅,等.单核细胞增生李斯特菌检测技术研究进展〔J〕.中国卫生检验杂志,2005;15(7):888-90.
5 Becker B,Jordan S,Holzapf WH,et al.Rapid and specific detection of Listeria monocytogenes in smoked salmon with BAX2 PCR〔J〕.Food Cont rol,2005;16(8):7172721.
6 陈道利,陶 勇,霍开兰,等.直接入口食品中单核细胞李斯特菌污染调查及其检验方法比较〔J〕.中国卫生检验杂志,2003;8(4):492-3.
7 李干红,丁晓雯.李斯特菌及其快速检测〔J〕.广州食品工业科技,2002;18(3):67-9.
8 周晓辉,焦新安.产单核细胞李斯特菌的分子鉴定与亚分型研究〔J〕. 中国人兽共患病杂志,2003;19(5):44-7.

