前列腺素E2与腺苷协同抑制肿瘤浸润淋巴细胞活性的作用
王启船 樊青霞 (郑州大学第一附属医院肿瘤科,河南 郑州 450052)
肿瘤免疫过继治疗是近年来肿瘤免疫治疗的研究热点之一,主要是从肿瘤患者中分离免疫活性细胞,在体外进行扩增和功能鉴定,然后回输给患者。肿瘤浸润性淋巴细胞(TIL)是从肿瘤组织中分离出来的淋巴细胞,经离体培养,由IL-2诱导而成,具有特异性杀伤肿瘤的活性〔1,2〕,其主要来源为手术切除所获得的实体肿瘤组织和浸润淋巴结等。目前是国际上研究和应用的主要免疫疗法。前列腺素E2(PGE2)在淋巴细胞发育与增殖等方面具有重要作用,腺苷则是公认的具有抑制细胞免疫功能的分子,两者都参与了机体的免疫调节,但对于TIL影响的报道甚少。我们通过PGE2与腺苷的协同作用,观察是否能够影响IFN-γ和TGF-β的分泌,抑制TIL的杀伤功能。
1 材料与方法
1.1 一般资料 郑州大学第一附属医院病理科2010年经病理诊断为胃癌的手术切除肿瘤组织标本18例(男6例,女12例),年龄42~71岁,平均52.6岁,患者术前均未接受过化学或放射治疗。
1.2 主要试剂 细胞因子IFN-γ和TGF-β酶联免疫吸附试验(ELISA)检测试剂盒购自 eBioscience公司,腺苷,PGE2购自Sigma公司,细胞因子IL-2购自R&D公司,淋巴细胞分离液购自郑州九是生物公司,PRMI1640培养基、胰蛋白酶购自Gibco公司,人胃癌细胞株SCG-7901由郑州大学第一附属医院肿瘤内科提供。
1.3 肿瘤组织中浸润淋巴细胞的制备 无菌获取胃癌患者手术切除的新鲜肿瘤组织,低温转移至实验室。用D-Hanks液冲洗组织表面血液并剪成5 mm3左右大小的组织块,置于0.25%胰蛋白酶中在37℃条件下消化约20 min,随后用吸管吸取消化后的组织经200目无菌细胞筛网过滤。过滤后的细胞悬液用淋巴细胞分离液通过密度梯度离心后获得单个核细胞,洗涤后置于含IL-2的PRMI1640完全培养基中培养、扩增,定期换液。
1.4 TIL细胞毒性的检测 细胞毒性实验在96孔培养板中进行。效应细胞为上述成功制备的TIL细胞,靶细胞为SCG-7901细胞株。将效应细胞与靶细胞按效/靶比例100/1、50/1、25/1、12.5/1加入梯度稀释的效应细胞与标记好的靶细胞各100 μl/孔,每个比例3复孔。同时以RPMI1640和PBS各100 μl为空白孔调零。效-靶细胞作用96孔培养板在37℃ 5%CO2培养箱孵育48 h后,加入 MTT(噻唑蓝)10 μl/孔,3 000 r/min离心5 min,弃上清。每孔加入DMSO 200 μl,震荡后在570 nm处检测各孔的吸光度值。细胞杀伤百分率=〔1-(杀伤孔-效应孔)/靶细胞孔〕×100%。
1.5 细胞因子的检测 将分离得到的TIL细胞计数后以1×105/孔的密度接种于96孔细胞培养板中,腺苷(50 μmol/L)和PGE2(50 nmol/L)单独或共同作用于每孔细胞,共同孵育16 h后收获上清,用ELISA试剂盒检测上清中细胞因子的含量。
1.6 统计学方法 采用SPSS15.0医学统计软件的t检验分析,所有数据均以s表示。
2 结果
2.1 PGE2与腺苷能够协同抑制TIL的细胞毒性作用 与对照组比较〔(57.97±3.51)%〕,单独的PGE2或腺苷作用均可以使TIL细胞的杀伤作用减弱〔(19.58±1.57)%、(34.91±3.79)%〕,但两者联合应用的抑制效应明显高于单独作用〔(7.79±2.09)%〕,并且随着效应细胞的比例升高,抑制TIL细胞杀伤作用的功能进一步增强(P<0.05)。
2.2 PGE2与腺苷联合作用刺激TIL能够抑制其IFN-γ的分泌 单独的PGE2或者腺苷均不能明显抑制TIL分泌IFN-γ,但两者联合作用可以使IFN-γ的分泌大大减少(P<0.05),这与两者对TIL细胞毒性的结果类似,说明二者联合作用具有叠加效应,从而抑制细胞因子IFN-γ的分泌(P<0.05)。腺苷单独作用或PGE2与腺苷联合作用均可以刺激TIL细胞TGF-β的分泌,且联合作用所表现出的效应更加明显(P<0.01),PGE2单独作用对TGF-β的分泌没有明显影响。说明两者在对TGF-β的分泌上也表现出了协同作用。见表1。
表1 PGE2和CADO对肿瘤浸润淋巴细胞细胞因子分泌的影响( s ,ng/L)
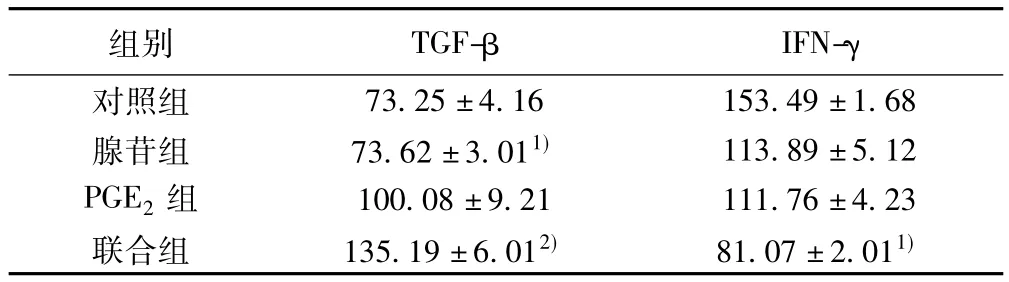
表1 PGE2和CADO对肿瘤浸润淋巴细胞细胞因子分泌的影响( s ,ng/L)
组别 TGF-β IFN-γ 73.25±4.16 153.49±1.68腺苷组 73.62±3.011) 113.89±5.12 PGE2组 100.08±9.21 111.76±4.23联合组 135.19±6.012) 81.07±2.011)对照组
3 讨论
众所周知,免疫监控系统在抗肿瘤细胞生长中起着重要的作用。因此,如果增强体内的抗肿瘤免疫反应,将有可能会改善癌症病人的生存状况。TIL因携带有针对肿瘤的特异性抗原而在抗肿瘤方面起到了尤为重要的作用,不少细胞免疫疗法主要针对体内肿瘤特异性TIL来进行研究,已有研究证明TIL回输治疗肿瘤具有较好的疗效〔3〕。但该治疗方式在获得肯定之余,也面临着一些困难和制约。
PGE2在免疫调节中发挥着重要的作用,包括抑制T淋巴细胞在体外的增殖、分化及细胞因子的分泌等〔4,5〕,但最近也有学者指出其对于Th1和Th17细胞发挥着与以往认知不同的调控作用〔6〕。腺苷是一种遍布人体细胞的内源性分子,在机体处于炎症情况的时候合成增加,通过与四种G蛋白耦联的受体-A1,A2A,A2B和A3结合发挥生物功能。目前大多数的研究认为腺苷具有强大的抗炎作用,在炎症发展的过程中,它可以对炎症细胞释放出一种“停止”信号从而使机体免受更大程度炎症反应的损害〔7〕。这两种物质单独应用都具有免疫调节功能,但是他们对TIL的影响报道较少,同时两者的联合应用是否能够抑制TIL的抗肿瘤效应、降低其杀伤功能也鲜见报道。
TGF-β可以通过抑制淋巴细胞的活性,协助肿瘤细胞逃避机体的免疫监视;以及通过刺激肿瘤组织内新生血管形成及细胞外基质合成而对肿瘤的生长起促进作用〔8〕,而IFN-γ作为Th1型细胞因子,在活化固有免疫细胞(如巨噬细胞),促进Th0细胞向Th1分化,以及提高CD8+T细胞的杀伤活性上均具有重要作用。在本实验中,我们成功分离了胃癌患者的TIL,并使用PGE2与腺苷单独或联合作用对上述假说进行了论证。实验结果表明无论是在抑制TIL细胞杀伤功能或是调节TIL细胞相关细胞因子分泌方面,两者都表现出了很强的协同作用。两者的联合作用使得TIL的杀伤功能显著下降,远远高于单独使用所表现出的抑制效应;在对细胞因子IFN-γ和TGF-β的研究中也发现了类似的结果。上述实验结果均提示我们PGE2与腺苷联合作用调控TIL细胞抗肿瘤效应的可能性。我们的实验证明了两者对TIL的抑制效应具有协同性,使得人们在进行TIL细胞过继性治疗的时候多了一个新靶点。即如何使TIL细胞对这两种物质的刺激脱敏,从而减弱其对TIL杀伤效应的抑制作用,达到增强TIL抗肿瘤效应的作用。当然,为了实现这一目标,我们还需要更加深入的研究。
1 Schwartzentruber DJ,Topalian SL,Mancini M,et al.Specific release of granulocyte-macrophage colony-stimulating factor,tumor necrosis factoralpha,and IFN-gamma by human tumor-infiltrating lymphocytes after autologous tumor stimulation〔J〕.J Immunol,1991;146(10):3674.
2 Goff SL,Smith FO,Klapper JA,et al.Tumor infiltrating lymphocyte therapy for metastatic melanoma:analysis of tumors resected for TIL〔J〕.J Immunother,2010;33(8):840.
3 Kradin RL,Boyle LA,Preffer FI,et al.Tumor derived interleukin-2 dependent lymphocytes in adoptive immunotherapy of lung cancer〔J〕.Cancer Immunol Immunother,1987;24(1):413.
4 Yuhki K,Ueno A,Naraba H,et al.Prostaglandin receptors EP2,EP3,and IP mediate exudate formation in carrageenin-induced mouse pleurisy〔J〕.J Pharmacol Exp Ther,2004;311(10):1218-24.
5 Biswas S,Bhattacherjee P,Paterson CA,et al.Ocular inflammatory responses in the EP2 and EP4 receptor knockout mice〔J〕.Ocul Immunol Inflamm,2006;14(3):157-63.
6 Daiji Sakata,Chengcan Y,Shuh Narumiya.Prostaglandin E2:an immunoactivator〔J〕.J Pharmacol Sci,2010;112(1):1-5.
7 Sitkovsky MV,Ohta A.The“danger”sensors that STOP the immune response:the A2A adenosine receptors〔J〕?Trends Immunol,2005;26(2):299-304.
8 Van Komen JS,Mishra S,Byrum J,et al.Early and dynamic polarization of T cell membrane rafts and ronstituents prior to TCR stop signals〔J〕.J Immunol,2007;79(18):6845-55.

