金雀异黄素对D-半乳糖损伤的乳鼠皮肤成纤维细胞的作用
顾翠英 韩志芬 夏花英 蒋嘉烨 曹红平 金国琴 (上海中医药大学,上海 201203)
成纤维细胞的生物学特性改变是皮肤瘢痕是否增生的决定性因素。由此提出,是否可通过改变皮肤成纤维细胞的生物学特性以抑制瘢痕增生?金雀异黄素(Gen)是一种植物雌激素,能结合并激活哺乳类动物及人类的雌激素受体(ER),具有类雌激素和(或)抗雌激素活性的双重作用,故Gen既能作为雌激素又能作为抗雌激素使用。至于Gen发挥雌激素样和(或)抗雌激素样何种效应为主,则与使用剂量等因素有关。本课题拟在D-半乳糖(D-gal)损伤小鼠皮肤成纤维细胞(MSFs)模型基础上,主要从ER、抗氧化及形态变化等角度,观察Gen对MSFs的影响,为临床治疗增生性瘢痕等皮肤纤维化疾病提供实验和理论依据。
1 材料与方法
1.1 实验动物 新生24 h的 KM乳鼠,SPF级,雌雄不分,由上海中医药大学实验动物中心提供。
1.2 主要药品试剂 PRMI-1640培养基、0.25%Trypsin&0.02%EDTA(吉诺生物医药技术有限公司);胎牛血清(杭州四季青生物工程材料有限公司);D-GAL、Gen和四甲基偶氮唑盐(Sigma公司);RT试剂盒(北京百泰克生物技术有限公司);超氧化物歧化酶(SOD)、丙二醛(MDA)和乳酸脱氢酶(LDH)测试试剂盒(南京建成生物工程研究所);PCR引物合成(上海生工生物科技公司)。
1.3 主要实验仪器 CO2培养箱,德国Heraeus公司。垂直式无菌无尘操作台,造鑫企业有限公司。倒置相差显微镜,日本Olympus公司。PCR扩增仪,德国Biometra公司。多功能成像系统,上海天能科技有限公司。电泳槽和电转仪,美国Bio-Rad公司。
1.4 方法
1.4.1 MSFs的原代培养和传代 本实验MSFs培养方法参照胡晋红等〔1~4〕相关文献,采用组织块培养法进行原代培养,操作中个别技术作少许改良。超净台上无菌获取新生24 h的KM乳鼠皮肤,精细镊去掉皮肤下的血管等其他组织,眼科剪剪成皮肤小块后置培养瓶,37℃,5%CO2培养箱中培养。待培养的组织块有大量细胞游出,剔弃组织,胰酶消化,以5×104/ml密度接种于25 cm2培养瓶,置培养箱培养。待原代培养的MSFs细胞汇合率达80% ~90%左右时,按1∶2或1∶2.5的比例进行传代培养。
1.4.2 MSFs的冻存与复苏 MSFs的冻存:冻存液为90%完全培养基+10%二甲基亚砜(DMSO)。取第2~4代细胞,调整细胞密度至5×105/ml后,依次进行如下操作:4℃放置30 min、-20℃放置30 min,最后置-80℃冰箱冷冻保存备用。
MSFs的解冻与复苏:从-80℃冰箱取冻存管,迅速置37℃恒温水浴箱中轻柔摇动,使其在1~2 min内完全解冻。用含20%胎牛血清的培养液,调整密度后接种于培养瓶中,置于37℃,5%CO2培养箱中培养,24 h内全量换液。
1.4.3 实验分组 实验分为三组:空白对照组:用纯1640培养液培养细胞;D组:用10g/L D-gal药液处理细胞;D+G组:用10 g/L D-gal+0.5 mg/L Gen药液处理细胞。
1.4.4 SOD活性、MDA含量和LDH活性的测定 取第3~8代的MSFs,以5×104/ml的密度接种于25 cm2或75 cm2培养瓶。培养细胞3~4 d后,吸弃培养液,实验组分别加入纯1640培养液、10 g/L D-gal和 10 g/L D-gal+0.5 mg/L Gen,作用24 h,终止培养,取细胞上清液严格按试剂盒说明书操作,分别检测SOD活性、MDA含量和LDH活性。
1.4.5 RT-PCR法检测 MSFs的ERα mRNA和 ERβ mRNA的表达。
1.4.5.1 提取总RNA及引物设计 收集药物作用24 h的MSFs,按Trizol试剂盒说明书提取总RNA,测定并计算A260/A280比值。参考相关文献〔5〕设计雌激素受体 ER的引物。ERα 上游引物:5'-GACCAGATGGTCA GTGCCTT-3',ERα 下游引物:5'-ACTCGAGAAGGTGGACCTGA-3',扩增片段为205 bp;ERβ上游引物:5'-CAGTAACAAGGGCATGGAAC-3',下游引物:5'-GTACATGTCCCACTTCTGAC C-3',扩增片段为 243 bp;β-actin 上游引物:5'-AACAGTCCGCCTAGAAGCAC-3',下游引物:5'-CGTTGACATCCGTAAAGACC-3',扩增片段为295 bp。引物合成由上海生工生物科技公司完成。
1.4.5.2 RT-PCR反应及扩增条件 RT-PCR反应体系参照试剂盒说明,RT反应总体积为20 μl,PCR 反应体系为25 μl;扩增条件:反应条件为95℃预变性5 min,然后95℃变性30 s,65℃退火60 s,72℃延伸25 s,循环45次;72℃最后延伸5 min,4℃保存。产物经琼脂糖凝胶电泳,上海天能科技有限公司Tanon 2500多功能成像系统处理。
1.5 统计学处理 采用SPSS13.0软件包分析,实验数据以s表示,多组间均数比较使用单因素方差分析。
2 结果
2.1 MSFs形态 采用组织块贴壁法培养细胞时,24 h即可见较多细胞从组织的边缘游出(见图1),到第3天就可见大量的细胞从组织块迁延出,并向四周扩散生长(见图2)。第3~8代的MSFs生长迅速,细胞融合后,排列紧密,多呈放射状、编织状或漩涡状走行,有的交叉重叠生长。细胞体呈长梭形、三角形或不规则形,胞质透明,向外伸出2~3个长短不一的突起。
2.2 Gen对D-gal损伤的MSFs形态变化的影响 分别为用纯1640培养液(空白组)、10 g/L D-gal(D组)和10 g/L D-gal+0.5 mg/L Gen(D+G组)处理24 h的细胞。由图2可见,与空白组比较,D组的胞体明显变细,而D+G组胞体的形状介于空白组和D组之间,但D+G组的细胞同时存在破损现象,推测Gen对D-gal处理后的细胞生长形态有一定的改善作用,随着D-gal作用时间的延长,D组的细胞皱缩,形状变成细条形,胞体突起逐渐断裂脱落,细胞出现固缩、脱落,直至离壁死亡。
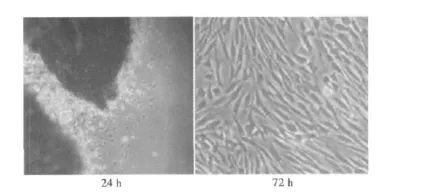
图1 MSFs形态(×40)
2.3 Gen对D-gal损伤的MSFs上清液中SOD活性、MDA含量和LDH活性的影响 由表1可见,与空白对照组相比,D组SOD活性显著低于空白对照组(P<0.01)。与D组相比,D+G组和空白对照组的SOD活性显著高于D组(P<0.01)。与空白对照组相比,D组和D+G组的MDA含量显著高于空白对照组(P<0.01)。与D组相比,D+G组的MDA含量显著高于D组(P<0.01),说明10 g/L D-gal和10 g/L D-gal+0.5 mg/L Gen均对MSFs造成损害,而0.5 mg/L Gen则加剧了这种损害。与空白对照组相比,D组和D+G组的LDH活性显著高于空白对照组,(P<0.01)。与D组相比,D+G组LDH活性显著高于 D 组(P <0.01),说 明 10 g/L D-gal和 10 g/L D-gal+0.5 mg/L Gen均损伤了 MSFs膜,而0.5 mg/L Gen加剧了对MSFs细胞膜的损伤。
表1 药物处理24 h后细胞培养液中SOD、LDH的活性和MDA的含量( s ,n=7)

表1 药物处理24 h后细胞培养液中SOD、LDH的活性和MDA的含量( s ,n=7)
与空白对照组比较:1)P<0.01;与D-gal组比较:2)P<0.01
组别 SOD(U/ml)MDA(nmol/mlL)LDH(U/L)空白对照组 10.25±2.442) 0.51±0.2882) 447.09±19.802)D组 6.63±1.041) 3.75±0.3561) 774.95±11.641)D+G组 10.83±1.801) 4.16±0.5471)2) 846.45±17.421)2)
2.4 Gen对D-gal损伤的MSFs中ER mRNA表达的影响
2.4.1 各组培养细胞ER mRNA表达的RT-PCR产物电泳鉴定结果 见图3。
2.4.2 Gen对D-gal损伤的 MSFs中 ERα mRNA和 ERβ mRNA表达影响 将RT-PCR电泳条带经图像扫描仪分析,以目的基因扩增条带/β-actin扩增条带比值表示 ERα mRNA或ERβ mRNA相对表达水平。由表2可见:ERα和ERβ在培养的MSFs中均有表达,但ERα的表达明显强于ERβ。与空白对照组相比,D组稍有下调ERα mRNA表达的趋势,而D+G组明显下调ERα mRNA表达(P<0.05);与D组相比,D+G组显著下调ERα mRNA表达(P<0.05)。Gen对MSFs的ERβ mRNA表达影响:与空白对照组相比,D组和D+G组均明显上调ERβ mRNA的表达;与 D组相比,D+G组则显著上调 ER-β mRNA的表达(P<0.05)。

图2 Gen对D-gal损伤MSFs形态变化的影响(×400)
表2 RT-PCR检测各组培养细胞ERα mRNA和ERβ mRNA的表达变化( s ,n=3)

表2 RT-PCR检测各组培养细胞ERα mRNA和ERβ mRNA的表达变化( s ,n=3)
与空白对照组比较:1)P<0.05,2)P<0.01;与D组比较:3)P<0.05
比值空白对照组 0.90±0.03 0.44±0.023)组别 ERα/β-actin比值 ERβ/β-actin D组 0.89±0.02 0.53±0.051)D+G组 0.71±0.071)3) 0.64±0.042)3)
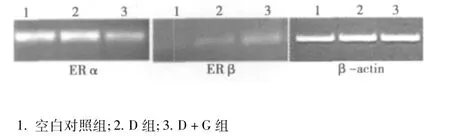
图3 ERα mRNA和ERβ mRNA的RT-PCR电泳图
3 讨论
成纤维细胞能合成和分泌胶原蛋白、弹性蛋白、生成胶原纤维、网状纤维和弹性纤维等基质成分〔6〕。研究发现,成纤维细胞是皮肤组织受损后的主要修复细胞。正常的伤口愈合过程中,胶原的合成与降解之间维持着平衡状态。但在病理性瘢痕中,这种正常的平衡被破坏,胶原的合成明显超过降解,最终导致胶原的大量堆积。而胶原合成的增加可能是成纤维细胞数目增加或是胶原合成率增高的缘故。瘢痕疙瘩是病理性瘢痕的一种,其本质可能是成纤维细胞的异常增生和以胶原为主的细胞外基质过度沉积〔7〕。
雌激素作为全身调节因素之一,对成纤维细胞的增殖及其胞外基质的合成具有重要调节作用,与纤维化疾病的发生、发展关系密切,因而抑制雌激素作用有可能对纤维化疾病的治疗产生积极的影响〔8〕。已知雌激素能通过与ER结合调控细胞的分化和增殖。ER的两种亚型分别为ER-α和ER-β。两种亚型在同一组织细胞上的表达水平不同,且ERβ对于ERα有抑制和调控作用〔9〕。研究表明,ERα 和 ERβ 均存在于 MSFs中〔10〕,易受到雌激素的影响。雌激素可通过ERα和ERβ直接调控成纤维细胞的增殖。Gen是一种植物雌激素,Gen的化学结构和分子质量与雌二醇相似,故能与雌二醇竞争雌激素受体,在一定的剂量范围内产生抗雌激素效应。有报道提出〔11〕植物雌激素浓度>0.5 mg/L时,其对细胞的增殖有抑制作用。余增丽等〔12〕研究报道,Gen能够下调ERα的mRNA转录,但不抑制ERβ的转录。还有研究报道,一定浓度的雌二醇作用于离体的绝经后妇女皮肤组织成纤维细胞后,检测成纤维细胞ER mRNA水平,发现以ERβ的上调为主,提出ERβ在成纤维细胞中具有优势地位并存在与ERα的协同作用〔13〕。本实验结果表明,Gen能通过下调培养的 MSFs的 ERαmRNA表达和上调ERβ mRNA表达,改善对D-gal处理的模型细胞的生物学性状。本研究结果与文献报道基本类似。
自由基衰老学说认为,细胞代谢过程中产生的氧自由基对于细胞成分的累积性损伤是引起细胞衰老与增殖能力丧失的重要因素,细胞内氧化与抗氧化体系的失衡是引起细胞损伤或衰老的重要原因。本实验采用试剂盒法检测SOD,是通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O-2),后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见分光光度计(波长为550 nm)测其吸光度。当被测样品中含有SOD活性时,则对超氧阴离子自由基有专一性的抑制作用,使形成的亚硝酸盐减少,使测定管的吸光度值低于对照管的吸光度值,通过试剂盒说明书公式计算可求出被测样品中的SOD活性。Gen在碳4、5、7位含有 三个酚性羟基,可作为供氢体与自由基反应,淬灭氧自由基,同时,Gen有诱导抗氧化酶SOD活性的作用〔14〕。MDA是脂质过氧化产物,测定MDA可间接反映自由基水平和脂质过氧化程度,其含量高低是组织细胞损伤的重要标志〔15〕。同时,MDA可以促进胶原的氧化交联,一般老化的细胞氧化交联较高,而年轻的细胞交联则较低。本研究结果表明Gen的作用是以提高SOD活性占主导地位,促进模型细胞抗氧化作用,避免过多的细胞遭受D-gal的损伤作用。
本课题结果还表明,0.5 mg/L Gen处理D-gal损伤的模型细胞,可使MDA含量和LDH活性增高,通过MDA的氧化损伤作用,一定程度上有利于抑制成纤维细胞过度生长,抑制瘢痕的增生;但同时Gen也增高了SOD活性,加强了Gen对模型细胞的抗氧化损伤能力,保护模型细胞免遭过度氧化损伤。有研究报道提出〔16〕,高浓度植物雌激素也能产生一定的细胞毒素,这是否是导致Gen处理后,MDA含量和LDH活性增高的原因有待进一步探明。
Gen作为一种特异性酪氨酸蛋白激酶(TPK)抑制剂,能阻断生长因子受体TPK信号转导途径,从而抑制细胞的过度增殖和胶原合成,对纤维化疾病(增生性瘢痕和瘢痕疙瘩)具有治疗作用〔7〕。推测Gen对模型细胞的作用机制除了通过抑制酪氨酸激酶,阻断TPK信号转导途径而调节细胞外基质的合成及纤维化有关外,有可能还通过ER介导的或非ER介导途径的抗氧化作用,以抑制组织纤维化作用,抑制疤痕增生。但对ER介导的或非ER介导途径的抗氧化作用之间联系的详细分子机制,及Gen对其作用的环节或靶点还需做更深入的实验研究。
1 胡晋红.皮肤药理学〔M〕.北京:化学工业出版社,2008:201-2.
2 林 真,沈晓丽,王孟丽,等.昆明小鼠胚胎成纤维细胞培养条件的研究〔J〕. 临床和实验医学杂志,2010;9(3):161-2.
3 王孟丽,沈晓丽,林 真,等.人皮肤成纤维细胞分离培养的研究〔J〕. 心血管康复医学杂志,2009;18(5):449-53.
4 杨艾玲,王欣宇,安江峰,等.经皮植入体对大鼠皮肤成纤维细胞的作用研究〔J〕. 化学与生物工程,2009;26(11):50-2.
5 Masayoshi Tachibana,Takashi Kasukabe,Yasuhito Kobayashi,et al.Expression ofestrogen receptor α and β in the mouse cornea〔J〕.Inves Ophthalmol Visu Sci,2000;41(3):668-70.
6 邹仲之.组织学与胚胎学〔M〕.第6版.北京:人民卫生出版社,2004:22-3.
7 曹 川,李世荣,戴 霞,等.三羟基异黄酮抑制增生性瘢痕成纤维细胞转分化作用的研究〔J〕.第三军医大学学报,2008;30(7):618-21.
8 朱 青,尹格平.雌激素对纤维化疾病的影响〔J〕.实用医药杂志,2003;20(6):470-2.
9 张 欢,李青峰.雌激素对皮肤衰老的调控〔J〕.组织工程与重建外科杂志,2009;5(1):58-60.
10 Ashcroft GS,Mills SJ,Lei K,et al.Estrogen modulates cutaneous wound healing by downregulating macrophage migration inhibitory factor〔J〕.J Clin Invest,2003;111(9):1309-18.
11 钱 革,周 武,吴剑波.植物雌激素对体外培养的正常人皮肤成纤维细胞的作用〔J〕.中国美容医学,2009;18(4):494-6.
12 余增丽,张立实,吴德生.金雀异黄素的抗雌激素效应〔J〕.卫生研究,2003;32(2):125-7.
13 Susan S,Julie T.Effect of estrogens on skin aging and the potential role of SERMs〔J〕.Clin Int Aging,2007;2(3):283-97.
14 闫祥华,顾景范,孙存普,等.大豆异黄酮对大鼠血脂和过氧化状态的影响〔J〕. 营养学报,2000;22(1):31-5.
15 徐贵森,刘合年,杨淑霞,等.缺血再灌注脊髓丙二醛含量和超氧化物歧化酶活性的变化〔J〕.西南军医,2006;8(2):10-1.
16 Maggiolini M,Bonofiglio D,Marsico S,et al.Estrogen receptor alpha mediabetes the proliferative but not the cytotoxic dose-dependent effects of two major phytoestrogens on human breast cancer cells〔J〕.Mol Pharmacol,2001;60(3):595-602.

