整合素αvβ3在血管紧张素Ⅱ诱导人脐静脉内皮细胞衰老中的变化
邹美圣 刘 凌 刘 泽 (广州军区广州总医院干部病房五科,广东 广州 510010)
炎性衰老中的促炎性反应与老年相关疾病如动脉粥样硬化(AS)等密切相关〔1〕。在炎症反应中,血管紧张素Ⅱ(AngⅡ)等因素可促进白细胞、单核细胞及淋巴细胞等与内皮细胞黏附。在这些炎症细胞与内皮细胞黏附的过程由细胞表面的细胞黏附分子所介导。整合素αvβ3表达于内皮细胞,通过调节白细胞在内皮细胞表面的滚动速率,介导白细胞与内皮细胞的黏附参与炎症反应〔2,3〕。目前,在AS发病中研究较多的细胞黏附分子主要有细胞间黏附分子(ICAM-1)、血管细胞间黏附分子(VCAM-1)、E-选择素(E-sel)和 P-选择素(P-sel)等,而整合素αvβ3则鲜有报道。本研究旨在探讨在AngⅡ诱导HUVECs衰老中整合素αvβ3表达的变化。
1 材料与方法
1.1 材料及试剂 人脐静脉血管内皮细胞株HUVECs由广州军区广州总医院医学实验科提供;DMEM培养基、胎牛血清、AngⅡ、CCK-8购自美国Sigma公司;细胞周期流式细胞分析试剂盒、细胞衰老特异性β-半乳糖苷酶检测试剂盒购自上海碧云天生物试剂公司;兔抗整合素αvβ3单克隆抗体(CST公司);辣根过氧化物酶标记的山羊抗兔IgG购自聚研生物科技公司,BCA蛋白试剂盒(Thermo scientific公司);PVDF膜、ECL发光液(Millipore,美国);倒置显微镜(Olympus公司,日本);酶标仪(Tecan Genios,瑞士);流式细胞仪(Miltenyi公司,德国),Quantity One凝胶图像处理软件(BD公司)。
1.2 方法
1.2.1 HUVECs的培养和鉴定 HUVECs细胞株贴壁生长于含10%胎牛血清的DMEM培养基中,置于5%CO2、37℃培养箱中培养,每2~3天换液一次维持细胞良好生长状态。待细胞长至融合时用0.25%胰蛋白酶消化、传代。HUVECs呈多角形,单层铺路石样紧密排列。
1.2.2 CCK-8法检测细胞存活率 将细胞以5 000个/孔接种于96孔板中,每孔加100 μl培养液置培养箱过夜,弃去培养液后,对照组(5孔)每孔加入100 μl培养液,实验组(每组5孔)加入含不同浓度(10-8、10-7、10-6和 10-5mol/L)AngⅡ100 μl培养液置培养箱培养48 h,终止培养前向每孔加入CCK-8 20 μl培养1 h,酶联免疫检测仪在450 nm下测定各孔OD值,以药物组与对照组OD值百分比代表细胞增殖率。每组设5复孔,重复3次。
1.2.3 衰老细胞鉴定 细胞长至亚融合后,无血清同步12 h,加入终浓度为10-6mol/L AngⅡ,持续刺激48 h,第12、24小时各补充AngⅡ一次即为AngⅡ诱导的HUVECs衰老模型。对照组为不含AngⅡ上述培养液培养48 h。
1.2.3.1 β-半乳糖苷酶染色 根据细胞衰老β-半乳糖苷酶染色试剂盒操作方法,将原培养板里的培养液弃去,PBS清洗细胞1次,每孔加入SA-β-gal染色固定液1 ml,室温固定15 min。吸除固定液后PBS洗3次,每次3 min。每孔加入染色工作液1 ml,37℃无CO2条件下孵育过夜。用保鲜膜将六孔板封住以防止蒸发。荧光显微镜下每组标本随机选取5个视野,胞浆蓝染者为衰老细胞,计算衰老细胞占观察细胞总数的百分比。
1.2.3.2 细胞周期分析 收获的细胞冷乙醇4℃固定过夜。取5×106细胞,1 000 r/min离心弃乙醇,PBS洗两遍;加入碘化丙啶(PI)染液,4℃避光孵育30 min。过筛后立刻上机检测进行细胞流式周期分析。
1.2.4 Western印迹检测整合素αvβ3水平 收集AngⅡ诱导0、12、24、36、48 h 细胞,用冷 PBS 洗 2 次,加入预冷的含 1%蛋白酶抑制剂的RIPA裂解液冰上充分裂解细胞30 min,4℃、离心30 min取上清分装,加入2倍上样缓冲液沸水变性5 min,-20℃保存备用。根据BCA蛋白浓度定量试剂盒操作说明测定蛋白样品浓度,每个样品上样量为20 μg,蛋白经过12%SDSPAGE凝胶电泳,100 V、2 h,分离后,转移至PVDF膜上,5%脱脂奶粉的TBST室温下缓慢摇动封闭1 h,加入一抗,在4℃孵育过夜,TBST洗涤后,与二抗室温孵育1 h,常规洗膜化学发光试剂显色,X线片显影,计算机图像处理系统对X线片上显影的条带进行定量分析。
1.3 统计学分析 采用SPSS15.0软件进行统计学分析。数据以s表示,计量资料比较采用单因素方差分析。
2 结果
2.1 细胞存活率 CCK-8法检测表明,经不同浓度AngⅡ培养 HUVECs 48 h 后,10-8和 10-7mmol/L AngⅡ组细胞存活率〔(91.67±4.23)%、(86.67±5.06)%〕与对照组比较差异无统计学意义P>0.05);10-6mmol/L AngⅡ组和 10-5mmol/L AngⅡ组存活率〔(97.15±1.85)%、(55.61±7.92)%〕比较差异有统计学意义(P<0.01)。10-5mmol/L AngⅡ在48 h即引起细胞生长停滞,增殖率降低,从而可能因浓度过高而导致细胞凋亡或坏死,不能诱发细胞衰老;10-8mmol/L AngⅡ组和10-7mmol/L AngⅡ在48 h内仍未引起明显的细胞生长停滞,从而可能因浓度过低不至于引起细胞衰老;10-5mmol/L AngⅡ组细胞存活率为(77.15±1.85)%,故本实验选用10-6mol/L AngⅡ建立HUVECs衰老模型。
2.2 衰老细胞鉴定
2.2.1 SA-β-gal活性 SA-β-gal化学染色阳性细胞的胞浆和胞核呈蓝染。染色前用相差显微镜观察细胞形态改变。对照组HUVECs生长良好,呈多角形或梭形;AngⅡ诱导组HUVECs体积较大,形态不一,胞浆中可见较多颗粒或空泡。染色后对照组几乎不表达β-gal,AngⅡ诱导组β-gal阳性细胞数明显增加,约80%细胞染色阳性。见图1。
2.2.2 细胞周期分析 流式细胞术分析结果显示,对照组HUVECs的各期比例正常,AngⅡ诱导大部分细胞停滞于G0/G1期,S期及G2/M期趋于消失(表1),与对照组比较各周期的细胞比例差异有统计学意义(F=92.329,P<0.01)。表明诱导组细胞生长逐渐停滞,细胞增殖能力明显下降。
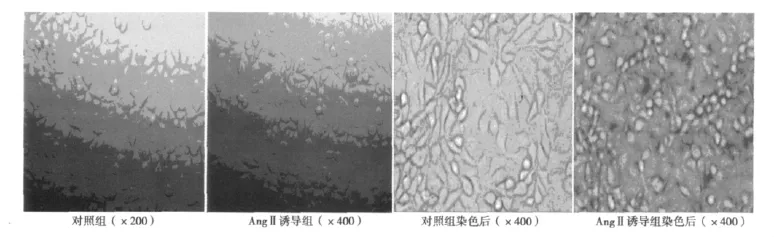
图1 AngⅡ对HUVECs形态及SA-β-gal活性的影响
表1 AngⅡ对细胞周期的影响(%, s,n=5)

表1 AngⅡ对细胞周期的影响(%, s,n=5)
与对照组比较:1)P<0.01
组别 G0/G1期 S期 G2/M期49.5±5.5 31.0±5.3 19.4±1.7 AngⅡ诱导组 89.4±3.41) 8.0±3.11) 2.0±1.51)对照组
2.3 整合素αvβ3的表达 Western印迹法显示,HUVECs静息时表达少量的整合素αvβ3,AngⅡ呈时间依赖性地上调整合素αvβ3表达,AngⅡ诱导 HUVECs 12 h,整合素 αvβ3表达逐渐增高,48 h整合素 αvβ3表达是 0 h的 1.5倍(F=72.582,P <0.01)。见图2。

图2 AngⅡ诱导HUVECs整合素β3表达电泳图
3 讨论
目前血管紧张素系统在血管衰老机制研究中逐渐被重视,AngⅡ信号级联反应随衰老增加,最终促进AS的发展,抑制AngⅡ的活性已被证明能降低心血管疾病的发病率和病死率〔4〕。AngⅡ信号在调节血管老化的许多刺激和信号中有关键性作用。最近研究表明,AngⅡ可通过丝裂原活化蛋白激酶(MAPK)的激活导致血管内皮细胞衰老〔5〕。
本实验结果显示AngⅡ诱导组内皮细胞SA-β-gal活性与对照组相比明显增高,与本课题组前期研究AngⅡ可呈剂量依赖性直接诱导内皮细胞衰老相吻合。AngⅡ诱导血管内皮细胞后,流式细胞仪分析细胞周期发现大多数细胞停滞G0/G1期,而S期及G2/M期趋于消失,表明细胞分裂缓慢,细胞增殖能力逐渐消失,该结果与Unterluggauer等〔6〕报道的内皮细胞衰老后细胞周期分布特点相符,说明用AngⅡ诱导的方法已成功复制衰老的HUVECs模型,可用于细胞衰老机制的研究。
整合素αvβ3是与AS相关的重要黏附因子之一。研究表明整合素αvβ3可以介导白细胞〔7〕和嗜酸性粒细胞〔8〕黏附于培养的HUVECs。Bishop等人〔9〕证实在高糖促进单核细胞和白细胞与内皮细胞黏附增加的机制中,整合素αvβ3起主要中介作用,杜学良等〔10〕人的研究表明,HG能够活化内皮细胞,使整合素αvβ3表达增加,同时内皮细胞与血小板黏附增加。同型半胱氨酸和氧化低密度脂蛋白在切应力作用时,可使血小板与内皮细胞的黏附增加2~3倍,这个现象可显著地被整合素αvβ3拮抗剂所阻断〔11〕。本研究表明AngⅡ呈时间依赖性地上调整合素αvβ3表达,与文献结果相吻合。
另有Kim等〔12〕提出AngⅡ作用后的血管内皮细胞与单核细胞的黏附作用增加,而且与一些主要的黏附因子如E-selectin,VCAM-1和ICAM-1无关,但与高糖(HG)和弱氧化低密度脂蛋白(mmLDL)促进黏附增加可能通过同一黏附因子。但本课题组前期研究观察到AngⅡ可呈剂量依赖性地增加E-sel及P-sel的表达。为什么会出现上述结果不一致,主要与各种黏附分子的功能有关,其具体机制有待于进一步研究。
1 Frannceschi C,Valensin S,Lescai F,et al.Neuroinflammation and the genetics of Alzheimer's disease:the search for a pro-inflamatory phenotype〔J〕.Aging(Milano),2001;13(3):163-70.
2 Zarbock A,Ley K.Mechanisms and consequences of neutropil interaction with the endothelium〔J〕.Am J Pathol,2008;172(1):1-7.
3 Rose DM,Alon R,Ginsberg MH.Intergrin modulation and signaling in leukocyte adhesion and migration〔J〕.Immunol Rev,2007;218(1):126-34.
4 Najjar SS,Scuteri A,Lakatta EG.Arterial aging:is it an immutable cardiovascular risk factor〔J〕?Hypertension,2005;46(3):454-62.
5 Shan HY,Bai XJ,Chen XM.AngiotensinⅡinduces endothelial cell senescence via the activation of mitogen-activated protein kinases〔J〕.Cell Biochem Funct,2008;26(4):459-66.
6 Unterluggauer H,Hütter E,Voglauer R,et al.Identification of cultivation independent markers of human endothelial cell senescence in vitro〔J〕.Biogerontoltgy,2007;8(4):383-97.
7 Piali L,Hammel P,Uherek C,et al.CD31/PECAM-1 is a ligand for alpha v beta 3 integrin involved in adhesion of leukocytes to endothelium〔J〕.J Cell Biol,1995;130(2):451-60.
8 Chiba R,Nakagawa N,Kurasawa K,et al.Ligation of CD31(PECAM-1)on endothelial cells increases adhesive function of alpha v beta3 integrin and enhances beta1 integrin-mediated adhesion of eosinophils to endothelial cells〔J〕.Blood,1999;94(4):1319-29.
9 Bishop GG,McPherson JA,Sanders JM,et al.Selective alpha(v)beta(3)-receptor blockade reduces macrophage infiltration and restenosis after balloon angioplasty in the atherosclerotic rabbit〔J〕.Circulation,2001;103(14):1906-11.
10 杜学良,孙 瑛,陈 莉,等.高糖、高胰岛素对血管内皮黏附功能的影响〔J〕. 中国病理生理杂志,1998;14(1):66.
11 Dardik R,Varon D,Tamarin I,et al.Homocysteine and oxidized low density lipoprotein enhanced platelet adhesion to endothelial cells under flow conditions:distinct mechanisms of thrombogenic modulation〔J〕.Thromb Haemost,2000;83(2):338-44.
12 Kim JA,Berliner JA,Nadler JL.AngiotensinⅡincreases monocyte binding to endothelial cells〔J〕.Biochem Biophys Res Commun,1996;226:862.

