心肌再灌注对抑郁大鼠心肌细胞凋亡以及bcl-2、bax和caspase-3表达的影响*
刘淑珍, 尤 鑫, 熊小栓, 刘兴德
(贵阳医学院附属医院心内科,贵州 贵阳 550000)
1000-4718(2012)03-0453-06
2011-07-21
2012-01-06
贵州省优秀科技教育人才省长资金项目(2005)306号
△通讯作者 Tel: 0851-6908608;E-mail:lxd@gmc.edu.cn
#现工作单位:郑州大学第二附属医院急诊科
心肌再灌注对抑郁大鼠心肌细胞凋亡以及bcl-2、bax和caspase-3表达的影响*
刘淑珍#, 尤 鑫, 熊小栓, 刘兴德△
(贵阳医学院附属医院心内科,贵州 贵阳 550000)
目的探讨心肌缺血再灌注(I/R)对抑郁大鼠心肌细胞凋亡及凋亡基因bcl-2、bax和caspase-3的影响。方法Wistar大鼠32只,随机分为4组,每组各8只。A组:非抑郁大鼠假手术组;B组:抑郁大鼠假手术组;C组:非抑郁大鼠心肌I/R组;D组:抑郁大鼠心肌I/R组。采用慢性轻度不可预知性应激结合孤养制备抑郁模型,用敞箱实验和液体消耗实验观察大鼠行为改变;运用结扎左冠状动脉前降支的方法复制心肌I/R模型。运用TUNEL法检测心肌凋亡细胞;运用免疫组化法和逆转录-聚合酶链反应(RT- PCR)方法检测bcl-2、bax和caspase-3的表达。结果(1)与A、B组比较,C、D组心肌细胞凋亡数量显著增加(P<0.01),A、B两组间比较无显著差异;与C组比较,D组心肌细胞凋亡数量显著增加(P<0.05)。(2)与A、B组比较,C、D组Bcl-2、Bax和caspase-3蛋白和mRNA表达显著增加(P<0.01),A、B两组间比较无显著差异;与C组比较,D组Bcl-2蛋白和mRNA表达显著减少(P<0.05),而Bax和caspase-3蛋白和mRNA表达显著增加(P<0.05)。结论心肌缺血再灌注可加重抑郁大鼠缺血心肌细胞凋亡,其机制可能与上调bax和caspase-3基因表达、下调bcl-2基因表达有关。
心肌再灌注; 抑郁; 大鼠; 细胞凋亡; 基因表达
冠心病(coronary heart disease,CHD)是临床常见疾病,急性心肌梗死(acute myocardial infarction,AMI)是CHD的严重类型,治疗AMI的最有效措施就是尽快进行血运重建,使缺血心肌恢复再灌注,然而,血运重建后常常出现心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤。有学者报道[1],伴抑郁症的心血管疾病患者的死亡率明显增加,且抑郁症在冠心病患者中常常同时存在。那么,伴有心理障碍的冠心病患者一旦发生AMI而行经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗,是否因为合并的抑郁障碍加重再灌注损伤尚不清楚。业已证实,I/R损伤包括再灌注心律失常、心肌顿抑和心肌细胞坏死、凋亡等[2]。本研究拟探讨心肌再灌注对抑郁大鼠缺血心肌细胞凋亡的影响及凋亡相关调控基因bcl-2(B-cell lymphoma/leukemia-2)、bax(B-cell lymphoma/leukemia-2-associated X gene)和caspase-3表达的影响。为临床合并抑郁症的冠心病患者有效防治心肌再灌注损伤提供基础研究资料。
材 料 和 方 法
1动物
Wistar大鼠,雌雄各半,体重200~250 g,贵阳医学院实验动物中心提供。
2主要试剂
TUNEL细胞凋亡试剂盒、免疫组化试剂盒、Bax Ⅰ抗(兔抗IgG)、Bcl-2 Ⅰ抗(兔抗IgG)、caspase-3 Ⅰ抗及DAB显色试剂盒均购自武汉博士德公司;RNAprep pure Tissue Kit、TIANScript RT Kit、DNA marker和2×Taq Plus PCR MasterMix均购自天根生化公司;琼脂糖(西班牙)。所用引物用Primer Pre-mier 5.0软件设计,由上海生工生物工程有限公司合成,见表1。
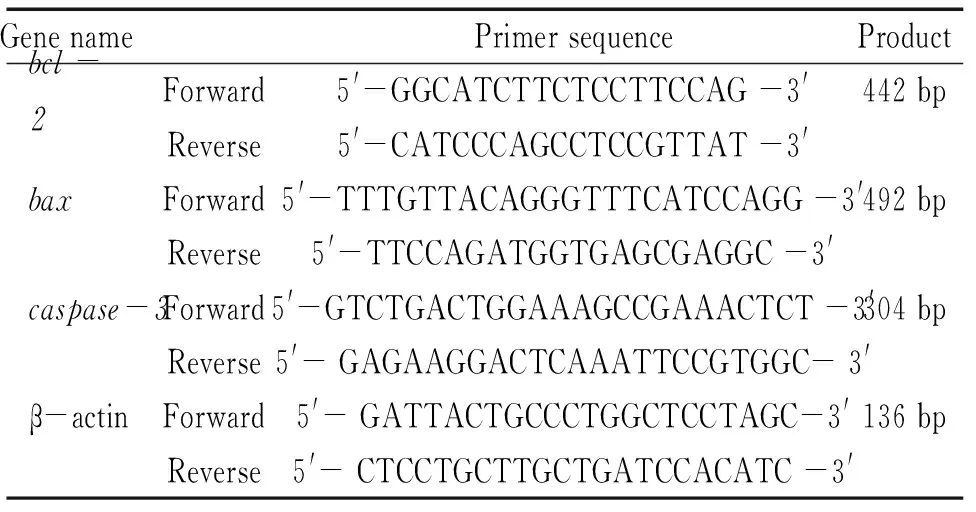
表1 引物序列
3主要方法
3.1抑郁模型的制备 大鼠熟悉饲养环境1周进行抑郁模型复制。根据文献[3],进行敞箱实验水平运动和垂直运动,总得分低于30分和高于120分的动物予以剔除(本研究大鼠抑郁模型复制前为80~120分)。每日随机选择以下一种慢性温和的不可预知性应激刺激(chronic unpredictable mild stress,CUMS):冷水游泳(4 ℃,5 min),倾斜鼠笼24 h,潮湿垫料24 h,昼夜环境颠倒,热环境 (40 ℃,5 min),2 h行为限制,夹尾 (1 min),摇晃(持续15 min)、悬尾,连续21 d并孤养。第22 d行敞箱实验和液体消耗实验确定抑郁模型是否复制成功。
敞箱实验(open-field test)行为测评:敞箱分析箱(80 cm×80 cm×60 cm)周壁为黑色,底面为面积相等的25块方格,将大鼠放入中央格,观察5 min活动情况。主要观察指标为中央格停留时间、穿越格子数、站立次数等。以大鼠穿越底面方格为水平活动得分 (3爪以上跨入记为 1分 ),以直立次数为垂直活动得分(两前肢离地 1 cm以上记为 1分 )。测定5 min内水平及垂直活动得分,总和为总评分。模型复制后均在30分以下,最少达10分。表现为大鼠自发性探究行为明显减弱,运动能力降低,表示抑郁模型复制造模成功。
液体消耗实验(fluid comsumption test),实验前48 h,训练大鼠适应饮含糖水,给动物双瓶饮水,一瓶为1%的蔗糖溶液,另一瓶为普通自来水。24 h的禁水禁食后,同时给予每只大鼠事先定量好的两瓶水:一瓶1%蔗糖水,一瓶普通自来水,双瓶重量一致,饮水24 h,然后通过称取饮水瓶的重量计算动物的总液体消耗、糖水消耗、纯水消耗,最后计算大鼠的糖水偏爱(%)=糖水摄入/总液体消耗×100%。模型复制后大鼠天生偏好糖水的兴趣下降,表示抑郁模型造模成功。
3.2大鼠心肌I/R模型的制备[4]动物麻醉后,行气管切开及气管插管后,采用左胸正中旁切口开胸,暴露心脏,于左心耳与肺动脉圆锥之间找到左冠状动脉,在动脉起始点下方2~3 mm处用6/0号丝线穿线结扎左冠状动脉前降支45 min后松开结扎线使心肌再灌注。记录肢导联心电图,缺血时S-T段弓背抬高,再灌注后S-T段回落超过50%为模型复制成功(非抑郁大鼠心肌I/R模型操作同抑郁大鼠)。抑郁假手术组只在其左前降支穿线不结扎(非抑郁大鼠假手术操作同抑郁假手术大鼠)。术后予以肌内注射青霉素钠1×105U预防感染。
3.3实验分组 Wistar大鼠(32只)随机分为4组,每组8只。A组:非抑郁大鼠假手术组;B组:抑郁大鼠假手术组;C组:非抑郁大鼠心肌I/R组;D组:抑郁大鼠心肌I/R组。术后7 d处死,取左室缺血区心肌3份,其中1份置于4%多聚甲醛中,2份置于液氮中冷冻保存备检。
3.4大鼠心肌细胞凋亡的检测 用TUNEL法检测心肌细胞凋亡,严格按照试剂盒说明书进行。
3.5大鼠缺血心肌细胞Bcl-2、Bax和caspase-3蛋白表达的检测 用SABC免疫组织化学方法,严格按照试剂盒的说明书操作,其中caspase-3检测的是活化的caspase-3。应用Image-Pro Plus图像分析系统进行计算机图像分析,测定平均吸光度值(A/area)作半定量分析。
3.6RT-PCR (1)采用RNAprep pure动物组织总RNA提取试剂盒在无菌无酶的条件下操作提取总RNA;(2)采用TIANScript RT Kit进行RNA逆转录成cDNA;(3)采用2×Taq Plus PCR MasterMix试剂盒进行PCR扩增反应。然后,5 μL DNA marker点样,取RT-PCR产物5 μL,在2%琼脂糖凝胶上电泳,mRNA的相对含量=同一泳道目的片段积分吸光度值/内参β-actin积分吸光度值。
4统计学处理
结 果
1心肌再灌注对抑郁大鼠心肌细胞凋亡的影响
由图1、表2可见,与A、B组比较,C、D组心肌细胞凋亡数量显著增加(P<0.01),A、B两组间比较无显著差异;与C组比较,D组心肌细胞凋亡数量显著增加(P<0.05)。
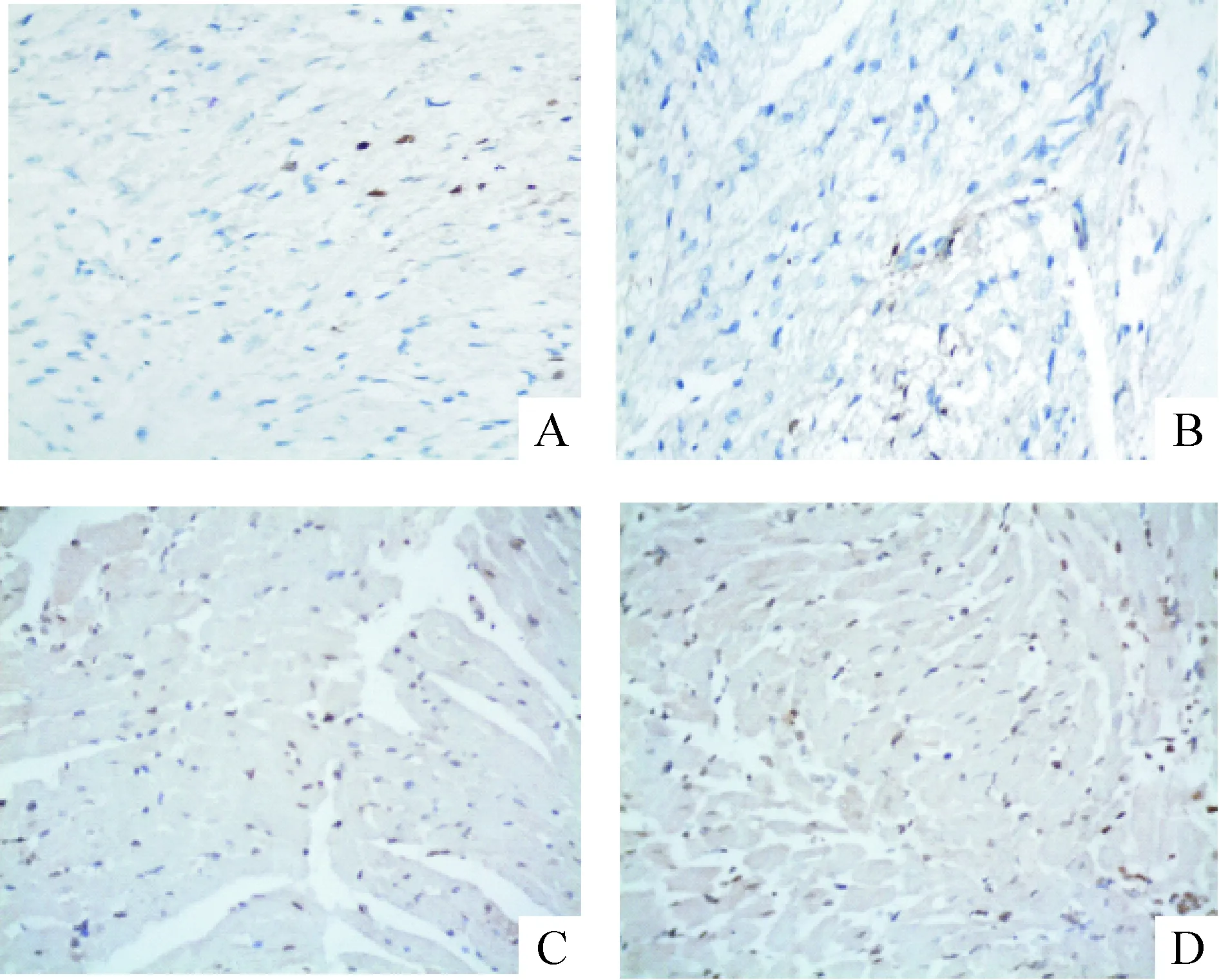
Figure 1. Apoptosis of rat myocardial cells in different groups (TUNEL, ×400). A: sham group; B: sham depression group; C: myocardial I/R group; D: myocardial I/R + depression group.
图1各组大鼠心肌细胞的凋亡情况
表2大鼠心肌细胞凋亡结果


GroupApoptoticindexSham2.63±0.86Shamdepression2.92±0.94MyocardialI/R38.60±1.86▲▲MyocardialI/R+depres-sion41.00±1.66▲▲★
▲▲P<0.01vssham or sham depression;★P<0.05vsmyocardial I/R.
2心肌再灌注对抑郁大鼠心肌细胞Bcl-2、Bax和活化的caspase-3蛋白表达的影响
由图2、表3可见,与A、B组比较,C、D组Bcl-2、Bax和活化的caspase-3蛋白表达显著增加(P<0.01),A、B两组间比较无显著差异;与C组比较,D组Bcl-2蛋白表达显著减少(P<0.05),而Bax和活化的caspase-3蛋白表达显著增加(P<0.05)。
3心肌再灌注对抑郁大鼠心肌细胞bcl-2、bax和caspase-3mRNA表达的影响
由图3、表4可见,与A、B组比较,C、D组bcl-2、bax和caspase-3 mRNA表达显著增加(P<0.01),A、B两组间比较无显著差异;与C组比较,D组bcl-2 mRNA表达显著减少(P<0.05),bax和caspase-3 mRNA表达显著增加(P<0.05)。
讨 论
1心肌再灌注对抑郁大鼠心肌细胞凋亡的影响
在正常情况下,心肌细胞属于不可再生细胞,生物个体成熟后心肌细胞凋亡非常少见,但当心脏处于某种病理状态下,如心脏负荷过重或心肌缺血时,心肌细胞凋亡大量发生[5]。
目前,PCI已成为临床冠心病治疗的重要方式,对冠心病的血运重建策略产生重大影响。但有研究显示[6],PCI后有的病例发生血压骤降、心功能不全、心律失常甚至猝死等一系列病情反而恶化的现象,这与心肌再灌注损伤(myocardial ischemia reperfusion injury,MIRI)有关,MIRI是指组织缺血缺氧性损伤不但发生于缺血当时,更主要是发生于恢复血液灌注后,而细胞凋亡被认为是心肌缺血再灌注损伤发病机制中的重要环节之一,细胞凋亡数目的多少决定了MIRI的严重程度。近年来冠心病和抑郁症的紧密联系也越来越引起国内学者的重视。有研究表明[7],冠心病合并抑郁症患者心血管不良事件的发生率明显升高,抑郁影响冠心病的发生、发展及其预后。但合并抑郁的冠心病患者罹患AMI后进行血运重建时对再灌注损伤影响如何?报道较少。
本研究显示,合并抑郁的心肌梗死大鼠再灌注后,心肌细胞凋亡显著增加,提示心肌缺血再灌注可能导致合并抑郁的大鼠更严重的再灌注损伤,提醒我们在临床上应高度重视合并抑郁的高危冠心病心肌梗死患者科学防治。抑郁加重大鼠缺血再灌注心肌细胞凋亡的机制尚不清楚,可能与凋亡相关调控基因有关。
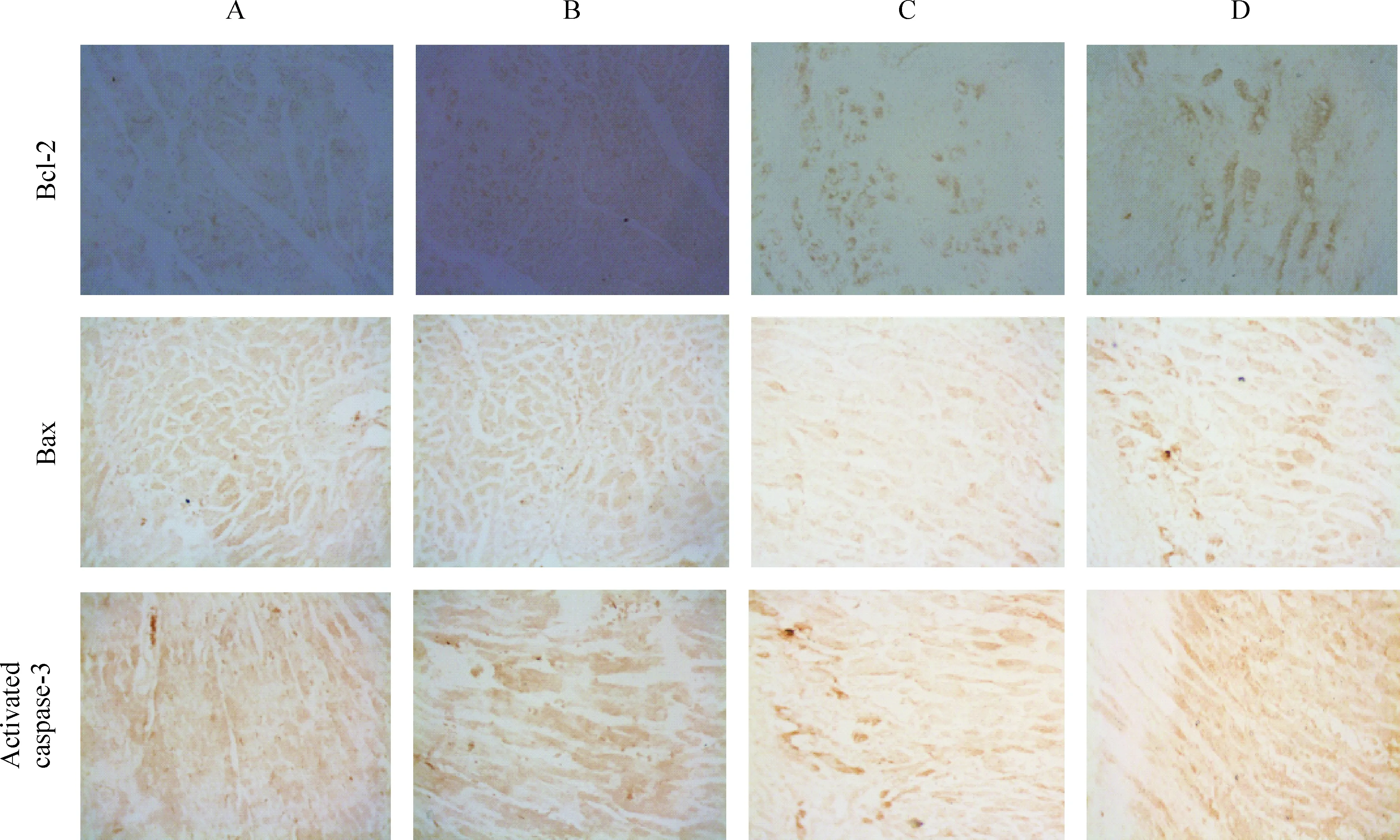
Figure 2. Expression of Bcl-2, Bax and activated caspase-3 proteins in rat myocardial cells from different groups (immunohistochemical staining, ×400). A: sham group; B: sham depression group; C: myocardial I/R group; D: myocardial I/R + depression group.
图2各组大鼠心肌细胞Bcl-2、Bax和活化caspase-3蛋白的表达
表3大鼠心肌细胞Bcl-2、Bax和caspase-3蛋白表达结果


GroupBcl-2BaxCaspase-3Sham0.062±0.0150.062±0.0170.153±0.016Shamdepression0.065±0.0130.070±0.0150.162±0.017MyocardialI/R0.171±0.019▲▲0.180±0.014▲▲0.305±0.014▲▲MyocardialI/R+depression0.153±0.014▲▲★0.204±0.027▲▲★0.324±0.017▲▲★
▲▲P<0.01vssham and sham depression;★P<0.05vsmyocardial I/R.
表4大鼠心肌细胞bcl-2、bax和caspase-3mRNA表达的影响

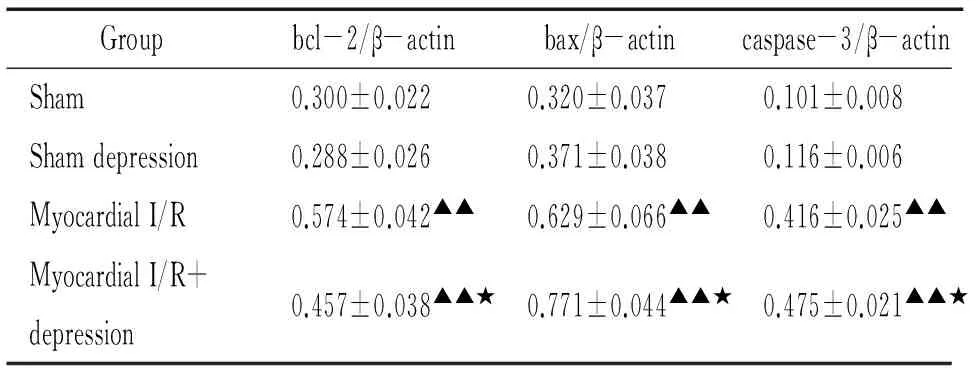
Groupbcl-2/β-actinbax/β-actincaspase-3/β-actinSham0.300±0.0220.320±0.0370.101±0.008Shamdepression0.288±0.0260.371±0.0380.116±0.006MyocardialI/R0.574±0.042▲▲0.629±0.066▲▲0.416±0.025▲▲MyocardialI/R+depression0.457±0.038▲▲★0.771±0.044▲▲★0.475±0.021▲▲★
▲▲P<0.01vssham and sham depression;★P<0.05vsmyocardial I/R.
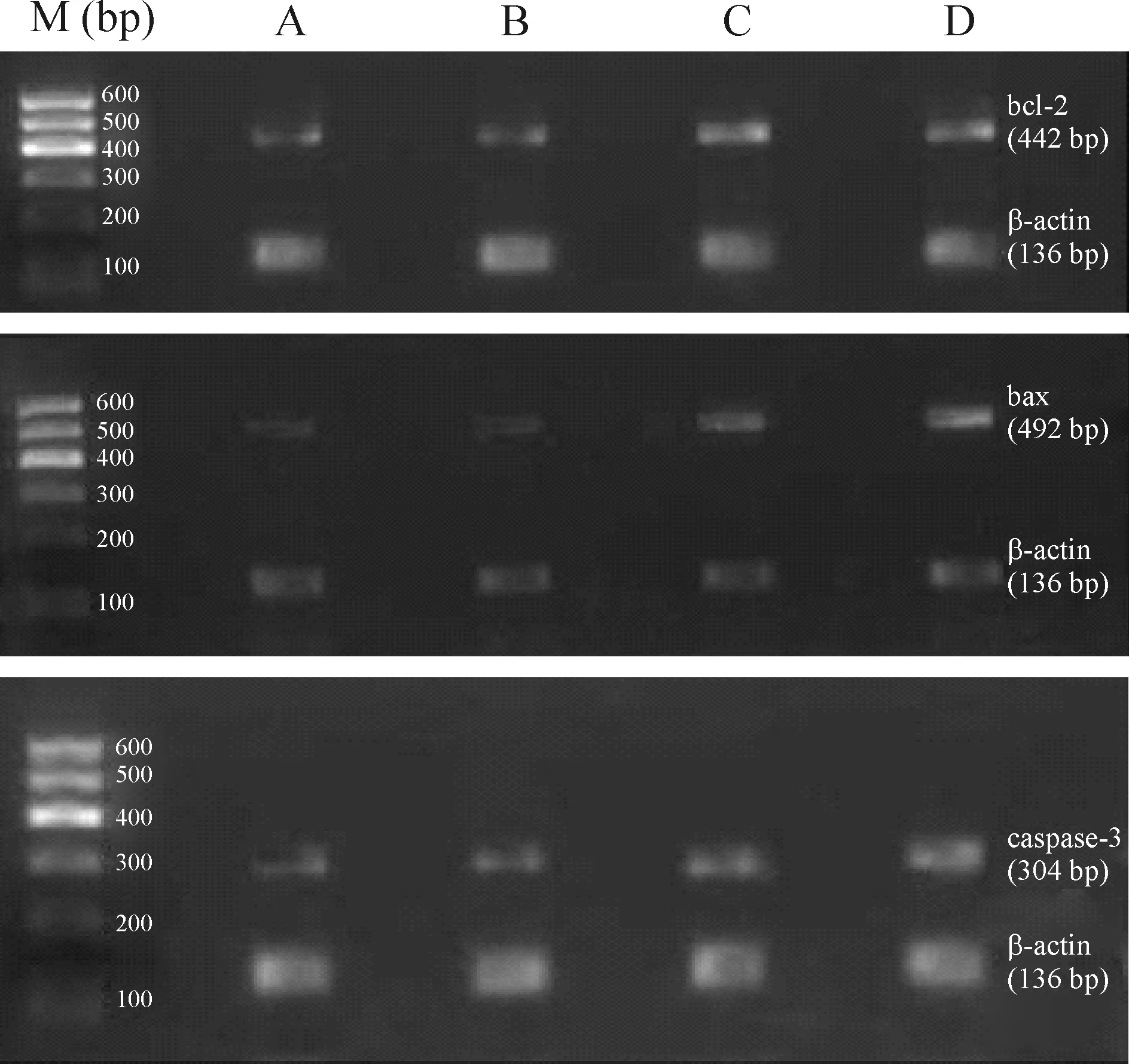
Figure 3. Expression of bcl-2, bax and caspase-3 mRNA in rat myocardial cells from different groups. M: marker; A: sham group; B: sham depression group; C: myocardial I/R group; D: myocardial I/R + depression group.
图3各组大鼠心肌细胞bcl-2、bax和caspase-3mRNA的表达
2心肌再灌注对抑郁大鼠凋亡基因bcl-2和bax表达的影响
细胞凋亡是一种受基因调控的主动性细胞死亡,表现为凋亡信号通路的启动和相关基因的表达。已经明确凋亡存在着3种信号转导途径:死亡受体途径、线粒体途径和内质网信号途径[8]。
bcl-2家族[9]是目前最主要的凋亡调控基因,通过线粒体途径调控细胞凋亡。bcl-2基因家族包括两大类:抑制凋亡的基因如bcl-2等和促凋亡基因如bax等。在哺乳动物类细胞中,凋亡抑制基因bcl-2和凋亡刺激基因bax与细胞的凋亡关系极为密切,Bax和Bcl-2分别可以以同源二聚体或异源二聚体形式存在,Bax-Bcl-2 异源二聚体较稳定, 无诱导凋亡的作用,而当Bax较Bcl-2绝对或相对增高,Bax-Bax同源二聚体形成,便诱导凋亡。近年来越来越多的实验显示,抑郁因素与心肌细胞凋亡的相关性关系密切[10],抑制心肌细胞凋亡可以减轻心肌IR损伤[11]。
本研究显示,myocardial I/R组大鼠的Bcl-2和Bax显著增高,其中Bax的增加较为明显,提示这与心肌细胞缺血再灌注后出现明显的细胞凋亡有关,与文献报道相似。本研究还显示,与myocardial I/R相比,myocardial I/R depression组Bax蛋白的表达显著增高,而Bcl-2蛋白的表达显著降低,推测抑郁因素可能通过下调bcl-2的表达和上调bax的表达,从而促进加重了大鼠I/R心肌细胞凋亡。然而细胞凋亡是一个受到高度调节的基因表达的结果 ,有许多基因参与其中,本文仅探讨了抑郁因素对I/R损伤过程中凋亡相关基因bcl-2和bax表达的影响,而抑郁因素是如何引起凋亡相关基因bcl-2和bax表达的变化,其具体的分子机制或信号转导途径尚有待进一步深入研究。
3心肌再灌注对抑郁大鼠凋亡基因caspase-3表达的影响
细胞凋亡的最终途径为激活caspases-3蛋白酶[12]。Caspase在细胞凋亡过程中是起着必不可少的作用,细胞凋亡的过程实际上是caspase酶系介导的保持细胞完整性裂解底物的过程。Caspase按功能分为启动子caspase(caspase-2,8,9,10)和效应子caspase(caspase-3,6,7),效应子被启动子激活,执行最终的凋亡效应。Caspase-3是caspase家族一种重要的蛋白酶,通常以无活性的酶原形式存在,被激活后引发“瀑布式”级联反应,对特定底物进行切割核酸内切酶,降解 DNA 修复酶,从而破坏细胞骨架蛋白和核蛋白,使染色体断裂成小片段,最终导致细胞死亡[13]。在体心脏实验表明,再灌注损伤和心肌梗死均能诱发心肌细胞凋亡。大量临床资料也表明,细胞凋亡参与人类心肌梗死的病理过程。当前,细胞凋亡是缺血性心脏病研究的较新课题,具有重要的理论意义和临床应用价值。I/R时细胞凋亡的机制尚未完全清楚,而 caspase-3激活是 I/R损伤发生发展的重要因素,是凋亡发生的标志酶[14]。但心肌再灌注对冠心病合并抑郁症患者缺血心肌组织凋亡基因caspase-3的影响目前研究报道尚少。
本研究显示,心肌缺血再灌注增加抑郁大鼠caspase-3 mRNA的表达,提示抑郁可能通过上调caspase-3 mRNA的表达而促进抑郁大鼠I/R心肌细胞凋亡。
综上所述,本研究采用CUMS合并单笼孤养,建立大鼠抑郁模型,从而促进加重了大鼠心肌缺血再灌注后缺血心肌的细胞凋亡,提示抑郁因素在缺血再灌注后心肌的恢复过程中可能起促进作用。然而细胞凋亡是一个受到高度调节的基因表达的结果,有许多基因参与其中,本文仅探讨了抑郁因素对I/R损伤过程中凋亡相关基因bcl-2、bax和caspase-3表达的影响还远不够全面,对此尚需作进一步的研究。
[1] Celano CM,Huffman JC.Depression and cardiac disease:areview[J].Cardiol Rev,2011,19(3):130-142.
[2] Savateev AV, Savateeva-Liubimova TN.Apoptosis-universal mechanisms of cell death and survival in ischemia and reperfusion:ways to pharmacological control[J].Eksp Klin Farmakol,2010,73(12):44-49.
[3] Willner P.Chronic mild stress (CMS) revisited:consistency and behavioural-neurobiological concordance in the effects of CMS[J].Neuropsychobiology,2005,52(2):90-110.
[4] 金 英,王永安.心肌缺血再灌注损伤动物模型建立的主要影响因素[J].国际药学研究杂志,2009,36(6):423-430.
[5] McCully JD,Wakiyama H,Hsieh YJ,et al.Differential contribution of necrosis and apoptosis in myocardial ischemia-reperfusion injury[J].Am J Physiol Heart Circ Physiol,2006,286(5):H1923-H1935.
[6] 刘永国,任 澎.心肌缺血/再灌注损伤的机制研究进展[J].医学综述,2010,16(21):3267-3269.
[7] Albus C.Psychological and social factors in coronary heart disease[J].Ann Med,2010,42(7):487-494.
[8] Rao RV,Ellerby HM,Bredesen DE,et al.Coupling endoplasmic reticulum stress to the cell death program[ J ].Cell Death Differ,2004,11(4):372-380.
[9] 刘珊珊,李 蒙,李 钰.Bc1-2家族蛋白相互作用因子的研究进展[J].国外医学:遗传学分册, 2005,28(6):336-338.
[10]Wang Y, Xiao Z, Liu X,et al.Venlafaxine modulates depression-behaviour and the expression of Bax mRNA and Bcl-xl mRNA in both hippocampus and myocardium[J].Hum Psyhopharmacol,2011,26(2):95-101.
[11]Shirito K,Otani H,Yamamoto F,et al.MK2-/-gene knockout mouse hearts carry anti-apoptotic signal and are resistant to ischemia reperfusion injury[J].J Mol Cell Cardiol, 2005,38(1):93-97.
[12]Zakeri Z,Lockshin RA.Cell death:history and future[J].Adv Exp Med Biol,2008,615:1-11.
[13]Faube S,Edestein CL.Caspases as drug targets in ischemia organ injury[J].Curr Drug Targets Immune Endocr Metabol Disord,2005,5 (3):269-287.
[14]Lee WK,Thévenod F.A role for mitochondrial aquaporins in cellular life-and-death decisions?[J].Am J Physiol Cell Physiol,2006,291(2):C195-C202.
Effectofmyocardialreperfusiononcardiocyteapoptosisandexpressionofbcl-2,baxandcaspase-3inratswithdepression
LIU Shu-zhen, YOU Xin, XIONG Xiao-shuan, LIU Xing-de
(DepartmentofCardiology,TheAffiliatedHospital,GuiyangUniversity,Guiyang550000,China.E-mail:lxd@gmc.edu.cn)
AIM: To explore the effect of ischemia/reperfusion (I/R) on cardiac myocyte apoptosis and the expression ofbcl-2,baxandcaspase-3 in the rats with depression.METHODSThirty-two Wistar rats were randomly divided into 4 groups,including group A: sham operation group; group B: the rats with depression undergoing sham operation; group C: the rats with myocardial I/R operation; group D: the rats with depression undergoing myocardial I/R operation. The rat model of depression was produced by chronic mild unpredictable stress and separation. The behaviors of the rats were detected by open field test and fluid consumption test. The myocardial I/R model was made by ligating the left anterior descending branch of coronary artery in the rats. The apoptotic cardiomyocytes were detected byinsituTdT-mediated dUTP nick end labeling (TUNEL) method, and the expression ofbcl-2,baxandcaspase-3 was detemined by the methods of immunohistochemistry and reverse transcription polymerase chain reaction (RT-PCR).RESULTSCompared with group A and group B, the numbers of apoptotic cardiomyocytes in group C and group D were significantly increased (P<0.01), and the expression ofbcl-2,baxandcaspase-3 in group C and group D was also significantly increased (P<0.01). No significant difference between group A and B was observed. Compared with group C, the number of apoptotic cardiomyocytes in group D was significantly increased (P<0. 05).The gene expression ofbcl-2 in group D was decreased significantly (P<0.05), while the gene expression ofbaxandcaspase-3 in group D was significantly increased (P<0.05).CONCLUSIONMyocardial reperfusion increases apoptosis in ischemic cardiomyocytes in the rats with depression. The mechanisms may be associated with up-regulating the gene expression ofbaxandcaspase-3 while down-regulatingbcl-2 expression.
Myocardial reperfusion; Depression;Rats; Apoptosis; Gene expression
R541.4
A
10.3969/j.issn.1000-4718.2012.03.012

