反复细菌感染致大鼠气道重构中结缔组织生长因子的表达变化及意义*
文 文, 赖国祥△, 柳德灵, 张亚彬, 姚丽青, 王爱民
(安徽医科大学福州总院教学医院 1呼吸与危重症医学科,2检验科,3病理科,福建 福州 350025)
1000-4718(2012)03-0546-04
2011-09-05
2011-12-12
福建省自然科学基金资助项目(No.Z0516077)
△通讯作者 Tel:0591-22859333;E-mail: laiguoxiang2007@163. com
反复细菌感染致大鼠气道重构中结缔组织生长因子的表达变化及意义*
文 文1, 赖国祥1△, 柳德灵1, 张亚彬2, 姚丽青3, 王爱民1
(安徽医科大学福州总院教学医院1呼吸与危重症医学科,2检验科,3病理科,福建 福州 350025)
目的探讨反复铜绿假单胞菌(Pseudomonasaeruginosa,PA)感染致大鼠气道重构中结缔组织生长因子(connective tissue growth factor, CTGF)的表达变化及意义。方法通过多次经气管穿刺注入一定剂量PA菌液,建立大鼠慢性肺部感染模型。观察气管及肺组织的病理改变, 测定气管壁和血管壁厚度。通过免疫组化检测肺组织CTGF蛋白的表达,同时采用real-time RT-PCR方法检测肺组织CTGF mRNA的表达变化,分析CTGF表达与病理改变的相关性。结果大鼠感染PA第4周开始,气管壁厚度和血管壁厚度均较NS组显著增加(P<0.05),至第16周,各级支气管管壁增厚,管腔明显狭窄,有气道重构和肺气肿形成。免疫组化以及real-time RT-PCR 结果显示CTGF表达随着时间的延长逐渐增强,与对照组相比差异有统计学意义(P<0.01),与气管壁和血管壁厚度呈显著正相关(r=0.880,r=0.829,P<0.01)。结论气道反复感染铜绿假单胞菌可致大鼠出现气道重构,而CTGF可能参与了气道重构的发生和发展过程。
气道重构; 铜绿假单胞菌; 结缔组织生长因子
气道重构(airway remodeling)是慢性阻塞性肺疾病和支气管哮喘的重要病理特点之一,会引起气道阻塞,肺弹性回缩力下降及肺功能的减退。研究发现,和气道重构密切相关的病原菌有腺病毒、呼吸道合胞病毒和细菌[1-3]。然而细菌导致气道重构的作用机制目前尚不十分清楚。铜绿假单胞菌(Pseudomonasaeruginosa,PA)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)急性加重期的主要责任病原菌,其感染易形成细菌生物被膜长期定殖,造成肺部反复感染[4]。然而反复铜绿假单胞菌感染能否导致气道重构及其具体机制目前尚无深入研究。
结缔组织生长因子(connective tissue growth factor,CTGF)是一种促纤维化生长因子,属即刻早期反应基因家族,具有自分泌和旁分泌功能而影响成纤维细胞、平滑肌细胞、内皮细胞等靶细胞,促进细胞外基质形成,对气道重塑性疾病具有重要意义[5]。转化生长因子β1的致纤维化作用主要是由CTGF介导的。本研究旨在通过多次经气管穿刺注入一定剂量铜绿假单胞菌菌液的呼吸道感染方法建立大鼠慢性肺部感染模型,评价其是否具有气道重构的病理特征,并测定肺组织CTGF的表达变化,探讨其在气道重构中的作用。
材 料 和 方 法
1材料
1.1动物 SPF级雄性Wistar大鼠120只,体重(250±10)g,上海斯莱克实验动物有限责任公司提供。
1.2实验菌株 铜绿假单胞菌标准菌株(抗生素敏感试验质控菌株),编号ATCC27853,购于卫生部临床检验中心。
1.3主要实验药品、试剂 RNAlater组织保护液(Qiagen),Trizol组织裂解液(Invitrogen),逆转录试剂盒(Promega),PCR试剂盒及荧光定量PCR试剂(SYBR Premix ExTaqTM)(大连TaKaRa公司),引物(上海生工公司合成)。
2动物分组和实验方法
2.1动物分组 大鼠基础饲料喂养适应环境1周后,随机分为生理盐水对照组(NS组,60只)和铜绿假单胞菌感染组(PA组,60只),每组预留12只大鼠备用(根据预实验大鼠死亡率估算),以补充因实验操作失误或实验中不可避免的非人为因素导致死亡的大鼠。并将2组各剩余的48只大鼠随机分为0 d、1 d、1周、2周、4周、8周、12周和16周组各6只。
2.2动物处理 NS组和PA组分别反复经气管穿刺注射0.1 mL生理盐水和0.1 mL铜绿假单胞菌菌液(0.3 mol/L,约相当于0.7×1011CFU/L),2次/周(每周的第1 d和第4 d),持续4周,后改为1次/周(每周的第1 d),持续4周,停止细菌感染继续观察大鼠8周。8个不同时点进行相关指标的检测。
2.3病理改变程度的判定标准及定量方法 将大鼠右肺中叶严格垂直于支气管及细支气管断面,矢状面最大周径处横贯取材,约3 mm厚,后固定,切片。组织切片置于显微测微器(×400)下,在支气管及细支气管横切面经中心点的纵轴和横轴上测量管壁厚度,测量5个支气管环及血管,取平均值,计算气管壁厚度和血管壁厚度。
2.4肺组织免疫组化染色评定方法 根据免疫组化结果,观察各组大鼠肺部气道上皮细胞和肺泡间质细胞CTGF阳性着色为棕色颗粒沉积。每张切片随机选择20个视野(×200),并计算阳性的气道上皮细胞/总的气道上皮细胞的百分率,求出平均值。由2位观察者采取双盲法对CTGF染色程度独立评价并进行半定量评分:0分:无染色或染色非常弱;1分:阳性细胞小于25%;2分:弥漫性弱阳性着色;3分:弥漫性中等强度着色;4分:弥漫性强阳性着色。免疫染色片与HE染色片作对照观察,以确定阳性染色出现的部位。
2.5CTGF real-time RT-PCR分析 细胞总RNA的提取按产品说明书进行,参照Reverse Transcription System 说明书合成cDNA。根据NCBI GenBank中人类GAPDH和CTGF mRNA序列,采用Primer3软件进行引物设计,见表1。常规法PCR优化扩增条件后,于Bio-Rad iCycler PCR仪上行实时荧光定量PCR。本实验将正常组作为基准设为对照组,先将生理盐水组和铜绿假单胞菌组分别与对照组比较,再将生理盐水组和铜绿假单胞菌组比较。
3统计学处理
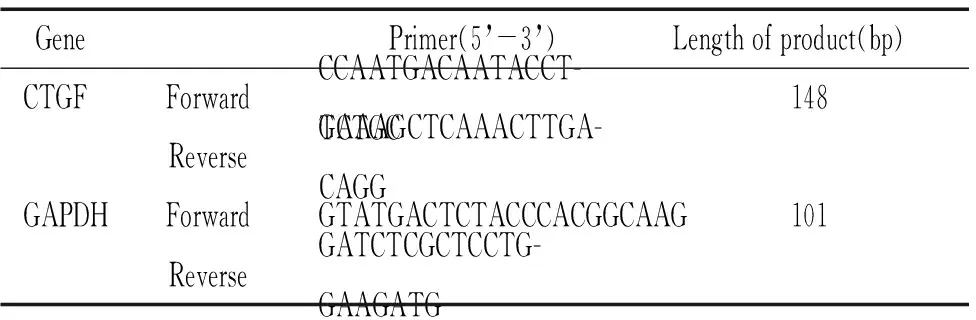
表1 CTGF及GAPDH的引物序列
结 果
1肺部病理形态学改变
第4周:PA组大鼠气管黏膜下可见大量腺体,杯状细胞减少,腺体导管内可见黏液栓。细支气管黏膜下及周围可见淋巴细胞和中性粒细胞浸润,肺泡间隔略增宽,间质充血水肿,肺泡上皮细胞增生。NS组气管及支气管黏膜上皮细胞排列尚规整,杯状细胞增生,肺内各级小支气管、细支气管及其伴行的管壁及周围有少许中性粒细胞及淋巴细胞浸润,血管腔充血。肺泡间隔基本正常,间质可见红细胞浸润,见图1。
第16周: PA组大鼠气管黏膜上皮细胞排列紊乱、脱落,黏膜下平滑肌增生明显,血管充血,支气管杯状细胞增殖,黏膜下层纤维化,平滑肌增厚,细胞外基质的沉积,出现气道重构表现,呼吸细支气管和肺泡管囊状扩张,可见肺气肿形成,视野中央多个肺泡相互融合,肺泡腔不规则扩大,肺泡间隔断裂,腔略增大,有的肺泡相互融合形成肺大泡。NS组气管及支气管黏膜上皮细胞排列尚规整,杯状细胞增生,肺内各级小支气管、细支气管及其伴行的管壁及周围有少许中性粒细胞及淋巴细胞浸润,血管腔充血。肺泡间隔略增宽,间质可见红细胞浸润,见图1。
2肺组织切片的定量分析
从第2周开始PA组大鼠气管壁厚度明显大于NS组,差异有统计学意义(P<0.05),与之伴行的肺小血管管壁亦增厚,从第4周开始厚度明显大于NS组,差异有统计学意义(P<0.05),见表2。

Figure 1. Pathological manifestation of trachea, bronchiole and alveolus of the rats in the 2 groups at the 4th and the 16th weeks(HE staining,×200)
图1第4周和第16周2组大鼠气管、细支气管和肺泡病理变化

表2 2组气管壁厚度和血管壁厚度的比较
△P<0.05,△△P<0.01vsNS group at the same time point.
3免疫组化检测肺组织CTGF蛋白表达水平
CTGF阳性染色主要定位于气道纤毛上皮、血管和肺泡间质细胞。NS组大鼠仅少量气道纤毛上皮细胞和肺泡间质细胞呈现CTGF阳性染色,且颜色淡。PA组大鼠第2周后开始出现气道纤毛上皮细胞和肺泡间质细胞CTGF表达增强,以气道纤毛上皮细胞明显,强于NS组。到实验结束时,PA组大鼠的CTGF表达明显强于NS组,见图2。
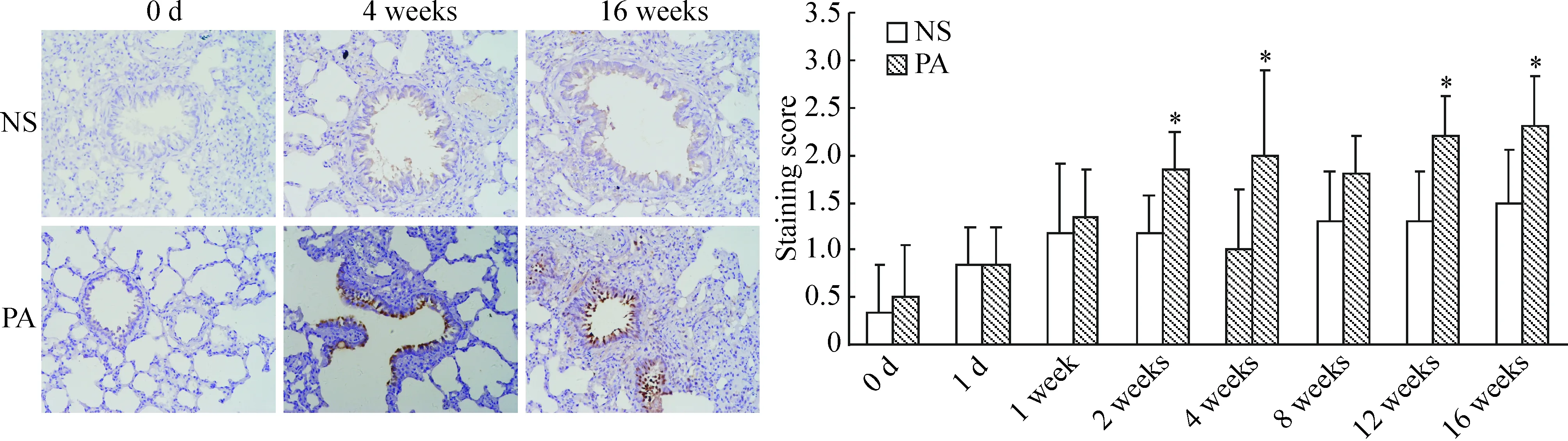

图2铜绿假单胞菌感染对肺组织中CTGF蛋白表达的影响
4肺组织CTGFmRNA表达水平
随着铜绿假单胞菌感染时间的增加CTGF表达逐渐增强,PA组大鼠感染第1 d后CTGF表达增强,明显强于NS组,差异有统计学意义(P<0.05)。到实验结束时,PA组大鼠的CTGF表达明显强于NS对照组,差异有统计学意义(P<0.01),见表3。

表3 2组大鼠肺组织CTGF mRNA的表达
△P<0.05,△△P<0.01vsNS group at the same time point.
5肺部气管和血管壁厚度与CTGF表达水平相关性分析
以铜绿假单胞菌组大鼠肺部血管壁和气管壁厚度为应变量Y,CTGF mRNA表达水平为自变量X,进行线性相关分析,相关系数r值见表4(P<0.01)。这说明CTGF表达与气管壁和血管壁厚度呈明显正相关。
表4大鼠肺部气管和血管壁厚度与CTGF表达水平的相关性
Table 4. Correlation between the expression of CTGF mRNA and the thickness of trachea wall and vessel wall of rats

CorrelatedwithCTGFmRNArPThicknessoftracheawall0.880<0.01Thicknessofvesselwall0.829<0.01
讨 论
气道重构是慢性阻塞性肺疾病和支气管哮喘的重要病理特点之一,会引起气道阻塞、肺弹性回缩力下降及肺功能减退。气道重构大多是由于反复气道慢性炎症刺激损伤和不全性修复所导致[6],其病理改变包括气道管壁的增厚,上皮下层纤维化,平滑肌增生肥大,肌成纤维细胞增生,黏液腺上皮化生和细胞外基质沉积增加[7]。
反复气道感染是COPD加重和发展最主要的原因,但它是否会引起或加重气道重构,是否会诱发COPD,成为COPD发生的原因?Sethi等[8-9]研究认为:感染尤其是细菌感染,不仅是COPD急性加重的主要原因,很可能是 COPD 发病机制中的一个重要因素。许浒等[3]研究发现,以适量肺炎克雷伯菌和肺炎链球菌,多次经鼻腔注入大鼠肺内,发现大鼠出现气道重构和肺气肿,具有 COPD的病理学特征。在实验中我们参照许浒等[3]的造模方法,选择铜绿假单胞菌作为研究对象,这是因为该细菌与COPD密切相关,是导致COPD终末期患者反复急性加重入院的主要致病菌,也是有创通气患者容易发生定植的细菌。我们的实验结果表明,大鼠感染PA后各级支气管慢性炎症明显,管壁增厚,管腔明显狭窄,有气道重构和肺气肿形成,也具有COPD的病理特征。因此,我们的结果表明反复气道感染会导致气道重构,也提示它既是COPD加重和发展的原因,也可能是COPD发生的原因。
在许多脏器纤维化的过程中,CTGF mRNA的表达显著增强。CTGF的主要作用是:(1)促进细胞有丝分裂和成纤维细胞增殖,合成胶原;(2)介导细胞趋化作用;(3)诱导细胞凋亡;(4)促进血管形成[10]。因此本研究也对CTGF在气道重构中的作用进行探讨,结果显示随着铜绿假单胞菌感染时间的延长,CTGF在肺内的表达逐渐增加,而且主要表达位于气道纤毛上皮细胞和肺泡间质细胞。不仅如此,我们还将CTGF与气道壁及血管壁的厚度进行相关性分析,结果也说明两者呈显著正相关。这些结果均提示CTGF参与了PA感染大鼠的气道重构过程。至于CTGF如何参与气道重构,推测可能是CTGF作用于下游的核因子,进而促进气管及血管平滑肌细胞增殖,趋化成纤维细胞,增加细胞外基质蛋白的合成,介导白细胞浸润,导致气道、血管壁增厚,引起气道重构。但这些推测需要在今后的研究中进行验证。
综上所述,我们的研究表明反复气道感染铜绿假单胞菌可致大鼠出现气道重构,可能会诱发COPD,而CTGF可能参与了气道重构的发生和发展过程。
[1] Kushwah R, Cao H, Hu J. Potential of helper-dependent adenoviral vectors in modulating airway innate immunity[J].Cell Mol Immunol,2007,4(2):81-89.
[2] Li W, Shen HH. Effect of respiratory syncytial virus on the activity of matrix metalloproteinase in mice[J]. Chin Med J (Engl),2007,120(1):5-11.
[3] 许 浒,熊 密,黄庆华,等. 细菌感染导致慢性阻塞性肺疾病大鼠模型的探讨[J].中华结核和呼吸杂志,1999,22(12):739-742.
[4] Murphy TF,Brauer AL,Eschberger K,et al.Pseudomonasaeruginosain chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2008,177(8):853-860.
[5] 田 锋,徐永健,张珍祥,等.CTGF在烟雾暴露大鼠肺血管中的表达及其与肺血管重建的关系[J].中国病理生理杂志,2008,24(1):7-11.
[6] Jeffery PK. Remodeling and inflammation of bronchi in asthma and chronic obstructive pulmonary disease[J]. Proc Am Thorac Soc,2004,1(3):176-183.
[7] Parameswaran K, Willems-Widyastuti A, Alagappan VK, et al. Role of extracellular matrix and its regulators in human airway smooth muscle biology[J]. Cell Biochem Biophys,2006, 44(1): 139- 146.
[8] Sethi S. Bacterial infection and the pathogenesis of COPD[J]. Chest, 2000, 117(5 Suppl 1): 286S-291S.
[9] Sethi S,Murphy TF.Infection in the pathogenesis and course of chronic obstructive pulmonary disease[J].N Engl J Med, 2008, 359(22): 2355-2365.
[10]Shimo T,Nakanishi T,Nishida T.Connective tissue growth factor induces the proliferation,migration,and tube formation of vascular endothelial cellsinvitro,and angiogenesisinvivo[J].J Biochem,1999,126(1):137-145.
Roleofconnectivetissuegrowthfactorinairwayremodeledinratsinducedbyrepeatedbacterialinfection
WEN Wen1, LAI Guo-xiang1, LIU De-ling1, ZHANG Ya-bin2, YAO Li-qing3, WANG Ai-min1
(1DepartmentofPulmonaryandCriticalCareMedicine,2DepartmentofLaboratoryMedicine,3DepartmentofPathology,FuzhouGeneralHospital,TeachingHospitalofAnhuiMedicalUniversity,Fuzhou350025,China.E-mail:laiguoxiang2007@163.com)
AIM: To investigate the role of connective tissue growth factor (CTGF) in airway remodeling in rats induced by repeatingPseudomonasaeruginosa(PA) infection.METHODSThe rats were intratracheally injected with PA for 12 times to induce chronic lung inflammation. The pathological changes of the trachea and lungs were observed, and the thickness of the trachea wall and vessel wall was measured. At the same time, the methods of immunochemistry and real-time quantitative RT-PCR were used to determine the protein and mRNA expression of CTGF in the lung tissues. The relevance between pathological changes and CTGF expression was also analyzed.RESULTSFrom the 4th week, the thickness of the trachea wall and vessel wall in infectious group was larger than that in NS group (P<0.05). At the 16th week, obvious chronic inflammation in all grade bronchi appeared, the trachea walls were thickened and the lumens were narrowed in the infected animals. The expression of CTGF was significantly up-regulated (P<0.01) with positive correlations to the thickness of the trachea wall and vessel wall (r=0.880,r=0.829,P<0.01).CONCLUSIONAirway remodeling in rats is induced by repeated injection of PA. CTGF may play some roles in the pathogenesis of airway remodeling.
Airway remodeling;Pseudomonasaeruginosa; Connective tissue growth factor
R363
A
10.3969/j.issn.1000-4718.2012.03.029

