雷奈酸锶通过上调骨形态发生蛋白2的表达促进骨髓间充质干细胞分化为成骨细胞*
王 瑒, 李 正, 王小娜, 兰爱平, 吴 文△
(1南方医科大学,广东 广州 510515;2广东省人民医院东病区内分泌科,广东 广州 510080;3中山大学中山医学院生理学教研室,广东 广州 510080)
1000-4718(2012)03-0404-05
2011-11-04
2011-12-08
十一五国家科技支撑项目(No. 2006BAI02B03);广东省科技计划(No. 2008B060600039;No. 2009B030801261)
△通讯作者 Tel:020-83827812-70912;E-mail:wuwen1964@163.com
雷奈酸锶通过上调骨形态发生蛋白2的表达促进骨髓间充质干细胞分化为成骨细胞*
王 瑒1,2, 李 正1,2, 王小娜1,2, 兰爱平3, 吴 文1,2△
(1南方医科大学,广东 广州 510515;2广东省人民医院东病区内分泌科,广东 广州 510080;3中山大学中山医学院生理学教研室,广东 广州 510080)
目的探讨雷奈酸锶(strontium ranelate,Sr)是否可以通过上调骨形态发生蛋白 2(bone morphogenetic protein 2,BMP-2)的表达而促进大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分化为成骨细胞。方法对大鼠BMSCs进行分离、纯化、培养及向成骨细胞的定向诱导分化,并在诱导培养时,根据实验目的加入不同浓度Sr以及BMP-2的拮抗剂noggin。用酶标法检测成骨细胞分化和功能成熟的早期标志物——碱性磷酸酶(alkaline phosphatase,ALP)活性的变化,用茜素红染色检测细胞钙化水平,用Western blotting法检测BMP-2蛋白的表达水平。结果应用0.1~7 mmol/L Sr处理细胞7 d均可使细胞ALP活性显著增加,其中浓度为3 mmol/L时效果最显著;应用3 mmol/L Sr处理细胞21 d可使细胞钙化结节明显增多;应用0.1~7 mmol/L Sr处理细胞7 d后细胞内BMP-2蛋白水平明显增高;在Sr处理BMSCs前,应用BMP-2拮抗剂noggin预处理细胞2 h不仅抑制Sr对BMP-2表达的上调作用,还拮抗Sr对ALP活性及钙化结节形成的促进作用。结论上调BMP-2的表达可能是Sr促进大鼠BMSCs分化为成骨细胞的作用机制之一。
雷奈酸锶; 骨髓间充质干细胞; 骨形态发生蛋白 2; 成骨细胞
雷奈酸锶(strontium ranelate,Sr)是由法国Servier公司研制开发的一类新型抗骨质疏松药物,是第一种被称为具有双重治疗作用——促进骨形成并抑制骨吸收的新药,主要用于治疗和预防绝经后妇女的骨质疏松症以降低椎体和髋部骨折的危险性。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)能够保持其干细胞的表型而引起多向分化,定向诱导其向成骨分化可为研究骨组织工程、骨折修复和骨质疏松等难题提供理论基础。有学者报道Sr可促进小鼠BMSCs和人BMSCs[1-2]向成骨细胞分化,能增加细胞碱性磷酸酶(alkaline phosphatase,ALP)的活性、I型胶原、骨钙素等成骨细胞标志的表达,同时也能促进细胞的钙化。Caverzasio等[3]对Sr促进成骨细胞系增殖的机制进行研究,发现Sr能够通过两种独特的细胞学机制增加成骨细胞系的复制:(1)直接与钙感应受体(calcium-sensing receptor,CaSR)相互作用,触发丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)p38等信号活化;(2)通过释放一种自分泌生长因子来促进成骨细胞的增殖,但其具体机制尚不明确。Choudhary等[1]发现Sr诱导小鼠的MSCs向成骨细胞分化与环氧化酶 2和前列腺素E2的介导有关;Fromigué等[4]认为激活活化T细胞核因子c1(nuclear factor of activated T cells c1,NFATc1)以及下游经典和非经典的Wnt信号通路(Wnt signaling pathways)对雷奈酸锶诱导的成骨细胞复制和分化均有影响。
研究人员对于骨形态发生蛋白(bone morphogenetic proteins,BMPs)的兴趣可以追溯到上世纪60年代,Marshall Urist将脱钙骨基质移植到肌肉内后引起了异位成骨[5]。BMPs通过协调细胞分化、增殖、生长和凋亡,在各种组织器官如牙齿、肾脏、前列腺、乳腺、皮肤、毛发、肌肉、心脏和神经等的不同发育过程以及体内平衡中发挥了重要作用[6]。BMPs在调节成骨细胞分化以及其后的骨形成过程中也起了重要作用。在人类和动物的体外模型中,已经证实BMPs可以刺激干细胞分化为成骨细胞[7-8],其中BMP-2是现在被研究最多的一种。而在Sr促进BMSCs分化为成骨细胞的过程中,是否存在着BMP-2的作用还未见报道。为此,本实验观察在Sr刺激大鼠BMSCs分化为成骨细胞过程中对BMP-2表达的影响及其作用,为探讨Sr可能的促成骨机制提供新颖的实验资料。
材 料 和 方 法
1主要材料
4周龄雄性SD大鼠购自中山大学实验动物中心;DMEM培养基和胎牛血清购自Gibco;青霉素、β-甘油磷酸钠、地塞米松、抗坏血酸购自Sigma;雷奈酸锶干混悬剂由法国Servier公司惠赠;碱性磷酸酶检测试剂盒购自南京建成生物工程研究所;细胞茜素红(alizarin red S)钙染色试剂盒购自上海杰美基因医药科技有限公司;BMP-2抗体购自Bioworld;noggin购自R&D。
2主要方法
2.1大鼠BMSCs的获取 取4周龄雄性SD大鼠1只,颈椎脱臼法处死后用75%乙醇浸泡5 min,在无菌条件下分离出两侧股骨及胫骨,剔除表面的肌肉、筋膜等组织,剪去股骨近端和胫骨远端,暴露骨髓腔,用含10%胎牛血清、100 kU/L青霉素及100 mg/L链霉素的DMEM低糖完全培养基反复冲洗骨髓腔,收集细胞,1 000 r/min离心5 min,弃上清,加入2 mL上述DMEM培养液重悬细胞,种植于培养瓶中并吹打混匀,标记为原代P0,置于37 ℃、5% CO2、80%相对湿度的培养箱中培养。24 h后更换新鲜培养液以去除未贴壁细胞和各种杂质,加入5 mL新鲜培养液。此后每隔2~3 d换液1次,倒置相差显微镜下观察细胞生长状况,直至细胞接近80%~90%融合时进行传代。此后每隔3~4 d传代1次。
2.2BMSCs的成骨分化 选取第3~5代BMSCs为研究对象,根据不同实验需要将细胞种植于培养皿或培养板中,加入成骨诱导液(含10%胎牛血清、100 kU/L青霉素及100 mg/L链霉素、10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 mg/L抗坏血酸的DMEM低糖培养基)培养。
2.3ALP活性检测 选取第3代细胞,以约1×108/L的密度接种于24孔板,各实验组给予不同处理因素后,于第7 d采用酶标法检测ALP活性。检测时将细胞收集后以0.2% Triton X-100裂解液及反复冻融法充分裂解,裂解后用PBS洗2遍,12 000 r/min离心10 min,取上清液按试剂盒说明书进行操作,于酶标仪520nm波长处测定结果。
2.4茜素红钙化结节染色 选取第3代细胞,接种于24 mm×24 mm盖玻片上,盖玻片预先置于6孔板中。各实验组给予不同处理因素后,于第21 d按照细胞茜素红钙染色试剂盒说明书对样本进行固定、染色及澄清处理,倒置显微镜下观察钙结节染色情况,每组取5个样本,每样本随机取1个视野(×100),比较各组间的差异。
2.5Western blotting法检测BMP-2蛋白表达水平 选取第3代细胞,接种于60 mm 培养皿中,各实验组给予不同的处理因素后,用预冷的PBS洗2遍,加入细胞裂解液,4 ℃裂解30 min,12 000 r/min离心10 min,取上清液,用BCA蛋白质定量试剂盒进行蛋白定量。总蛋白经SDS-PAGE分离后,转移到PVDF膜上。用5%脱脂奶粉封闭1.5 h,随后加入BMP-2抗体(1∶1 000),4 ℃过夜,用TBST洗3次,每次10min,加入Ⅱ抗(1∶2 500)孵育1.5 h,再用TBST洗3次,每次10 min。将膜用发光试剂ECL显色,暗室曝光,凝胶成像系统扫描并分析结果。
3统计学处理
结 果
1Sr增加BMSCs的ALP活性
0 mmol/L、0.1 mmol/L、1 mmol/L、3 mmol/L、5 mmol/L及7 mmol/L Sr处理细胞7 d,各实验组与对照组相比,ALP活性均有所增加, 当Sr浓度为0.1 mmol/L时,与对照组相比,ALP活性即有显著增加(P<0.05),当Sr浓度增加至3 mmol/L时,ALP活性增至最大,而5 mmol/L及7 mmol/L时,ALP活性增加幅度降低。可认为在0.1~7 mmol/L浓度范围内,Sr对BMSCs向成骨分化的促进作用具有一定的剂量依赖性,见表1。
表1不同浓度Sr对ALP活性的影响
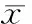
GroupActivityofALPControl0.153±0.007Sr(0.1mmol/L)0.169±0.005#Sr(1mmol/L)0.279±0.012##Sr(3mmol/L)0.304±0.007##Sr(5mmol/L)0.266±0.009##Sr(7mmol/L)0.187±0.013##
#P<0.05,##P<0.01vscontrol.
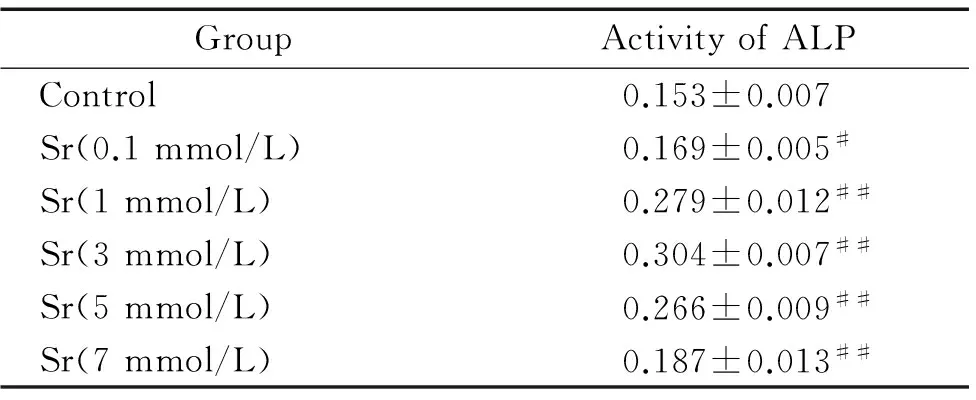
2Sr促进BMSCs的钙结节生成
图1显示,3 mmol/L Sr处理BMSCs 21 d,与对照组相比细胞内钙结节生成明显增多,见图1。

图1Sr促进BMSCs钙结节形成
3Sr上调BMSCs的BMP-2表达
图2A显示,0.1 mmol/L、1 mmol/L、3 mmol/L、5 mmol/L及7 mmol/L Sr处理BMSCs 7 d后,与对照组相比,细胞内BMP-2表达均明显升高,Sr的浓度为1 mmol/L 时BMP-2表达水平达到最高值,Sr的浓度为7 mmol/L时,BMP-2表达的上升幅度明显下降,但仍明显高于对照组(P<0.05),呈现出一定的浓度依赖性;图2B显示,1 mmol/L Sr分别处理BMSCs 1 d、3 d、5 d、7 d及10 d后,与对照组相比,细胞内BMP-2表达均明显升高,在1~7 d的时间范围内,Sr呈时间依赖性地促进BMP-2表达,Sr处理BMSCs 7 d时,BMP-2表达水平达到高峰,处理10 d时,BMP-2表达水平显著下降,但仍明显高于对照组(P<0.05),见图2。
4BMP-2拮抗剂noggin抑制Sr对BMP-2表达的上调作用
图3显示,1 mmol/L Sr处理BMSCs 7 d后,与对照组相比,细胞内BMP-2表达明显增加(P<0.01),在Sr处理BMSCs前,给予100 μg/L noggin预处理2 h后,细胞内BMP-2表达明显下降。100 μg/L noggin或PBS本身对BMP-2的基础表达无明显影响,见图3。
5BMP-2拮抗剂noggin抑制Sr对ALP活性的促进作用
3 mmol/L Sr处理BMSCs 7 d后,与对照组相比,细胞内ALP活性显著增加(P<0.05),在Sr处理细胞前,给予100 μg/L noggin预处理2 h后,细胞内ALP活性显著降低(P<0.05)。Noggin(100 μg/L)或PBS本身对ALP活性无明显影响,见图4。
6BMP-2拮抗剂noggin抑制Sr对钙结节生成的促进作用
图5显示,3 mmol/L Sr处理BMSCs 21 d后,与对照组相比,细胞内钙结节数量明显增加,在Sr处理细胞前,给予100 μg/L noggin预处理2 h后,细胞内钙结节数量明显减少。Noggin (100 μg/L)或PBS本身对钙结节形成无明显影响,见图5。


图2Sr对BMSCsBMP-2表达的影响
讨 论
Urist[5]于上世纪60年代最早利用脱钙骨基质在肌肉内诱发异位成骨,这一实验结果提示在骨基质中可能含有一种活性蛋白质, 这种活性蛋白质可以在骨骼和骨骼以外的部位诱生出骨和软骨组织,它后来被命名为BMPs。BMPs是一组具有类似高度保守结构的的功能强大的糖蛋白,除BMP-1属于金属肽链内切酶家族(the astacin family of metallo-endopeptidases)外,其余均属于转化生长因子 β(transforming growth factor β,TGF-β)超家族。迄今为止,在人类胚胎发生、骨骼形成、造血生成及神经发育过程中,已经鉴定出骨形态发生蛋白家族超过20种具有各种不同作用的成员[9]。BMP-2已经成为BMPs家族里被研究最广的成员,其功能主要是从骨折愈合、骨质缺损以及一些脊柱融合模型中分析得出[10]。已有临床前研究和临床研究表明,BMP-2可以在骨缺损、非连续骨折、脊柱融合、骨质疏松症和根管手术中使用[11]。Govender等[12]报道一项包括450例受试者的前瞻性、随机、对照、单盲研究结果,接受包含重组BMP-2治疗的试验组获得了更快的骨折愈合(P<0.01)和更少的感染发生率(P<0.05)。重组人BMP-2是唯一在胫骨骨折和脊柱融合应用方面具有完整前瞻、随机临床试验的BMP[13],并于2002年7月2日被美国FDA批准作为一种骨移植替代物用于脊柱融合[14]。此外,BMP-2在肿瘤学领域也发挥了它特有的作用[15]。


图3BMP-2抑制剂noggin预处理拮抗Sr对BMP-2表达的促进作用
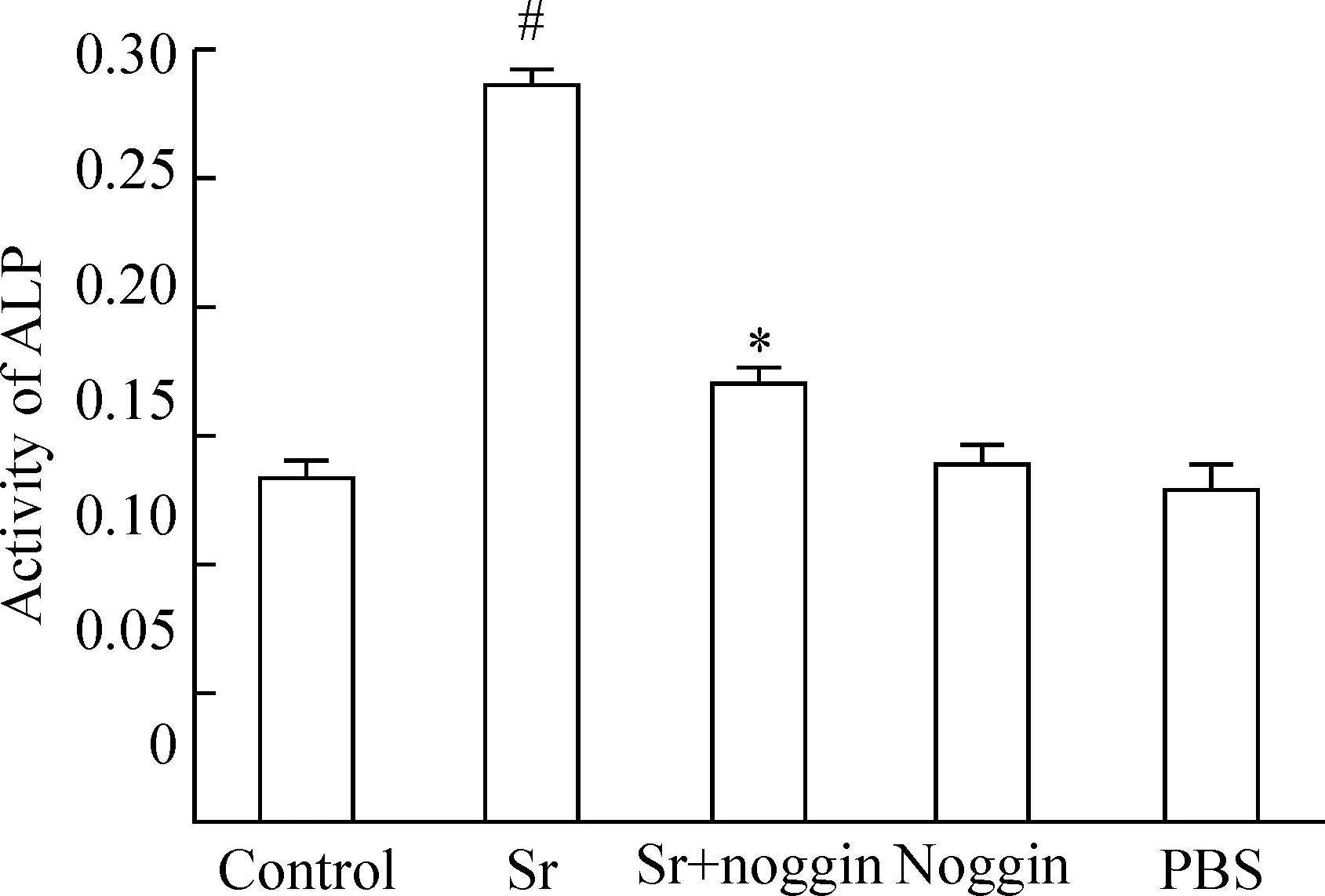

图4BMP-2抑制剂noggin预处理阻断Sr对ALP活性的促进作用

Figure 5. Preconditioning with BMP-2 inhibitor noggin inhibited Sr-induced mineralization in BMSCs(×100).A:control;B:Sr;C:Sr+noggin;D:noggin;E:PBS.
图5BMP-2抑制剂noggin预处理阻断Sr对钙结节生成的促进作用
本研究证实了Sr可促进BMSCs分化为成骨细胞,这与国内外很多研究结论相一致[2-3]。重要的是本研究首次证实,在BMSCs分化为成骨细胞的过程中,Sr上调了BMP-2的表达,而且BMP-2的拮抗剂noggin不仅拮抗Sr对BMP-2表达的上调作用,还抑制Sr的促成骨作用,这提示上调的BMP-2介导了Sr对BMSCs分化为成骨细胞的促进作用,为深入阐明锶盐抗骨质疏松的机制提供了新的实验依据,也为防治骨质疏松症以及各种骨科疾病新药的研发提供了新的作用靶点。
[1] Choudhary S, Halbout P, Alander C, et al. Strontium ranelate promotes osteoblastic differentiation and mineralization of murine bone marrow stromal cells: involvement of prostaglandins[J]. J Bone Miner Res,2007,22(7):1002-1010.
[2] Sila-Asna M, Bunyaratvej A, Maeda S, et al. Osteoblast differentiation and bone formation gene expression in strontium-inducing bone marrow mesenchymal stem cell[J]. Kobe J Med Sci,2007,53(1-2):25-35.
[3] Caverzasio J. Strontium ranelate promotes osteoblastic cell replication through at least two different mechanisms[J]. Bone,2008,42(6):1131-1136.

[5] Urist MR.Bone: formation by autoinduction[J]. Science,1965,150(698):893-899.
[6] Ye L, Mason MD, Jiang WG.Bone morphogenetic protein and bone metastasis, implication and therapeutic potential[J].Front Biosci, 2011,1(16):865-897.
[7] Reddi AH.Bone morphogenetic proteins: from basic science to clinical applications[J].J Bone Joint Surg Am,2001,83-A Supp 1(Pt 1):S1-S6.
[8] Gautschi OP, Frey SP, Zellweger R.Bone morphogenetic proteins in clinical applications[J].ANZ J Surg,2007,77(8):626-631.
[9] Bragdon B, Moseychuk O, Saldanha S,et al. Bone morphogenetic proteins: a critical review[J]. Cell Signal,2011,23(4):609-620.
[10]Valdes MA, Thakur NA, Namdari S,et al. Recombinant bone morphogenic protein-2 in orthopaedic surgery: a review[J].Arch Orthop Trauma Surg,2009,129(12):1651-1657.
[11]Chen D, Zhao M, Mundy GR.Bone morphogenetic proteins[J].Growth Factors,2004,22(4):233-241.
[12]Govender S, Csimma C, Genant HK, et al. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures: a prospective, controlled, randomized study of four hundred and fifty patients[J]. Bone Joint Surg Am,2002,84-A(12):2123-2134.
[13]Khan SN, Lane JM.The use of recombinant human bone morphogenetic protein-2 (rhBMP-2) in orthopaedic applications[J].Expert Opin Biol Ther,2004,4(5):741-748.
[14]McKay B.Local sustained delivery of recombinant human bone morphogenetic protein-2 (rhBMP-2)[J].Conf Proc IEEE Eng Med Biol Soc,2009,2009:236-237.
[15] 黄培德, 黄飞程, 陈 阳, 等. 重组人骨形成蛋白-2提高人乳腺癌细胞MCF-7的迁移性[J]. 中国病理生理杂志, 2010,26(5):931-936.
Strontiumranelatepromotesdifferentiationofbonemarrowmesenchymalstemcellstoosteoblastsbyincreasingexpressionofbonemorphogeneticprotein2
WANG Yang1, 2, LI Zheng1, 2, WANG Xiao-na1, 2, LAN Ai-ping3, WU Wen1,2
(1SouthernMedicalUniversity,Guangzhou510080,China;2DepartmentofEndocrinology,EastWardofGuangdongGeneralHospital,Guangzhou510080,China;3DepartmentofPhysiology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:wuwen1964@163.com)
AIM: To explore whether strontium ranelate (Sr) promotes differentiation of rat bone marrow mesenchymal stem cells (BMSCs) to osteoblasts by increasing the expression of bone morphogenetic protein 2 (BMP-2).METHODSRat BMSCs were isolated, purified and cultured, then were induced to differentiate into osteoblasts. The cells were treated with different concentrations of Sr or noggin (an inhibitor of BMP-2) according to the experimental purposes. The activity of alkaline phosphatase (ALP) was measured by colorimetry. Mineralized nodules were measured by alizarin red staining. The expression of BMP-2 was detected by Western blotting.RESULTSTreatment with Sr at concentrations of 0.1 mmol/L to 7 mmol/L for 7 d obviously increased the activity of ALP,and Sr at concentration of 3 mmol/L produced the maximum effect. Exposure of the cells to Sr at concentration of 3 mmol/L for 21 d significantly increased mineralized nodules. Exposure of the cells to Sr at concentrations of 0.1 mmol/L to 7 mmol/L for 7 d markedly increased the expression of BMP-2. Preconditioning with noggin at concentration of 100 μg/L for 2 h not only inhibited Sr-induced expression of BMP-2, but also antagonized the increase in the activity of ALP and mineralization induced by Sr in BMSCs.CONCLUSIONUp-regulation of the expression of BMP-2 may be one of the mechanisms by which Sr promotes differentiation of rat BMSCs to osteoblasts.
Strontium ranelate; Bone marrow mesenchymal stem cells; Bone morphogenetic protein 2; Osteoblasts
R589
A
10.3969/j.issn.1000-4718.2012.03.004

