索拉菲尼对肝硬化大鼠部分肝切除术后肝脏再生的影响*
周小虎, 张红卫, 万云乐
(中山大学孙逸仙纪念医院肝胆外科, 广东 广州 510120)
1000-4718(2012)03-0528-06
2011-10-24
2011-12-07
北京市希思科临床肿瘤学研究基金会基金资助项目 (No.Y-2009-017).
△通讯作者 Tel:020-34071170;E-mail:hongweizhang88@126.com
·短篇论著·
索拉菲尼对肝硬化大鼠部分肝切除术后肝脏再生的影响*
周小虎, 张红卫△, 万云乐
(中山大学孙逸仙纪念医院肝胆外科, 广东 广州 510120)
目的在大鼠肝硬化模型的基础上行肝脏部分切除(PH),研究索拉菲尼(sorafenib)对大鼠肝脏再生的影响。方法使用二乙基亚硝胺(DEN)诱导Wistar大鼠肝硬化,成功建立30只肝硬化大鼠PH模型后,随机分2组,每组15只。术后第1 d开始,分别给予实验组索拉菲尼(30 mg·kg-1·d-1)、对照组生理盐水灌胃10 d后处死。留取PH后及实验结束后的血液及肝脏标本,检测2组肝脏再生率(LRR),增殖细胞核抗原(PCNA),生化指标: 丙氨酸转移酶(ALT)和血清白蛋白(ALB)、血清总胆红素(TBIL)和血清直接胆红素(DBIL)的变化,血管生成相关因子:血管内皮生长因子(VEGF)、血管内皮生长因子受体2(VEGFR-2)、血小板源性生长因子受体β(PDGFR-β),以及肝脏微血管密度(MVD)的变化。结果(1)LRR在实验组及对照组分别为45.43%±3.36%和44.21%±2.77%,无显著差异(P>0.05);(2)免疫组织化学(IHC)没有检测到PCNA;(3)2组的生化指标无显著差异(P>0.05);(4)实验组VEGFR-2和PDGFR-β的表达受到抑制,MVD降低,并且实验组与对照组差异有统计学意义(P<0.01)。结论索拉菲尼虽然对肝硬化血管再生相关因子有抑制作用,但是对肝细胞再生和肝功能没有明显影响。
索拉菲尼; 肝硬化; 肝再生; 肝切除术
肝细胞癌(hepatocellular carcinoma,HCC)是一种严重威胁人类健康的恶性肿瘤,在全球恶性肿瘤中排第6位,在全球癌症相关致死亡原因中排第3位[1]。肝细胞癌是少有的几个有明确危险因素的癌症之一,大约80%的HCC病例发生在肝硬化基础上,因此肝硬化这一癌前病变是发生肝细胞癌的最强诱因[2]。手术是HCC的主要治疗手段,早期HCC患者手术切除后5年生存率可达50%, 但是HCC的术后复发率很高,术后3年复发率为50%,5年复发率则高达70%[3]。
索拉非尼(sorafenib)是一种多激酶抑制剂,它对多种受体酪氨酸激酶[如血管内皮生长因子受体 2(vascular endothelial growth factor receptor 2,VEGFR-2)、血小板源性生长因子受体(platelet derived growth factor receptor,PDGFR)、Fms样酪氨酸激酶3(Fms-like tyrosine kinase 3,FLT3)、Ret、c-Kit和丝氨酸/苏氨酸激酶(b-Raf, p38)]发挥抑制活性,通过抑制VEGFR-2和PDGFR的活性抑制新生血管的形成进而影响肿瘤血供,以及通过Raf激酶通路抑制肿瘤细胞增殖及诱导其凋亡[4]。Ⅲ期随机双盲安慰剂对照临床试验证实,索拉非尼用于治疗晚期HCC可使患者的生存时间延长3个月[5-7]。由于临床上大部分肝癌病人合并肝硬化,其中部分肝癌病人的切除手术难以达到根治性切除,而目前已知索拉菲尼是唯一被证明有效的治疗肝癌的系统性治疗药物。 所以,在非根治性肝癌切除术后早期应用索拉菲尼能否抑制残留癌细胞的生长从而提高生存率已成为临床关注的热点。然而,在肝硬化病人肝部分切除术后的早期,索拉菲尼是否会抑制肝硬化的肝细胞增殖,并导致肝功能不全,目前仍不清楚。因此,本研究通过建立肝硬化大鼠部分肝脏切除模型,研究索拉菲尼对肝硬化肝脏再生及肝功能的影响。
材 料 和 方 法
1动物及分组
雄性Wistar大鼠,体重170~200 g,喂养于SPF级环境。索拉菲尼溶解于聚氧乙烯蓖麻油/95% 乙醇 (50∶50,Sigma),室温避光保存。在大鼠形成明显肝硬化后行30%肝部分切除术(partial hepatectomy , PH)后随机分2组,每组15只。术后第1 d开始,实验组给予索拉菲尼(30 mg·kg-1·d-1),对照组给予生理盐水,喂养10 d后处死。收集PH后以及实验结束后的大鼠血液及肝脏标本。血液用于肝脏生化检测,每份肝组织一部分置于多聚甲醛固定24 h后石蜡包埋用于免疫组化检测,一部分置于液氮速冻后冻存用于Western blotting 分析。
2大鼠肝硬化肝脏部分切除模型的建立
参照华赟鹏等[8]诱导大鼠肝硬化方法,Wistar大鼠适应环境1周后,每天自由饮用含0.095 g/L 二乙基亚硝胺(diethylnitrosamine,DEN)(Sigma)的纯水60 d后形成明显的肝硬化,苏木素-伊红(HE)染色: 肝内假小叶明显形成。2 d后按照Higgins等[9]方法进行30%部分肝(肝左叶)切除:所有大鼠术前均禁食24 h,不禁水。戊巴比妥钠(3O mg/kg)腹腔注射全麻。取腹部正中切口进腹,暴露肝脏左叶,游离肝左叶并结扎其血管,进而切除肝左叶。模型大鼠术后分组如上述介绍。
3指标测定
3.1肝脏再生率(liver regeneration rate,LRR)的测定 参照Fan等[10]的实验方法,预实验中我们得到了切除肝重(resected liver weight,RLW)与总肝重(total liver weight)的比值,由此根据切除的肝重和实验结束后残余肝重(remnant liver weight),我们得出肝脏再生比率LRR=(Mb-Ma)/Ma×100%。其中Ma为肝部分切除术后大鼠理论残肝质量,Mb为处死大鼠取标本时的残余肝质量。
3.2肝脏生化指标的测定 处死大鼠时,从下腔静脉采集血液进行生化检测:血清丙氨酸转氨酶(alanine transaminase,ALT),血清白蛋白(albumin,ALB),总胆红素(total bilirubin,TBIL),直接胆红素(direct bilirubin,DBIL)。用于评估肝脏功能。
3.3增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及肝脏血管再生相关因子VEGFR-2、PDGFR-β、CD31的免疫组化检测 留取的肝脏组织经多聚甲醛溶液固定、石蜡包埋。连续切片,厚4 μm。切片常规脱蜡后蒸馏水冲洗5 min;用30 mL/L H2O2孵育30 min以抑制内源性过氧化物酶,0.1 mol/L枸橼酸缓冲液(pH 6.0)抗原修复10 min,用10 mL/L正常小牛血清孵育20 min封闭;分别滴加Ⅰ抗[PCNA(Dako),PCI0 MAb 1∶50;VEGFR-2(ab39638 goat polyclonal,Abcam,1∶50);PDGFR-β(SC-339 goat polyclonal);CD-31(SC-1506 goat polyclonal;Santa Cruz Biotechnology,diluted 1∶100)],4 ℃湿盒内孵育过夜,PBS冲洗3次×5 min;加多聚体的Ⅱ抗(中杉金桥,PV-6001 PowerVisionTMTwo-Step Histostaining Reagent 二步法免疫组化检测试剂),室温孵育30 min;PBS彻底冲洗;DAB显色液(中杉金桥,ZLI-9017 DAB Kit) 染色2~5 min。苏木素复染;系列乙醇脱水,二甲苯透明;树胶封片观察。 组织片置于显微镜下×400观察,每张片随机选取4个视野,并用数码相机(Nikon ECLIPSE, Nis-elment)拍照获取图片数据。
3.4Western blotting 检测VEGF、VEGFR-2和PDGFR-β的表达 肝脏组织液氮速冻后-80 ℃冰箱冻存。肝脏组织蛋白提取按照试剂盒说明书进行操作: 称取100 mg肝组织液氮下研磨成粉状加入细胞裂解液RAPA及蛋白酶抑制剂PUSF,冰上静止30 min然后4°离心30 min提取总蛋白。蛋白样品用样品缓冲液进行稀释并煮沸。30 μg蛋白样品通过凝胶电泳进行分离,然后点转到PVDF膜上,用5%(W/V)脱脂奶粉封闭,孵育Ⅰ抗[(兔抗大鼠 VEGF(1∶2 000),VEGFR-2(1∶2 000),PDGFR-β(1∶2 000)]4 ℃过夜,洗膜, 孵育羊抗兔结合的过氧化物酶标记的Ⅱ抗(1∶3 000)常温1 h,洗膜30 min,然后蛋白条带使用ECL发光及Western blotting(Amersham Life Science)检测。Quantity One 软件用于分析蛋白条带。
4统计学处理
结 果
1LRR的比较
结果显示,术后大鼠残余肝细胞迅速增殖,肝脏体积增大,实验组和对照组10 d的LRR差异无统计学意义(45.43% ± 3.36%vs44.22% ± 2.77%,P>0.05))。
2肝细胞PCNA的比较
大鼠肝部分切除术后10 d,没有发现2组肝脏细胞核中阳性染色,2组PCNA表达无显著差异(P>0.05)。
3肝脏生化指标
结果显示,肝部分切除术后10 d,实验组大鼠肝功能指标在服用索拉菲尼前后没有显著变化,并且实验组与对照组肝功指标亦无显著区别(P>0.05),见图1。


图1Sorafenib组、对照组及肝部分切除术前肝硬化大鼠的肝功能指标
4肝脏血管再生相关因子及微血管的变化
4.1索拉菲尼对VEGFR-2表达的抑制作用 图2显示,大鼠肝脏部分切除术后10 d后, 对照组VEGFR-2较处理前增加了36.5%(P<0.01)。用索拉菲尼(30 mg·kg-1·d-1)10 d后,实验组VEGFR-2的表达较对照组减少了36.7% (P<0.01)。图3显示,与处理前相比,对照组VEGFR-2表达增加,用索拉菲尼 10 d后显著抑制VEGFR-2的表达。实验组与对照组比有显著差异(P<0.01)。
4.2索拉菲尼对PDGFR-β表达的抑制作用 结果显示,与处理前相比,对照组PDGFR-β增加了24.2%,但两者差异无统计学意义(P>0.05)。实验组与对照组相比减少49.8%(P<0.01),见图2、3。
4.3索拉菲尼对VEGF的影响 VEGF在对照组中并没有伴随VEFGR-2以及PDGFR-β的表达升高而升高,实验组与对照组比无显著差异(P>0.05),见图2。
4.4索拉菲尼对肝内新生血管的影响 免疫组化结果显示,与处理前相比,对照组的残肝中CD31阳性血管增加了76.3%;与对照组相比,实验组CD31阳性血管减少了73.2%。实验组与对照组比差异有统计学意义 (P<0.01),见图3。


图2免疫印迹分析Sorafenib组、对照组及肝部分切除的肝组织中VEGFR-2、PDGFR-β及VEGF的表达

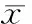
图3免疫组化分析Sorafenib组、对照组及肝部分切除的肝组织中VEGFR-2、PDGFR-β及CD31的表达
讨 论
肝脏部分切除术后其再生的研究已在多个动物模型中开展[11,14-19]。我们在肝硬化模型的基础上,研究多激酶抑制剂索拉菲尼对肝脏再生、肝脏功能及肝内血管生成是否具有抑制作用。这种关注于肝硬化基础上肝脏再生的研究,对于任何新药的疗效和潜在的临床应用性的转化型研究来说都是必要的。
我们的研究表明,索拉菲尼对肝硬化大鼠部分肝脏切除后肝脏再生、肝脏生化、肝细胞增殖没有显著影响,而对肝内血管再生等因子有明显的抑制作用。我们的结果显示,实验组和对照组大鼠肝脏切除后观察10 d,发现2组肝脏都迅速再生且很快恢复到正常肝脏功能,2组残肝再生比率没有显著差异。实验结束后残肝标本中没能检测到PCNA,其可能原因是:肝脏再生后达到稳定期,肝细胞分裂增殖停止,不再产生PCNA。肝脏能够精确的调节肝的生长及体积,肝细胞减少能触发肝细胞复制,增大的肝脏则诱导肝细胞凋亡以恢复到最佳肝体重比率、恢复肝脏正常功能及体积[20]。 并且有研究证明肝细胞在正常情况下很少分裂增殖,但在肝脏部分切除后24 h就有PCNA表达阳性,48 h达到最高点,随后减少,术后10 d就可恢复到正常水平[11]。
VEGFR-2及PDGFR-β对多阶段血管生成过程的调节至关重要[21-22]。然而索拉菲尼对肝内血管再生等因子的抑制作用比较明显,观察10 d证实索拉菲尼在实验组中明显抑制了VEGFR-2及PDGFR-β,这在索拉菲尼治疗恶性肿瘤多项研究中得到体现[4, 23-24]。肿瘤与VEGFR-2和PDGFR-β密切相关,并且多项研究证明VEGFR-2和PDGFR-β可以促进血管再生促进肿瘤发生及转移,本实验也证实VEGFR-2和PDGFR-β在肝脏部分切除术后明显升高,这可能是肝癌术后复发的一个关键因素。阚和平等[25]研究表明索拉菲尼对于富含微血管的肝细胞癌肝移植后肿瘤复发有良好的抑制作用。我们的结果证实实验组的血管生成较对照组减少约73.2%。对照组血管生成的增加并没有伴随VEGF的的高表达,并且其在实验组和对照组中的表达并没有明显变化,这可能是因为索拉菲尼不影响VEGF的表达。另有观点认为:肝硬化早期增加的VEGF诱导内皮细胞增殖和血管的形成,而晚期阶段,新生血管的稳定与成熟主要通过其它生长因子来调节[26-27]。无论如何,血管生成是一个多因素的极其复杂的过程,由多种因子在不同水平进行调节[22]。
总之,我们的研究为证明索拉菲尼对肝硬化部分肝脏切除术后肝脏再生及血管生成的影响提供了有力的体内证据。索拉菲尼虽然可以抑制肝内血管再生相关因子的表达,但是不影响肝细胞的增殖,不影响肝脏的再生及肝功能。
[1] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin,2005,55(2):74-108.
[2] Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma[J]. Lancet,2003,362(9399):1907-1917.
[3] Llovet JM, Schwartz M, Mazzaferro V. Resection and liver transplantation for hepatocellular carcinoma[J]. Semin Liver Dis,2005,25(2):181-200.
[4] Liu L, Cao Y, Chen C, et al. Sorafenib blocks the RAF/MEK/ERK pathway, inhibits tumor angiogenesis, and induces tumor cell apoptosis in hepatocellular carcinoma model PLC/PRF/5[J]. Cancer Res,2006,66(24):11851-11858.
[5] Llovet J, Ricci S, Mazzaferro V, et al. Sorafenib improves survival in advanced hepatocellular carcinoma (HCC): results of a phase III randomized placebo-controlled trial (SHARP trial).[J]. J Clin Oncol,2007,25(Suppl):962s(abstract LBA1).
[6] Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol,2009,10(1):25-34.
[7] Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular[J]. N Engl J Med,2008,359(4):378-390.
[8] 华赟鹏,李绍强,刘 杰,等. 肝硬化大鼠肝癌细胞原位种植瘤模型的建立[J]. 中国病理生理杂志,2009,25(10):2073-2077.
[9] Higgins GM, Anderson RM. Restoration of the liver of the white rat following partial surgical removal[J]. Arch Pathol,1931,12:186-202.
[10]Fan YD, Praet M, van Huysse J, et al. Effects of portal vein arterialization on liver regeneration after partial hepatectomy in the rat[J]. Liver Transpl,2002,8(2):146-152.
[11]Kraizer Y, Mawasi N, Seagal J, et al. Vascular endothelial growth factor and angiopoietin in liver regeneration[J]. Biochem Biophys Res Commun,2001,287(1):209-215.
[12]Lee JS, Semela D, Iredale J, et al. Sinusoidal remodeling and angiogenesis: a new function for the liver-specific pericyte?[J]. Hepatology,2007,45(3):817-825.
[13]Mejias M, Garcia-Pras E, Tiani C, et al. Beneficial effects of sorafenib on splanchnic, intrahepatic, and portocollateral circulations in portal hypertensive and cirrhotic rats[J]. Hepatology,2009,49(4):1245-1256.
[14]Assy N, Spira G, Paizi M, et al. Effect of vascular endothelial growth factor on hepatic regenerative activity following partial hepatectomy in rats[J]. J Hepatol,1999,30(5):911-915.
[15]Makino H, Shimizu H, Ito H, et al. Changes in growth factor and cytokine expression in biliary obstructed rat liver and their relationship with delayed liver regeneration after partial hepatectomy[J]. World J Gastroenterol,2006,12(13):2053-2059.
[16]Harun N, Nikfarjam M, Muralidharan V, et al. Liver regeneration stimulates tumor metastases[J]. J Surg Res,2007,138(2):284-290.
[17]Deng M, Huang H, Jin H, et al. The anti-proliferative side effects of AEE788, a tyrosine kinase inhibitor blocking both EGF- and VEGF-receptor, are liver-size-dependent after partial hepatectomy in rats[J]. Invest New Drugs,2011,29(4):593-606.
[18]Bockhorn M, Fingas CD, Rauen U, et al. Erythropoietin treatment improves liver regeneration and survival in rat models of extended liver resection and living donor liver transplantation[J]. Transplantation,2008,86(11):1578-1585.
[19]Shimizu H, Miyazaki M, Wakabayashi Y, et al. Vascular endothelial growth factor secreted by replicating hepatocytes induces sinusoidal endothelial cell proliferation during regeneration after partial hepatectomy in rats[J]. J Hepatol,2001,34(5):683-689.
[20]Fausto N. Liver regeneration[J]. J Hepatol,2000,32(1 Suppl):19-31.
[21]Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res,2004,64(19):7099-7109.
[22]Folkman J, D’Amore PA. Blood vessel formation: what is its molecular basis?[J]. Cell,1996,87(7):1153-1155.
[23]Chang YS, Adnane J, Trail PA, et al. Sorafenib (BAY 43-9006) inhibits tumor growth and vascularization and induces tumor apoptosis and hypoxia in RCC xenograft models[J]. Cancer Chemother Pharmacol,2007,59(5):561-574.
[24]Kim S, Yazici YD, Calzada G, et al. Sorafenib inhibits the angiogenesis and growth of orthotopic anaplastic thyroid carcinoma xenografts in nude mice[J]. Mol Cancer Ther,2007,6(6):1785-1792.
[25]阚和平,谭永法,周 杰. 索拉非尼治疗肝移植术后肝癌复发的疗效与肿瘤组织Ki-67表达及微血管密度的关系[J]. 中国病理生理杂志,2011,27(8):1549-1551.
[26]Medina J, Caveda L, Sanz-Cameno P, et al. Hepatocyte growth factor activates endothelial proangiogenic mechanisms relevant in chronic hepatitis C-associated neoangiogenesis[J]. J Hepatol,2003,38(5):660-667.
[27]Tanaka S, Mori M, Sakamoto Y, et al. Biologic significance of angiopoietin-2 expression in human hepatocellular carcinoma[J]. J Clin Invest,1999,103(3):341-345.
Effectofsorafenibonliverregenerationafterpartialhepatoectomyinlivercirrhoticrats
ZHOU Xiao-hu, ZHANG Hong-wei, WANG Yun-le
(DepartmentofHepatobiliarySurgery,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:hongweizhang88@126.com)
AIM: To study the effect of sorafenib on the liver regeneration after partial hepatectomy (PH) in cirrhotic rats.METHODSThirty Wistar rats with liver cirrhosis induced successfully with diethylnitrosamine (DEN) underwent 30% PH and then were randomly divided into 2 groups (n=15). The rats in experimental group were fed with sorafenib at dose of 30 mg·kg-1·d-1from the 1st day to the 10th day after PH, while those in control group were fed with vehicle by gavage. The blood and liver tissues of the rats were collected after PH and at the end of the experiment. Liver regeneration rate (LRR) and proliferating cell nuclear antigen (PCNA) expression were assessed for determining the hepatocyte proliferation. The content of alanine transaminase (ALT), albumin (ALB), total bilirubin (TBIL), direct bilirubin (DBIL), angiogenesis related factors including vascular endothelial growth factor (VEGF), vascular endothelial growth factor receptor 2 (VEGFR-2), platelet-derived growth factor receptor β (PDGFR-β) and micro-vessel density (MVD) were measured in both groups.RESULTSLRRs on day 10 after PH were 45.43%±3.36% and 44.21%±2.77% in experimental group and control group, respectively (P>0.05), and the expression of PCNA in hepatic tissues of the rats was not found by the method of immunohistochemistry in both groups. Liver function index had no significant difference between the 2 groups (P>0.05). However, other than VEGF, sorafenib resulted in inhibition of VEGFR-2 and PDGFR-β expression and reduction of MVD in experiment group, and significant difference between the 2 groups was observed (P<0.01).CONCLUSIONSorafenib does not influence live regeneration after PH in liver cirrhotic rats.
Sorafenib; Liver cirrhosis; Liver regeneration; Hepatectomy
R363
A
10.3969/j.issn.1000-4718.2012.03.025

