MicroRNA-30a调控Beclin-1对缺氧复氧乳鼠心肌细胞的保护效应*
晏 浩, 徐建军△, 李文林, 朱书强, 龙 翔, 车建鹏, 陈立如
(南昌大学 1第二附属医院胸心外科,2 医学院,江西 南昌 330006)
1000-4718(2012)04-0583-06
2011-10-13
2011-12-20
国家自然科学基金资助项目(No.30960381);江西省教育厅科研项目(No.GJJ08097)
△通讯作者 Tel:0791-86293362; E-mail:xujianjun3526@163.com
MicroRNA-30a调控Beclin-1对缺氧复氧乳鼠心肌细胞的保护效应*
晏 浩1, 徐建军1△, 李文林2, 朱书强1, 龙 翔1, 车建鹏1, 陈立如1
(南昌大学1第二附属医院胸心外科,2医学院,江西 南昌 330006)
目的观察microRNA-30a(miR-30a)在原代心肌细胞缺氧复氧中的作用,探讨miR-30a保护缺血再灌注心肌的分子机制。方法重组构建慢病毒miR-30a表达载体(LV-GFP-miR-30a)感染原代乳鼠心肌细胞,构建缺氧复氧损伤模型。实验分为正常培养组、单纯缺氧复氧组、LV-GFP加缺氧复氧组、LV-miR-30a-GFP加缺氧复氧组和3-甲基腺嘌呤(3-MA)加缺氧复氧组。Real-time PCR检测缺氧复氧和慢病毒感染对miR-30a的表达影响,Western blotting检测LC3和Beclin-1蛋白表达变化,TUNEL和PI染色检测缺氧复氧后心肌细胞死亡情况。结果(1)缺氧复氧后心肌miR-30a表达水平下调(P<0.05);(2)慢病毒miR-30a表达载体高效感染后心肌细胞miR-30a表达水平上调(P<0.05),心肌过表达miR-30a下调Beclin-1蛋白表达(P<0.05);(3)心肌过表达miR-30a抑制缺氧复氧后Beclin-1表达(P<0.05);3-MA处理减少缺氧复氧后心肌Beclin-1表达,减少缺氧复氧后LC3-Ⅰ转化为LC3-Ⅱ(P<0.05);(4)过表达miR-30a和3-MA处理减少缺氧复氧后心肌细胞凋亡(P<0.05)。结论心肌细胞过表达miR-30a显著下调Beclin-1;抑制自噬可以减少缺氧复氧后心肌细胞死亡。
缺血再灌注; 细胞凋亡; 微小RNA; 自吞噬作用
心肌梗死发生后心肌供氧供能严重不足,心肌细胞由于损伤方式和程度不同,表现出多种形式死亡:坏死、凋亡(Ⅰ型程序性死亡)和自噬性死亡(Ⅱ型程序性死亡),而坏死、凋亡和自噬三者间又同时存在协同和拮抗关系。自噬是一个高度保守的生命过程,在真核生物和原核生物已经确定了参与自噬的30多个自噬相关基因(Atg)。生理条件下自噬是细胞长存蛋白和细胞器代谢再循环的主要方式。而应激时自噬为细胞生存提供应急能量和清除有害细胞器,而过度激活自噬将导致自我消化而加重损伤。微小RNA(microRNA,miRNA)参与心肌缺血再灌注损伤多个环节的调控,被认为参与沉默多个信号通路上的关键蛋白[1]。各种心肌病理过程中miR-30a表达均有改变,我们通过生物信息软件TargetScan预测rno-miR-30a可能调控大鼠Beclin-1(真核基因Atg6同源基因)表达,而且Beclin-1被认为是心肌缺血再灌注过程中的主要自噬功能基因,但其调控机制尚不清楚。本研究关注于心肌再灌注损伤中心肌自噬的作用,通过在原代心肌细胞过表达miR-30a,观察缺氧复氧中心肌细胞经典自噬蛋白Beclin-1蛋白表达与心肌细胞死亡的相关性,探讨miR-30a保护缺血心肌的分子机制。
材 料 和 方 法
1主要试剂
Trizol reagent(Invitrogen); TUNEL显色法细胞凋亡检测试剂盒(Merck),碘化丙啶 (南京凯基);3-甲基腺嘌呤(3-methyladenine,3-MA)和BrdU(Sigma);抗体LC3(Abcam)、 Beclin-1(Cell Signaling Technology)和β-actin(Santa Cruz)及辣根过氧化物酶偶联Ⅱ抗(北京中杉);蛋白提取试剂盒、蛋白酶磷酸酶复合抑制剂(普利莱);BCA蛋白定量(碧云天);增强型化学发光显色试剂盒(Thermo);其它试剂均为市售分析纯。
2方法
2.1原代细胞培养 取出生1~2 d的Sprague Dawley大鼠[江西中医学院动物实验中心,许可证号为SCXK(赣)2005-0001],用75%乙醇消毒皮肤;颈椎脱臼处死乳鼠,开胸取心室肌,剪成约1 mm×1 mm×1 mm大的碎块,用0.25%胰酶PBS缓冲液在37 ℃水浴中多次振荡消化,每次5 min,共12~18次。收集除第1次以外的上清,用含15%胎牛血清的高糖DMEM终止消化,离心取细胞沉淀,加入培养液,集中混匀制成细胞悬液。应用差速贴壁法分离纯化心肌细胞,并添加100 μmol/L BrdU抑制非心肌细胞增殖。
2.2重组慢病毒的构建及转染 上海吉凯基因化学构建rno-miR-30a过表达慢病毒(LV-GFP-miR-30a)及对照慢病毒(LV-GFP),本实验慢病毒以感染复数值为70感染原代心肌细胞,每孔中加入5 mmol/L polybrene增强感染效率,转染72 h后荧光显微镜下观察 GFP 绿色荧光,估算细胞转染效率。
2.3构建心肌缺氧复氧模型 正常培养转染心肌细胞72 h,观察心肌搏动频率情况后进行缺氧复氧培养,37 ℃预热配制的缺氧液和复氧液,将培养的心肌细胞换用预充有95%N2+5%CO2的缺氧液,95%N2+5%CO2的密闭容器中培养2 h。再将缺氧的心肌细胞换用预充95%O2+5%CO2的含糖复氧液,并在95%O2+5%CO2的密闭容器中培养4 h,建立缺氧/复氧损伤模型[2-3]。
2.4实验分组 根据实验方案实验分为5组:(1)正常培养组:更换正常培养基后在5% CO2培养箱正常培养6 h;(2)单纯缺氧复氧组:更换缺氧液缺氧培养2 h,再更换复氧液复氧培养4 h;(3)LV-GFP加缺氧复氧组:LV-GFP感染心肌细胞更换缺氧液缺氧培养2 h,再更换复氧液复氧培养4 h;(4)LV-GFP-miR-30a加缺氧复氧组:LV-GFP-miR-30a感染细胞更换缺氧液缺氧培养2 h,再更换复氧液复氧培养4 h;(5)3-MA加缺氧复氧组:更换含5 mmol/L 3-MA缺氧液缺氧培养2 h,再更换含5 mmol/L 3-MA复氧液复氧培养4 h。
2.5实时定量PCR法检测心肌miR-30a表达变化 常规Trizol方法抽提心肌细胞总RNA, 通过Bulge-LoopTMRT Primer反转录,采用 SYBR Green进行qRT-PCR,引物序列采用Bulge-LoopTM-rno-miR-30a定量检测引物和U6 snRNA为内参照(广州锐博生物),反应参数: 预变性95 ℃ 20 s,95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,40个循环,miR-30a和U6产物倍数按2-ΔΔCt计算。
2.6TUNEL法检测心肌细胞凋亡 参照试剂盒说明书。处理后各组心肌细胞在4 ℃ 4%甲醛固定30 min,室温孵育15 min水合,使用蛋白酶K孵育20 min透性处理样品,再30%H2O2与甲醇室温孵育5 min灭活内源性过氧化物酶,平衡缓冲液室温孵育30 min,接着37 ℃孵育1.5 h标记反应,终止缓冲液终止反应,封闭缓冲液封闭30 min,最后甲基绿复染3 min,二甲苯封片。各组分别取5张,每张随机取10个视野计算,褐色为凋亡阳性细胞,绿色和浅色为非凋亡细胞,计算凋亡指数(apoptotic index,AI)(AI=凋亡阳性细胞数/总细胞数×100%)。
2.7碘化丙啶(PI)染色检测心肌细胞死亡 PI检测参照试剂盒说明书,各组处理后心肌细胞洗涤后加入PI避光孵育5 min,PI荧光信号呈红色,使用CKX41倒置荧光成像系统(Olympus)观察和拍照分析。
2.8Western blotting 检测LC3和Beclin-1蛋白表达 按照总蛋白提取试剂盒说明,添加蛋白酶磷酸酶复合抑制剂,裂解液冰上充分裂解组织蛋白,高速离心沉淀总蛋白后乙醇洗涤,十二烷基磺酸钠溶液溶解总蛋白,并按BCA法蛋白定量检查蛋白浓度,采用8%~15%胶上样30~40 mg蛋白,聚丙烯酰氨凝胶电泳,转至PVDF膜2 h,5%牛血清白蛋白室温封闭1 h,4 ℃ Ⅰ抗孵育过夜,Beclin-1以β-actin为内参照, LC3蛋白转化以LC3-Ⅱ/LC3-Ⅰ比值参考,洗涤后Ⅱ抗室温孵育1 h,再次洗涤后使用增强型化学发光显色试剂显影,胶片(柯达)曝光,胶片图像扫描后通过ImageJ图像软件分析统计。
3统计学处理
结 果
1缺氧复氧心肌细胞下调miR-30a表达
实时定量PCR检测结果显示原代心肌细胞单纯缺氧复氧后miR-30a水平是正常培养心肌细胞的(25.4±0.7) %,P<0.05,见图1;这表明缺氧复氧下调心肌细胞miR-30a表达。


图1缺氧复氧后心肌细胞miR-30a的表达
2慢病毒miR-30a转染心肌细胞后上调miR-30a,抑制心肌细胞Beclin-1蛋白表达
重组慢病毒感染心肌细胞后,荧光显微镜检测含GFP绿色荧光原代心肌细胞超过80%,见图2。实时定量PCR检测结果显示,与单纯LV-GFP组比较,LV-GFP-miR-30a组miR-30a上调(31.58±4.93)倍,P<0.05,见图2。这说明LV-GFP-miR-30a转染可以有效上调miR-30a表达。而通过Western blotting检测,与单纯LV-GFP组(0.30±0.10)比较,LV-GFP-miR-30a组显著下调Beclin-1蛋白(0.07±0.04),P<0.05,见图3。

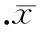
图2慢病毒感染心肌细胞后GFP和miR-30a的表达
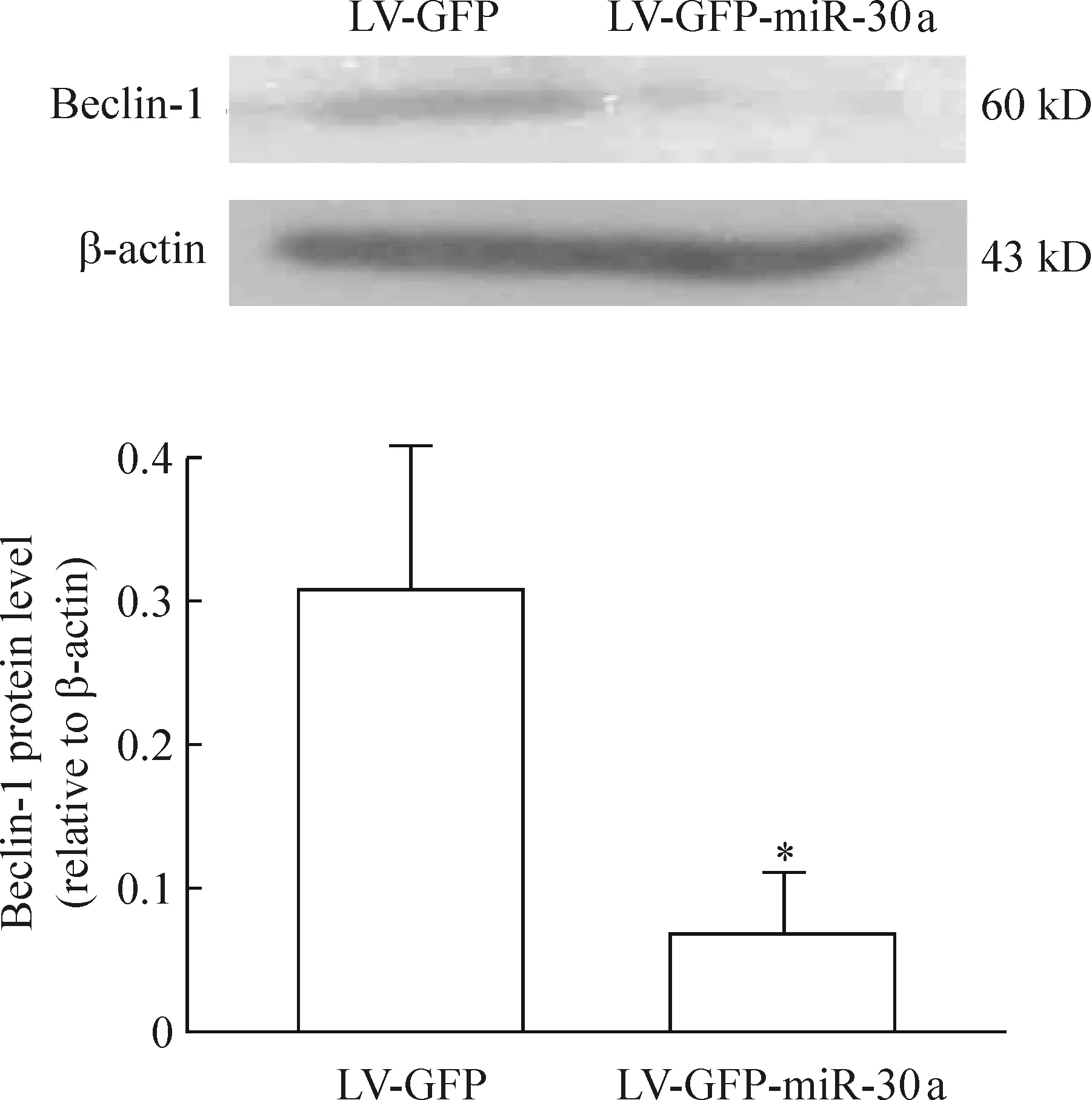
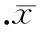
图3慢病毒miR-30a感染心肌细胞后Beclin-1蛋白的表达
3缺氧复氧后心肌细胞Beclin-1和LC3的表达变化
原代心肌细胞感染和药物处理后行缺氧复氧损伤,通过Western blotting 检测各组Beclin-1表达差异,相比单纯缺氧复氧组和LV-GFP加缺氧复氧组,LV-GFP-miR-30a加缺氧复氧组和3-MA加缺氧复氧组均下调Beclin-1(P<0.05),见图4。 LC3-Ⅰ转化为LC3-Ⅱ是自噬标志过程。比较各组LC3-Ⅱ表达差异发现,相比LV-GFP加缺氧复氧组,LV-GFP-miR-30a加缺氧复氧组和3-MA加缺氧复氧组明显减少LC3-Ⅰ转化为LC3-Ⅱ(P<0.05),见图5。

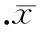
图4缺氧复氧后各组Beclin-1蛋白的表达
4miR-30a可以抑制缺氧复氧后细胞死亡
缺氧处理心肌进行TUNEL显色法细胞凋亡检测发现,相比单纯缺氧复氧组(57.7%±6.7%)和 LV-GFP加缺氧复氧组(65.5%±7.2%),LV-GFP-miR-30a加缺氧复氧组(36.5%±3.1%)和3-MA加缺氧复氧组(41.6%±3.1%)均明显减少凋亡(P<0.05),见图6。各组原代心肌细胞缺氧复氧后直接进行PI染色,PI穿过破损细胞膜染红细胞核,所以红染细胞代表晚期细胞凋亡和其它死亡类型细胞,见图7。我们观察到在LV-GFP-miR-30a加缺氧复氧组和3-MA加缺氧复氧组红染明显少于缺氧复氧组和LV-GFP加缺氧复氧组。由于原代心肌形态特殊性,还无法进行定量。

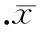
图5缺氧复氧后各组LC3蛋白的表达
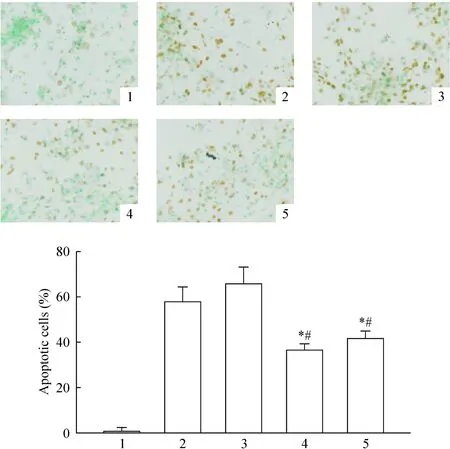

图6缺氧复氧后各组心肌细胞凋亡情况

Figure 7. Cell death after H/R (PI staining,×60).1: normal group; 2: H/R group; 3: LV-GFP plus H/R group; 4: LV-GFP-miR-30a plus H/R group; 5: 3-MA plus H/R group.
图7缺氧复氧后各组细胞PI染色情况

Figure 8. Potential mechanism of miR-30a action.
图8miR-30a在缺血再灌注损伤中的潜在机制
讨 论
自噬是细胞的代谢机制,被认为与神经退变、肿瘤发生、老化、糖尿病等疾病密切相关。文献报道miR-30a调控多株人肿瘤细胞的Beclin-1基因,下调经典的自噬过程,参与调控肿瘤细胞代谢过程[4]。miR-30a表达增加也被认为与肿瘤疾病诊断预后有密切关系[5-6]。最新研究提示老化干细胞出现miR-30a表达下降,也提示Beclin-1可能参与干细胞老化过程[7]。
在心脏,自噬也是新陈代谢和应急供能的主要细胞机制,自噬体系缺乏或突变,往往导致各种心肌病和心肌肥大[8-9],而且人心衰时miR-30a也下调明显[10]。心肌缺血再灌注过程中,缺氧阶段启动低程度自噬被认为是应急供能而保护心肌,这一过程表现以激活AMPKa为主导的自噬,而再灌注阶段通过激活JNK导致过表达Beclin-1,而大量激发自噬导致降解过度,加重心肌损伤[11]。而在缺血性心肌病患者发现心肌miR-30a水平明显下调[12],我们在缺氧复氧后心肌细胞中也发现miR-30a下调,推测其与再灌注中Beclin-1表达增加可能存在因果关系;而且我们在乳鼠心肌细胞中发现过表达miR-30a心肌在生理条件和缺氧复氧条件下都有Beclin-1蛋白下调,进一步验证了miR-30a和Beclin-1靶向关系。由于miR-30a具有高度生物保守性,在多个物种人、大鼠、小鼠表达相同,而且在上述物种的Beclin-1基因上均有相同靶序列,所以在大鼠上的实验结果对于人类缺血性心脏疾病更具有重要指导意义,见图8。
同样作为程序性死亡方式,自噬和凋亡间也存在拮抗和协同关系。一方面,低自噬水平激活作为保护机制,清除有害物质,减少细胞凋亡;大量自噬导致细胞自我消化的自噬性死亡。凋亡启动过程中激活的caspases可以剪切自噬基Beclin-1,剪切后形成的C端Beclin-1(Beclin-1C)可以结合线粒体,并促进细胞色素C(cytochrome C, Cyt C)释放,导致细胞凋亡[13]。多个研究均发现自噬蛋白被凋亡相关基因剪切促进凋亡[14]。另一方面,生理条件下抗凋亡蛋白Bcl-2结合Beclin-1,抑制Beclin-1自噬活性;缺血再灌注阶段,激活的JNK促进Bcl-2磷酸化,而释放Bcl-2结合的Beclin-1,这也可能是再灌注期Beclin-1主导自噬增加的原因[15]。我们实验发现过表达miR-30a可下调Beclin-1,既减少自噬上游蛋白表达,阻断过度自噬流,又减少诱发凋亡的Beclin-1C形成,可能同时减少2种类型的细胞程序性死亡。通过自噬阻断剂3-MA阻断过度自噬流也可以减少缺氧复氧导致的细胞死亡,也提示Beclin-1参与的自噬诱导缺氧复氧心肌细胞死亡,其可能机制见图8。使用PI染色发现miR-30a组缺氧复氧后染色较少,PI染色包括各种膜通透性改变死亡方式,包括晚期凋亡和坏死。最近文献也认为自噬体晚期成熟障碍加重心肌坏死[16],但一般自噬流下游自噬体降解阻断是主要原因,而我们的实验结果认为减少自噬上游自噬体过度表达可以有效减少坏死。
近年来,心肌缺血再灌注损伤中miRNA调控机制一直是研究热点,miRNA通过结合互补mRNA,沉默或者降解mRNA。而miR-30a在心肌的这种转录后修饰调控Beclin-1被认为是一种迅速而高效的瞬间调控方式,对于缺血心肌病的诊疗有重要意义。但是还要考虑到miRNA可能的“一箭多靶”效应,我们对于miR-30a在心肌缺血中的保护作用还需深入研究其它靶基因的作用。
[1] 魏 聪,胡 兵, 申 锷. MicroRNAs在心脏发育和疾病中的作用[J]. 中国病理生理杂志, 2011,27(3):611-615.
[2] Koyama T, Temma K, Akera T. Reperfusion-induced contracture develops with a decreasing [Ca2+]iin single heart cells[J]. Am J Physiol, 1991,261(4 Pt 2):H1115-H1122.
[3] 刘 丹, 何 明, 易 波, 等. p38 MAPK-Pim-3通路可能介导预处理对抗心肌细胞缺氧/复氧损伤[J]. 中国病理生理杂志, 2009,25(10):1912-1916.
[4] Zhu H, Wu H, Liu X, et al. Regulation of autophagy by a beclin 1-targeted microRNA, miR-30a, in cancer cells[J]. Autophagy, 2009,5(6):816-823.
[5] Jukic DM, Rao UN, Kelly L, et al. MicroRNA profiling analysis of differences between the melanoma of young adults and older adults[J]. J Transl Med, 2010,8:27.
[6] Baffa R, Fassan M, Volinia S, et al. MicroRNA expression profiling of human metastatic cancers identifies cancer gene targets[J]. J Pathol, 2009,219(2):214-221.
[7] Lee S, Jung JW, Park SB, et al. Histone deacetylase regulates high mobility group A2-targeting microRNAs in human cord blood-derived multipotent stem cell aging[J]. Cell Mol Life Sci, 2011,68(2):325-336.
[8] Tanaka Y, Guhde G, Suter A, et al. Accumulation of autophagic vacuoles and cardiomyopathy in LAMP-2-deficient mice[J]. Nature, 2000,406(6798):902-906.
[9] Shende P, Plaisance I, Morandi C, et al. Cardiac raptor ablation impairs adaptive hypertrophy, alters metabolic gene expression, and causes heart failure in mice[J]. Circulation, 2011,123(10):1073-1082.
[10]Thum T, Galuppo P, Wolf C, et al. MicroRNAs in the human heart: a clue to fetal gene reprogramming in heart failure[J]. Circulation, 2007,116(3):258-267.
[11]Matsui Y, Takagi H, Qu X, et al. Distinct roles of autophagy in the heart during ischemia and reperfusion: roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J]. Circ Res, 2007,100(6):914-922.
[12]Ikeda S, Kong SW, Lu J, et al. Altered microRNA expression in human heart disease[J]. Physiol Genomics, 2007,31(3):367-373.
[13]Wirawan E, Vande WL, Kersse K, et al. Caspase-mediated cleavage of Beclin-1 inactivates Beclin-1-induced autophagy and enhances apoptosis by promoting the release of proapoptotic factors from mitochondria[J]. Cell Death Dis, 2010,1:e18.
[14]Norman JM, Cohen GM, Bampton ET. Theinvitrocleavage of the hAtg proteins by cell death proteases[J]. Autophagy, 2010,6(8):1042-1056.
[15]He C, Levine B. The Beclin 1 interactome[J]. Curr Opin Cell Biol, 2010,22(2):140-149.
[16]Su H, Li F, Ranek MJ, et al. COP9 signalosome regulates autophagosome maturation[J]. Circulation, 2011,124(19):2117-2128.
ProctectiveeffectofmicroRNA-30aonregulatingbeclin-1expressioninhypoxia-reoxygenatedneonatalratcardiomyocytes
YAN Hao1, XU Jian-jun1, LI Wen-lin2, ZHU Shu-qiang1, LONG Xiang1, CHE Jian-peng1, CHEN Li-ru1
(1DepartmentofCardiacSurgery,TheSecondAffiliatedHospital,2MedicalCollege,NanchangUniversity,Nanchang330006,China.E-mail:xujianjun3526@163.com)
AIM: To explore the potential mechanism of microRNA-30a (miR-30a) overexpression in neonatal rat cardiomyocytes during hypoxia/reoxygenation (H/R).METHODSThe miR-30a overexpression was induced in primary neonatal rat cardiomyocytes by lentivirus transfection. The cardiomyocytes were divided into 5 groups: normal group, H/R group, LV-GFP+H/R group, LV-GFP-miR-30a+H/R group and 3-methyladenine(3-MA)+H/R group. The expression level of miR-30a after lentivirus transfection and H/R was determined by real-time PCR, while the protein levels of LC3 and Beclin-1 after H/R and lentivirus transfection were detected by Western blotting. The cardiomyocyte death after H/R were measured by TUNEL and PI staining.RESULTSCompared with LV-GFP group, significant down-regulation of Beclin-1 protein level was observed in cardiomyocytes with miR-30a overexpression, while the protein levels of Beclin-1 and LC3 in the cardiomyocytes with miR-30a overexpression were down-regulated after H/R, and apoptosis of these cells were significantly decreased after H/R.CONCLUSIONThe protein level of Beclin-1 is down-regulated in cardiomyocytes with miR-30a overexpression. Inhibition of autophagy decreases the cardiomyocyte death after H/R.
Ischemia-reperfusion; Apoptosis; MicroRNA; Autophagy
R363
A
10.3969/j.issn.1000-4718.2012.04.002

