自噬在熊果酸诱导的人脐静脉内皮细胞损伤中的作用*
毕娟娟, 何 林, 余 音, 郭 倩, 叶秀峰,2△
(重庆医科大学 1神经科学研究中心,2病理教研室,重庆 400016)
1000-4718(2012)04-0601-07
2011-11-18
2012-02-21
重庆市教委科技研究项目基金资助项目(No.KJ08032);重庆市科技攻关计划项目(No.CSCT,2008AB5118)
△通讯作者 Tel:023-68485789; E-mail:Yxf1960@126.com
自噬在熊果酸诱导的人脐静脉内皮细胞损伤中的作用*
毕娟娟1, 何 林1, 余 音1, 郭 倩1, 叶秀峰1,2△
(重庆医科大学1神经科学研究中心,2病理教研室,重庆 400016)
目的研究自噬在熊果酸诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤中的作用。方法体外培养HUVECs,运用不同浓度的熊果酸处理36 h,采用MTT法检测HUVECs增殖率的变化;透射电镜观察细胞超微结构的改变;单丹磺酰尸胺(MDC)荧光染色观察熊果酸对HUVECs自噬表达水平的影响;Western blotting检测微管相关蛋白轻链3(microtubule-associated protein light chain 3, LC3)及自噬相关蛋白Beclin-1的变化;RT-PCR检测LC3及Beclin-1 mRNA的变化;流式细胞术检测自噬抑制剂3-甲基腺嘌呤(3-methyladenine, 3-MA)抑制自噬前后经熊果酸处理的HUVECs凋亡率的变化。结果熊果酸抑制HUVECs增殖并呈剂量依赖性;熊果酸可诱导HUVECs产生自噬:透射电镜和MDC染色均显示HUVECs经熊果酸处理后自噬囊泡明显增加且自噬在基因及蛋白水平的表达均增加;3-MA与熊果酸联合作用于HUVECs时抑制了熊果酸诱导的HUVECs自噬空泡的积聚并且可明显促进HUVECs凋亡。结论熊果酸抑制HUVECs增殖,并诱导其发生自噬,自噬在此过程中对HUVECs起保护作用。自噬抑制剂3-MA能够增强熊果酸诱导的HUVECs的增殖抑制作用并且促进HUVECs发生凋亡。
熊果酸; 内皮细胞; 自吞噬作用; 细胞凋亡
病理性血管生成具有持续性、无控性,其在肿瘤的演化过程中起着重要的作用。肿瘤新生血管对其提供氧气及营养物质则作为肿瘤侵袭转移的首要步骤,因此,目前治疗肿瘤的焦点已汇集于抑制肿瘤血管生成[1]。
自噬是广泛存在于真核细胞内的一种溶酶体依赖性的降解途径。众多研究表明自噬在疾病发生及发展过程中具有促进和抑制的双重作用:自噬能够在饥饿及外界刺激下回收大分子以及清除受损的线粒体及其它细胞器,为细胞提供能量及蛋白质实现再循环以维持细胞生存。然而,自噬也可以引起细胞生长阻滞,以及一种与过量自噬空泡形成有关的自噬性细胞死亡[2]。
熊果酸(ursolic acid,UA)又称乌索酸或乌苏酸,一种来源于传统中草药的提取物,属五环三萜类化合物。它广泛存在于自然界中,并具有多种生物学效应,比如抗肿瘤、抗血管生成、抗氧化、抗抑郁、保肝、降血脂、抗病毒及抗菌作用等,且毒副作用较小[3]。 Sohn 等[4]鸡胚胎绒毛膜实验(chicken chorioallantoicmembrane assays,CAM)研究显示,熊果酸可较强地抑制血管生成,但其作用机制目前尚未明确。我们之前研究表明熊果酸可通过抑制ERK信号通路抑制血管内皮细胞增殖[5]。目前,关于自噬在熊果酸诱导血管内皮细胞损伤中的作用报道较少,本文利用自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)协同作用,初步探讨自噬在熊果酸诱导内皮细胞损伤中的作用。
材 料 和 方 法
1细胞
人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)株由重庆医科大学病理教研室提供。
2主要试剂
熊果酸(纯度>98%)购自陕西旭煌植物科技发展有限公司;DMEM/high glucose购自HyClone;小牛血清购自Gibco;3-MA、单丹磺酰尸胺(monodansylcadaverine,MDC)、Western Blotting Luminol Reagent和兔抗人微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)多克隆抗体购自Sigma;MTT购自北京鼎国昌盛生物技术有限责任公司;PRO-PREPTM蛋白提取液购自北京赛百盛基因技术有限公司;Bradford蛋白质定量试剂盒购自上海生工生物工程技术服务有限公司;兔抗人Beclin-1多克隆抗体购自Santa Cruz;小鼠抗人β-actin、HRP标记的山羊抗兔IgG和山羊抗鼠IgG购自北京中杉金桥生物技术有限公司;DNA marker 购自Bioflux;RNA提取试剂盒购自TaKaRa;逆转录试剂盒购自北京百泰克生物技术有限公司;Taq酶购自SinoBio。
3细胞培养
HUVECs置于含15%小牛血清的DMEM/high glucose培养液中,于37 ℃、5%CO2培养箱中常规培养,取处于对数生长期的细胞进行实验。
4MTT法检测熊果酸对HUVECs增殖的影响
取对数生长期的HUVECs,以5 000 cells/well的密度接种于96 孔板,每孔加200 μL培养基,于孵箱中培养24 h,将细胞分为熊果酸组(分别加入5、10、20、40、80 μmol/L熊果酸);3-MA+熊果酸处理组(先用2 mmol/L 3-MA预处理细胞,1 h后加入不同浓度熊果酸);溶剂对照组(只加相应浓度DMSO不加熊果酸)和空白调零组(只含培养液,无细胞),每组设5 个复孔,重复3 次。作用36 h后,每孔加入MTT(5 g/ L)20 μL,继续培养4 h,弃去孔内液体,每孔加入150 μL DMSO,振荡10 min,酶联免疫测定仪选择波长570 nm空白孔调零,测定各孔吸光度(A)值并计算细胞增殖抑制率和半数抑制浓度(IC50)。细胞增殖抑制率(%)=[ (溶剂对照组A值-处理组A值)/溶剂对照组A值] ×100 %。
5透射电镜法检测熊果酸对HUVECs细胞超微结构的影响
取对数生长期HUVECs,以每瓶5×105的密度接种于100 mL培养瓶中,每瓶加5 mL培养液。熊果酸(20 μmol/L)给药 36 h后常规收集细胞,正常对照组用完全培养基培养36 h。PBS离心洗涤1次,1 000 r/min离心10 min, 4%戊二醛固定,于 4 ℃保存,送重庆医科大学生命科学院电镜室固定、切片、摄片。
6MDC荧光染色检测细胞内自噬空泡的变化
MDC是自噬空泡的标志物,通过MDC染色可以观察判断细胞自噬过程的发生[6]。取对数生长期HUVECs,以2×104/well的密度接种于已放置小盖玻片的24孔板中,每孔加1 mL培养液,培养24 h后加入终浓度为20 μmol/L熊果酸,另设3-MA(2 mmol/L)+熊果酸(20 μmol/L)处理组和正常对照组。置37 ℃、5% CO2细胞培养箱中继续培养。36 h后加入终浓度50 μmol/L MDC,37 ℃孵育60 min,PBS液漂洗5 min×3次。4%多聚甲醛室温固定细胞15 min,PBS液漂洗5 min×3次,荧光显微镜观察细胞自噬空泡的变化并统计荧光染色阳性细胞百分比。
7Westernblotting检测LC3和Beclin-1蛋白的表达
取对数生长期的HUVECs以每瓶5×105的密度接种于100 mL培养瓶中,每瓶加5 mL培养液,24 h后按如下分组进行处理: 20 μmol/L熊果酸分别处理0、12、24、36、48 h。取各组细胞,提取总蛋白,Bradford法测定蛋白浓度。经SDS-PAGE分离后,将蛋白转移至PVDF膜上,5 kg/L脱脂奶粉37℃封闭1 h;加入5%脱脂奶粉稀释的兔抗人LC3(1∶1 000 稀释)或兔抗人Beclin-1(1∶200稀释)多克隆抗体或小鼠抗人β-actin 单克隆抗体(1∶500 稀释),4 ℃孵育过夜;TBST 洗膜后,加入5%脱脂奶粉稀释、HRP标记的山羊抗兔或山羊抗鼠IgG(1∶1 000 稀释),37 ℃孵育2 h;ECL显色,采用ChemiDocXRS化学发光成像系统进行曝光采图。用Quantity One 4.6.2 软件分析,比较条带的面积和灰度值,以β-actin为内参照,进行半定量。
8RT-PCR检测自噬相关蛋白LC3和Beclin-1mRNA的表达
8.1分组 取对数生长期的HUVECs以每瓶5×105的密度接种于100 mL培养瓶中,每瓶加5 mL培养液,24 h后按如下分组进行处理:(1)20 μmol/L熊果酸分别处理0、12、24、36、48 h;(2)熊果酸(20 μmol/L)组、3-MA(2 mmol/L)+熊果酸(20 μmol/L)组和正常对照组(正常培养细胞)。
8.2引物设计及合成 根据Gene中登录的LC3及Beclin-1序列设计引物:LC3上游引物5′-TCCCACACCAAGTGCATGTCAG-3′,下游引物 5′-GCCAAGTGGACAGACGCATGC-3′,扩增片段长度为390 bp;Beclin-1上游5′-GGTGGCTTTCCTGGACTGTGTGC-3′,下游引物5′-TCAAAACTGACCAGGGCTGGCA-3′,扩增片段长度为465 bp;内参照β-actin 上游引物5′-CCGCCAGCTCACCATGGATGAT-3′,下游引物5′-TCTCTTGCTCTGGGCCTCTG-3′,扩增片段长度为199 bp,由北京赛百盛公司合成。
8.3细胞总RNA 的提取 取各组细胞,PBS洗涤2次后加入Trizol提取液,以氯仿/异丙醇法抽提各组细胞总RNA,测定A260/A280比值。
8.4RT-PCR 以提取的细胞总RNA为模板,进行逆转录,以逆转录产物为模板进行PCR扩增,以β-actin作为内参照。反应体系:Taq酶12.5 μL、上、下游引物各1 μL ,cDNA2.5 μL,用灭菌蒸馏水补足体积至25 μL。LC3反应条件:94 ℃ 3 min,94 ℃ 30 s,56 ℃ 45 s,72 ℃ 45 s,共35 个循环,72 ℃ 5 min。Beclin-1反应条件:94 ℃ 3 min,94 ℃ 30 s,56 ℃ 45 s,72 ℃ 45 s,共35 个循环,72 ℃ 5 min。PCR产物经2%琼脂糖凝胶电泳鉴定并计算LC3、Beclin-1 mRNA/β-actin吸光度值。
9流式细胞术检测细胞凋亡率
取对数生长期HUVECs,以每瓶5×105的密度接种于100 mL培养瓶中,每瓶加5 mL培养液。培养24 h后加入20 μmol/L熊果酸,另设3-MA(2 mmol/L) +熊果酸(20 μmol/L)处理组、正常对照组。继续培养36 h后常规收集细胞, PBS液冲洗,1 000 r/min离心5 min×3次。送重庆医科大学生命科学院annexin V-FITC和PI染色后流式细胞仪检测细胞凋亡率。
10统计学处理
结 果
1熊果酸对HUVECs增殖的影响
不同浓度熊果酸(5、10、20、40、80 μmol/L)作用HUVECs 36 h后均有抑制作用,且呈明显的剂量依赖性,不同浓度与对照组(0 μmol/L)之间的抑制率差异均有统计学意义(P<0.05),熊果酸处理HUVECs 36 h的IC50为20 μmol/L,以下相关实验选用的药物浓度为20 μmol/L,见图1。
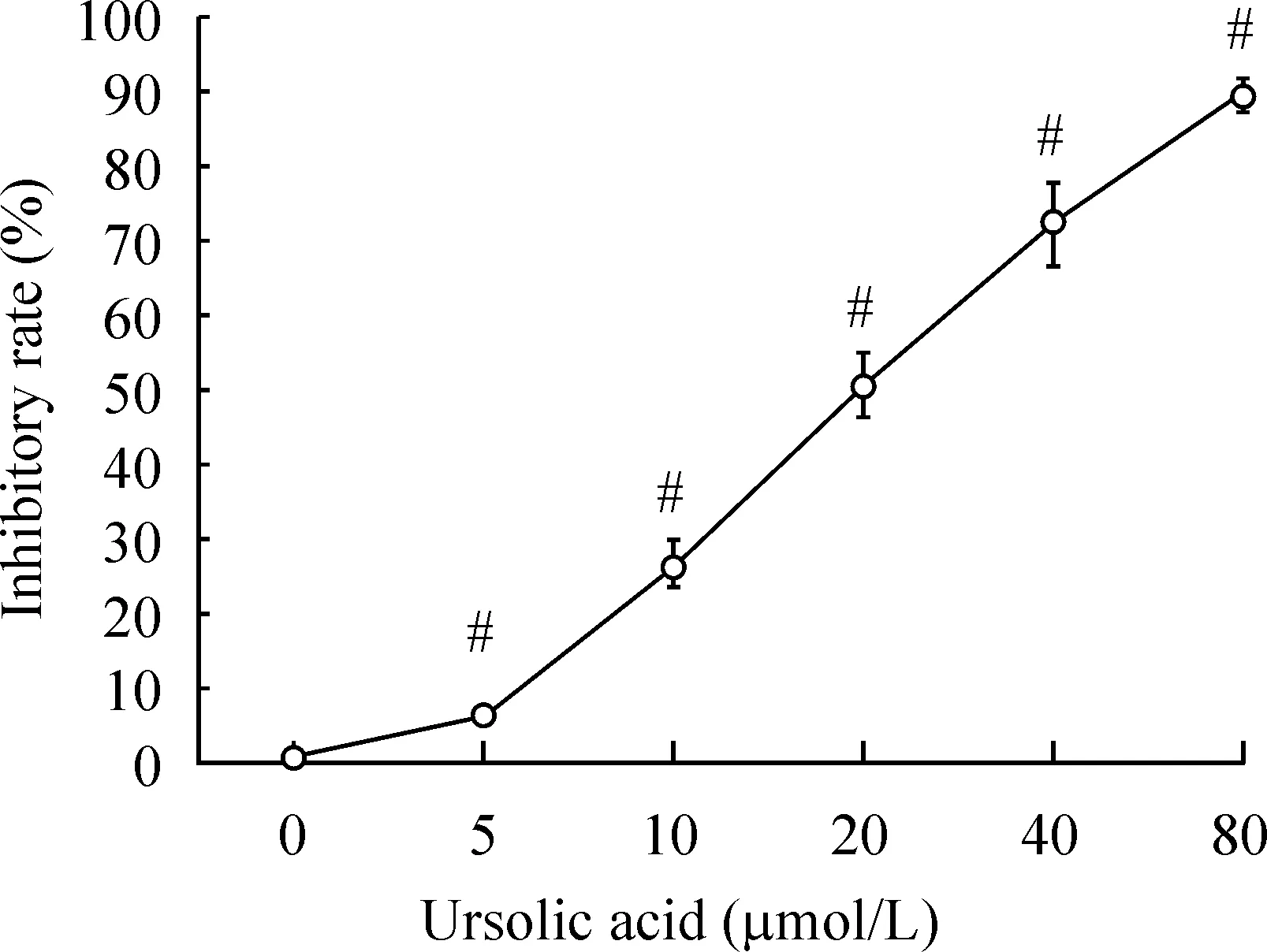
图1不同浓度熊果酸对HUVECs增殖的抑制率
2熊果酸可诱导HUVECs产生自噬
2.1透射电镜观察熊果酸对HUVECs超微结构的影响 正常对照组细胞核膜完整,染色质结构正常,胞浆内各细胞器、细胞核形态和分布基本正常,未见明显自噬空泡,溶酶体数目未见明显增多。熊果酸(20 μmol/L)处理36 h后胞浆中可见大量空泡状结构及包含部分胞浆成分形成双层膜结构的自噬体,表明熊果酸可诱导HUVECs发生自噬,见图2。
2.2Western blotting检测LC3和Beclin-1蛋白表达情况 20 μmol/L熊果酸处理HUVECs后,结果显示:随着作用时间的延长LC3Ⅱ/LC3Ⅰ逐渐增高,除48 h外各时间组与对照组之间差异有统计学意义(P<0.05);随着作用时间的延长Beclin-1蛋白表达增高,除12 h外各时间组与对照组之间差异有统计学意义(P<0.05),见图3。
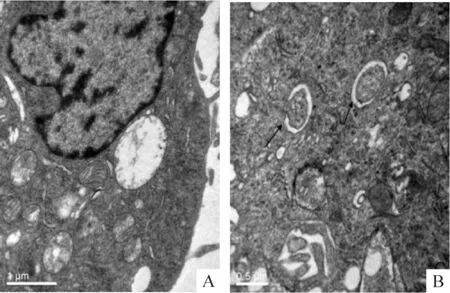
Figure 2. The effect of ursolic acid (UA) on ultrastructure of HUVECs. A:control; B: UA.
图2熊果酸对HUVECs细胞超微结构的影响
2.3RT-PCR检测LC3和Beclin-1 mRNA表达情况 20 μmol/L熊果酸处理HUVECs后,结果显示:随着作用时间的延长LC3 mRNA表达逐渐增高,于36 h达高峰,各时间组与对照组之间差异有统计学意义(P<0.05);随着作用时间的延长Beclin-1 mRNA表达增高,除12 h组外,各时间组与对照组之间差异有统计学意义(P<0.05),见图4。
3抑制自噬增强了熊果酸对HUVECs的增殖抑制作用
3.1MDC荧光染色检测细胞内自噬空泡的变化 MDC染色结果显示单独应用熊果酸作用于HUVECs时,细胞内出现明显自噬空泡积聚,阳性细胞率为(67.12±2.85)%,与正常对照组阳性细胞率[(5.37±1.34)%]相比有明显差异,表明有自噬发生;熊果酸与3-MA联合作用(24.07±0.60)%时,自噬空泡明显减少但仍高于正常对照组,表明自噬被抑制,见图5。
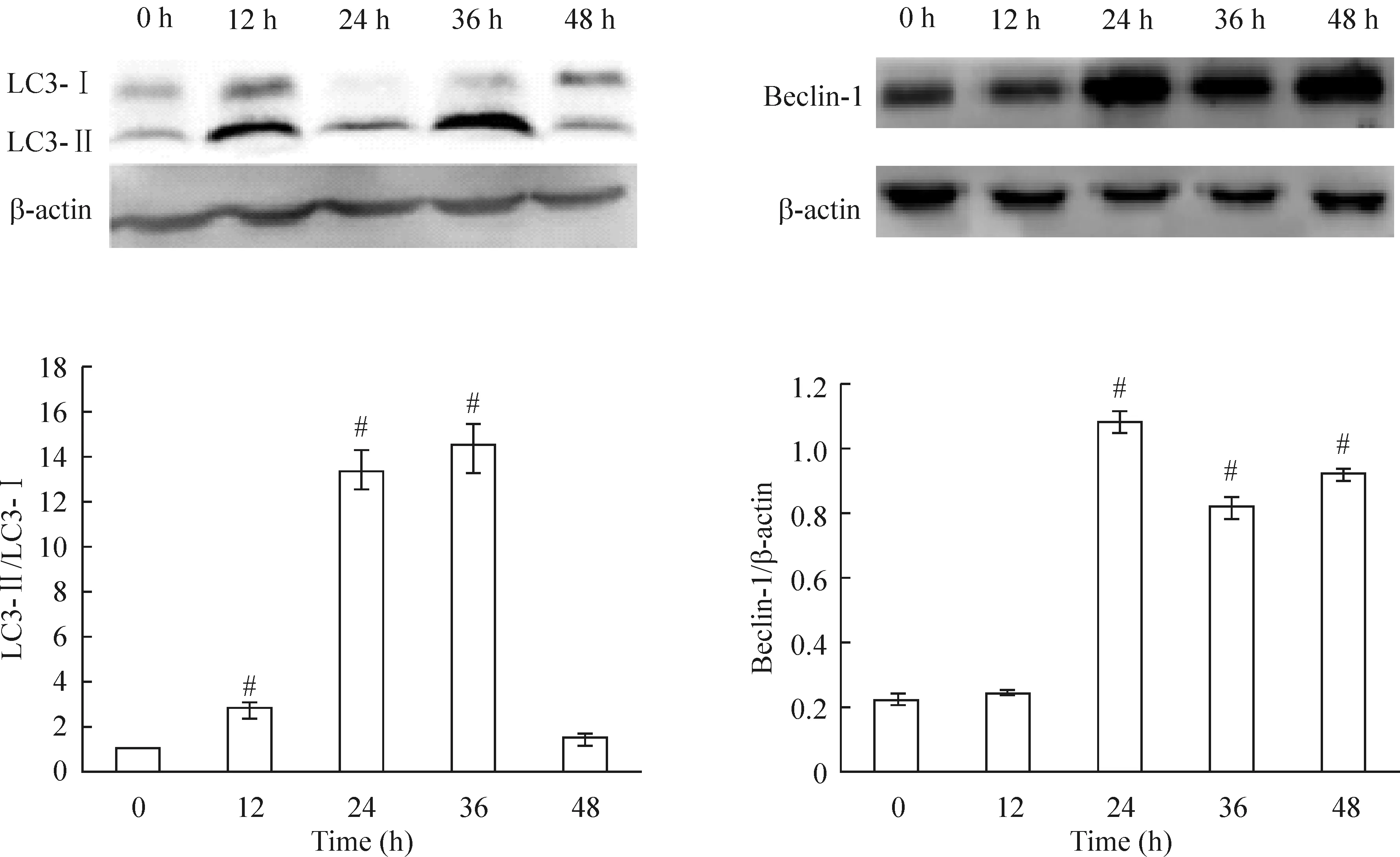

图320μmol/L熊果酸处理不同时间HUVECs中LC3及Beclin-1蛋白的表达
3.2RT-PCR检测3-MA对熊果酸诱导的HUVECs LC3和Beclin-1 mRNA表达的影响 20 μmol/L熊果酸单独处理或2 mmol/L 3-MA与20 μmol/L熊果酸联合处理的HUVECs中, LC3和Beclin-1 mRNA的转录水平明显高于正常对照组,其中熊果酸单独处理组高于3-MA与熊果酸联合处理组,差异显著(P<0.05),见图6。
3.33-MA对熊果酸抑制HUVECs增殖的影响 MTT结果显示:熊果酸单独作用HUVECs或3-MA与熊果酸联合作用对细胞增殖均有抑制作用,后者抑制作用更为显著,其细胞存活率差异显著(P<0.05);3-MA 与对照组相比,差异没有统计学意义,见图7。
4抑制自噬能促进熊果酸诱导的HUVECs凋亡的发生
与正常对照组[细胞凋亡率(3.34±0.32)%]相比,熊果酸单独作用HUVECs 36 h,细胞凋亡率增加[ (5.21±0.22)%];3-MA和熊果酸联合作用时与单独应用熊果酸组相比,细胞凋亡率明显增加[(12.7±0.56)%],见图8。


图420μmol/L熊果酸处理不同时间HUVECs中LC3及Beclin-1mRNA的表达


图5MDC染色检测熊果酸和3-MA作用36hHUVECs自噬空泡的变化
讨 论
肿瘤血管生成是导致肿瘤侵袭、转移的重要因素。近年来通过抑制肿瘤血管生成进而抑制肿瘤生长和转移已成为肿瘤研究的热点。传统抗肿瘤血管生成主要是通过抑制血管生成因子的产生、抑制配基与受体相互作用而抑制血管生成因子的活性、选择性拮抗剂直接作用于血管生长因子受体,调节受体在内皮细胞上的表达水平或者引入野生型受体与负性非功能受体与之竞争、抑制内皮细胞增殖、迁移及分化成新生血管的能力、抑制或者中和具有降解基底膜和细胞外基质酶的活性[7]。但由于大多数抗血管生成药物具有不稳定性、毒性较大且价格昂贵 ,因此临床应用受到限制。熊果酸作为一种高效低毒的天然药物,可抑制多种肿瘤细胞的生长,具有广阔应用前景,有望成为一种新型抗肿瘤药物[8-9]。已有报道熊果酸可通过多种途径抑制血管内皮细胞增殖[10-11]。
自噬在疾病进展中的角色随疾病病程不断发生变化,细胞受到外界刺激发生自噬时,胞浆内出现大量游离的膜性结构,逐渐包绕受损伤细胞器和部分胞浆形成自噬体,之后再与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢。自噬在很多情况下都可以被激活,当营养缺乏或者各种生存条件不足时细胞可通过自噬降解细胞内物质为细胞提供营养及能量实现再循环。因此,从这个意义上讲自噬是细胞面对不良刺激时所发生的一种防御行为[12]。然而,自噬具有两面性,一方面可通过降解有害物质保护细胞以避免坏死和凋亡的危险,而过度的激活则会通过降解细胞器导致细胞死亡。研究表明:自噬在氧化低密度脂蛋白诱导内皮细胞损伤中起一定的保护作用,抑制自噬会促进内皮细胞发生凋亡,对细胞产生损伤作用[13];另有研究报道抑制自噬可促进Nara-H细胞发生凋亡[14]。熊果酸诱导内皮细胞损伤过程中是否诱导自噬的发生,自噬在此过程中起保护作用还是抑制作用则成为本课题研究的重点。


图63-MA对熊果酸诱导的LC3和Beclin-1mRNA表达的影响


图73-MA对熊果酸诱导的HUVECs细胞生存率的影响
本研究通过MTT检测证明熊果酸对HUVECs具有细胞毒作用,并呈明显的剂量依赖性;透射电镜下观察到经熊果酸处理的HUVECs胞浆中可见明显的自噬体及自噬溶酶体,与文献中描述的自噬过程出现的空泡一致[15]。Atg为自噬相关蛋白,LC3为Atg8在哺乳动物中的同源体。Atg12结合过程和LC3修饰过程在哺乳动物自噬泡形成过程中起着重要的作用。Atg12结合过程参与前自噬泡的形成,LC3具有2种形式:LC3-I 和LC3-II。LC3前体形成后,在 Atg7 的催化作用下发生一系列反应:首先加工成胞浆可溶性形式的 LC3-I,随后,LC3-I 被活化并转运至 Atg3,并被修饰成膜结合形式的LC3-II。LC3-II定位于前自噬体和自噬体,其为自噬体的标志分子。一旦自噬体与溶酶体融合,自噬体内的LC3- II便被溶酶体中的水解酶降解。 LC3-II含量或 LC3-II/LC3-I 的比值与自噬泡的数量呈正相关[16]。因此,通过检测细胞内LC3-II 的含量变化,可以基本判断是否发生自噬及其自噬是被诱导还是被抑制。本实验Western blotting显示熊果酸处理HUVECs后与对照组相比, LC3-II/LC3-I 的比值明显增加。同时,RT-PCR检测显示HUVECs经熊果酸处理后与对照组相比LC3 mRNA表达明显增多。则从另一个角度说明熊果酸在抑制内皮细胞增殖的过程中诱导自噬的发生。MDC荧光染色发现单纯熊果酸作用于HUVECs后细胞内出现大量自噬空泡积聚,而自噬特异性抑制剂3-MA与熊果酸联合作用后细胞内自噬空泡明显减少,明显抑制了自噬的发生。我们同时经RT-PCR证实了这一点。研究发现:3-MA能够一定程度地抑制H2O2诱导的U251细胞发生自噬并且促进其发生凋亡[17]。本实验也证实了这一点,我们通过MDC、RT-PCR、检测发现3-MA与熊果酸联合作用组自噬相关基因表达较熊果酸单独处理组明显降低,同时MTT法检测显示抑制自噬后熊果酸诱导的HUVECs增殖抑制明显增强;且抑制自噬可以促进熊果酸诱导的HUVECs发生凋亡。
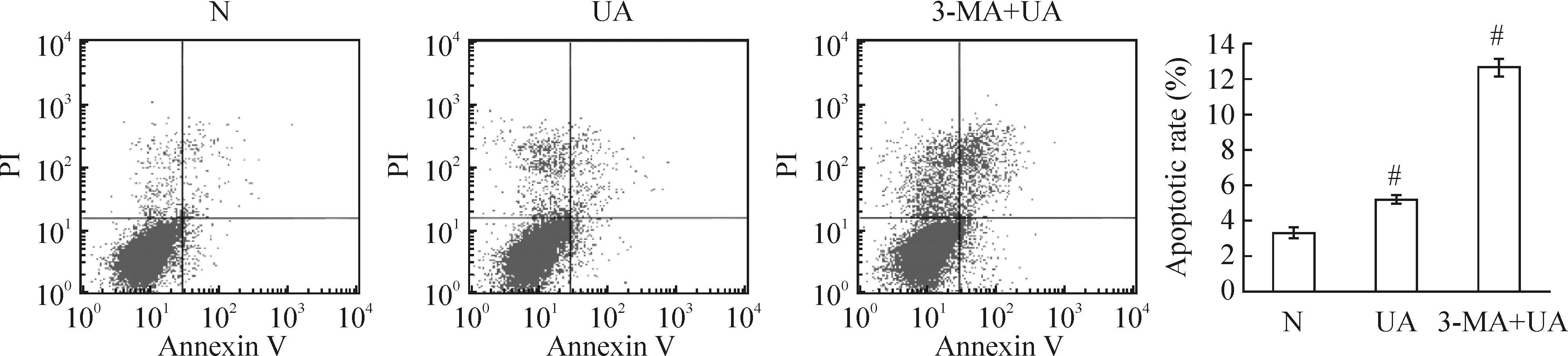
图83-MA对熊果酸诱导的HUVECs凋亡的影响
综上所述,熊果酸在抑制HUVECs增殖过程中可诱导自噬的发生,自噬在此过程中对HUVECs起保护作用。抑制自噬,可增强熊果酸对HUVECs的抑制作用且促进HUVECs发生凋亡。
[1] Kunimasa K, Ohta T, Tani H ,et al.Resveratrol derivative-rich melinjo(GnetumgnemonL.) seed extract suppresses multiple angiogenesis-related endothelial cell functions and tumor angiogenesis[J]. Mol Nutr Food Res, 2011,55(11):1730-1734.
[2] Wu W,Wei W, Ablimit M,et al.Responses of two insect cell lines to starvation: autophagy prevents them from undergoing apoptosis and necrosis, respectively[J].J Insect Physiol, 2011, 57(6):723-734.
[3] Kuttan G, Pratheeshkumar P, Manu KA,et al. Inhibition of tumor progression by naturally occurring terpenoids[J]. Pharm Biol, 2011,49(10):995-1007.
[4] Sohn KH,Lee HY,Chung HY,et al.Anti-angiogenic activity of triterpene acid[J]. Cancer Lett,1995,94(2):213-218.
[5] 李 伟,刘 琼,何 林,等.熊果酸对血管内皮细胞增殖的影响及其机制[J].中国生物制品学杂志,2011, 24(2):157-162.
[7] Carmeliet P, Jain RK. Principles and mechanisms of vessel normalization for cancer and other angiogenic diseases[J]. Nat Rev Drug Discov,2011,10(6):417-427.
[8] Shan JZ, Xuan YY, Ruan SQ,et al. Proliferation-inhibiting and apoptosis-inducing effects of ursolic acid and oleanolic acid on multi-drug resistance cancer cellsinvitro[J]. Chin J Integr Med, 2011,17(8):607-611.
[9] Kim KH, Seo HS, Choi HS,et al. Induction of apoptotic cell death by ursolic acid through mitochondrial death pathway and extrinsic death receptor pathway in MDA-MB-231 cells[J]. Arch Pharm Res, 2011,34(8):1363-1372.
[10] Messner B, Zeller I, Ploner C,et al.Ursolic acid causes DNA-damage, P53-mediated, mitochondria- and caspase-dependent human endothelial cell apoptosis, and accelerates atherosclerotic plaque formationinvivo[J]. Atherosclerosis, 2011,219(2):402-408.
[11] Kanjoormana M, Kuttan G. Antiangiogenic activity of ursolic acid[J]. Integr Cancer Ther,2010 ,9(2):224-235.
[12] Tan ML, Ooi JP, Ismail N,et al. Programmed cell death pathways and current antitumor targets[J]. Biochem Biophys Res Commun,2010 ,394(3):760-766.
[13] Zhang YL,Cao YJ,Zhang X,et al.The autophagy-lysosome pathway: a novel mechanism involvedin the processing of oxidized LDL in human vascular endothelial cells[J]. Biochem Biophys Res Commun,2010,394(2):377-382.
[14] Nakamura O, Hitora T, Akisue T,et al.Inhibition of induced autophagy increases apoptosis of Nara-H cells[J]. Int J Oncol, 2011,39(6):1545-1552.
[15] Zeng R, He J, Peng J,et al. The time-dependent autophagy protects against apoptosis with possible involvement of Sirt1 protein in multiple myeloma under nutrient depletion[J]. Ann Hematol, 2012, 91(3):407-417.
[16] Chaachouay H, Ohneseit P, Toulany M,et al. Autophagy contributes to resistance of tumor cells to ionizing radiation[J]. Radiother Oncol, 2011,99(3):287-292.
[17] 孔晓霞,张宏宇,钟加滕,等. 自噬抑制剂3-甲基腺嘌呤在H2O2引起的神经胶质瘤U251细胞损伤中的作用[J].中国病理生理杂志, 2011,27(4):695-698.
Roleofautophagyinursolicacid-inducedinjuryofhumanumbilicalveinendothelialcells
BI Juan-juan1, HE Lin1, YU Yin1, GUO Qian1, YE Xiu-feng1,2
(1InstituteofNeuroscience,2DepartmentofPathology,ChongqingMedicalUniversity,Chongqing400016,China.E-mail:Yxf1960@126.com)
AIM: To investigate the role of autophagy in the injury of human umbilical vein endothelial cells (HUVECs) induced by ursolic acid (UA).METHODSHUVECs were culturedinvitrowith UA at various concentrations for 36 h and the proliferation inhibitory rate of HUVECs was determined by MTT method. The change of ultrastructure was observed under transmission electronic microscope (TEM). The autophagy was observed using fluorescent microscope by monodansylcadaverin (MDC) staining. The protein level and mRNA expression of microtubule-associated protein light chain 3(LC3) and Beclin-1 were detected by Western blotting and RT-PCR, respectively. Cell apoptotic rate was measured by flow cytometry analysis.RESULTSUA at various concentrations showed significantly dose-dependent inhibitory effect on the proliferation of HUVECs. Autophagy was induced in HUVECs treated with UA as detected by MDC staining and TEM. The protein level and mRNA expression of LC3 and Beclin-1 in HUVECs were significantly increased following the treatment with UA, which was also in a time-dependent manner. Compared with UA group, addition of 3-methyladenine(3-MA) inhibited the increase in autophagic vacuoles and exacerbated the apoptosis.CONCLUSIONAutophagy shows protective effect on the proliferation inhibition of HUVECs induced by UA and the proliferation inhibition can be enhanced by the autophagy inhibitor 3-MA. 3-MA may enhance the apoptotic rate of HUVECs induced by UA.
Ursolic acid; Endothelial cells; Autophagy; Apoptosis
R363
A
10.3969/j.issn.1000-4718.2012.04.005

