蛇毒PCA改善冠脉微血栓大鼠血液流变学的机制研究*
李 曙, 张根葆,2 △, 洪 云, 陆晓华
(皖南医学院 1病理生理学教研室, 2蛇毒研究所, 3弋矶山医院超声医学科,4机能实验中心,安徽 芜湖 241002)
1000-4718(2012)04-0595-06
2011-11-23
2012-02-24
安徽省高等学校省级自然科学研究项目(No.KJ2010B461);安徽省教育厅自然基金重点项目 (No.KJ2011266);皖南医学院中青年课题(No.WK200918)
△通讯作者 Tel:0553-3932435;E-mail: zgb858@163.com
蛇毒PCA改善冠脉微血栓大鼠血液流变学的机制研究*
李 曙1, 张根葆1,2 △, 洪 云3, 陆晓华4
(皖南医学院1病理生理学教研室,2蛇毒研究所,3弋矶山医院超声医学科,4机能实验中心,安徽 芜湖 241002)
目的探讨皖南产蝮蛇毒(AHV)蛋白C激活物(PCA)改善冠脉微血栓(CAM)大鼠血液流变学的作用机制。方法Sprague-Dawley大鼠50只,随机分为假手术组、CAM组、低、中、高剂量PCA[CAM+PCA(0.5 mg/kg)、CAM+PCA (2 mg/kg)、CAM+PCA (8 mg/kg)]干预组,每组10只。通过从主动脉根部直接向左心室注入月桂酸钠1.0 mg/kg(浓度10 g/L)以建立大鼠冠脉微血栓模型,采用血栓弹力仪系统(TEG)描计血栓弹力图,测定各组血浆中内皮素-1(ET-1)、P-选择素(P-selectin)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)和天冬氨酸氨基转移酶(AST)的水平;Western blotting检测心肌组织中P-selectin和肿瘤坏死因子α(TNF-α)蛋白表达;光镜观察心肌组织学改变。结果与模型组比较,PCA大剂量干预组凝血时间和血凝块形成时间延长,Alpha角度、最大幅度和血凝指数值减小(P<0.05),血浆CK-MB、LDH、AST、ET-1和P-selectin的水平降低(P<0.05),心肌组织P-selectin和TNF-α的蛋白表达下降(P<0.05)。病理观察显示中、高剂量PCA干预组大鼠冠脉未形成微血栓。结论蝮蛇毒PCA组分可以限制冠脉微血栓的形成,降低血浆ET-1和P-selectin的含量,抑制心肌组织P-selectin和TNF-α表达,改善微血栓后血液流变学变化,有效保护心肌细胞。
蝮蛇毒; 蛋白C激活物; 微血栓; 血液流变学
血栓性疾病是一组因各种原因致使血液在血管内或心脏中,由流动的液体变为凝固的固体,致使血流发生不同程度的受阻后所形成的综合病症[1-2]。蛇毒作为一种天然的药用资源,含有多种活性成分,是目前治疗心脑血管疾病较为有效的生物制剂。近些年来,本课题组从皖南地区五步蛇、蝮蛇和眼镜蛇粗毒中分离纯化了蛋白C激活物(protein C activator, PCA),实验研究已证实该生物活性物质可影响凝血过程,影响血小板黏附、聚集和保护血管内皮细胞功能,具有高效低毒的抗凝、溶栓效应,这对于临床血栓性疾病的防治以及改善血液高凝状态具有重要意义。但PCA是否通过抑制肿瘤坏死因子α(tumor necrosis factor α,TNF-α)防止内皮损伤和血栓形成目前尚未见报道。本文采用月桂酸钠复制大鼠冠脉微血栓(coronary artery microthrombosis,CAM)模型,探讨PCA对实验性冠脉微血栓的影响,为今后进一步临床应用提供科学的实验依据。
材 料 和 方 法
1药物与试剂
蛇毒PCA由皖南医学院蛇毒研究所提供;SDS-PAGE凝胶电泳试剂(Sigma);P-选择素(P-selectin)、TNF-α、羊抗大鼠多克隆抗体、马抗山羊 IgG抗体、β-actin (Santa Cruz),月桂酸钠(上海润捷化学试剂有限公司),肌酸激酶同工酶(creatine kinase-MB,CK-MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)活性测定试剂盒(南京建成生物工程研究所),内皮素-1(endothelin-1, ET-1) 测定试剂盒(北京尚柏生物科技有限公司),其余试剂均为国产分析纯。
2主要仪器
TEG®5000型血栓弹力仪系统(Haemoscope Corporation);DYY-10C型电泳仪(北京市六一仪器厂);蛋白质纯化系统(KTAprime,GE);DW-2000型动物人工呼吸机(上海嘉鹏科技有限公司);Model 680型酶标仪(Bio-Rad);7060 型全自动生化分析仪(日立);Western blotting:Bio-Rad MiniGel系统。
3动物分组与给药
健康雄性Sprague-Dawley大鼠50只,体重200~250 g,由皖南医学院实验动物中心提供。大鼠随机分为假手术组 (sham operation,sham)、CAM模型组、低、中、高剂量PCA干预组(0.5 mg/kg、2 mg/kg、
8 mg/kg),每组10只。模型复制10 min后,各PCA组舌静脉注射PCA;CAM组注射同体积生理盐水;sham组不复制微血栓模型,仅注射同体积生理盐水。
4大鼠冠脉微血栓模型制备
参考叶明芳等[3]方法加以改进,取SD雄性大鼠,腹腔注射3%戊巴比妥钠(1 mL/kg)后,仰卧固定,常规颈部手术,气管插管,呼吸机辅助通气,左前外侧中心切口进胸,分离主动脉并用血管夹夹闭主动脉后,迅速以微量注射器从主动脉根部注入月桂酸钠1.0 mg/kg(浓度10 g/L);夹闭20 s后,松开血管夹,心跳稳定后逐层关胸。
5大鼠血液流变学监测
各实验组动物均于3 h后颈总动脉取1 mL血液置于3.8%枸橼酸钠(1∶9)抗凝剂5 mL试管中,实验所用玻璃试管均经硅化处理。血样加入专业测试杯,激活剂为Kolin。用TEG®5000型血栓弹力图-凝血弹性描记仪系统(简称TEG)对血样各参数:凝血时间(R);血凝块形成时间(K);Alpha角度;最大幅度(maximum amplitude,MA);凝血指数(coagulation index,CI)等进行检测。
6大鼠血液生化及分子生物学指标检测
采用7060 型全自动生化分析仪连续检测法测定血浆中CK-MB、LDH和AST活性。采用酶联免疫吸附双抗体夹心法原理定量测定ET-1和P-选择素水平,严格按试剂盒说明书操作。
7Westernblotting检测
术后12 h处死动物,取约1 g心肌,加组织裂解液,匀浆、超声、离心(12 000×g离心5 min),取上清液150 μg用10% SDS-PAGE电泳后半干式转膜至 PVDF膜, 5%脱脂奶粉室温封闭2 h。P-selectin、TNF-αⅠ抗(1∶250稀释 )室温过夜, 加辣根过氧化物酶标记的马抗山羊IgG抗体 (1∶5 000稀释 )室温反应 1.5 h, 洗膜后DAB显色,膜置滤纸上干燥, 以β- actin为内参照,进行半定量分析。
8组织形态学观察
取左心室乳头肌经10%中性甲醛溶液固定,常规梯度乙醇脱水,石蜡包埋、切片,HE染色,光镜下观察微血栓形成及心肌形态学变化。
9统计学处理
结 果
1蝮蛇毒PCA组分对大鼠血栓弹力图影响
CAM组较sham组,R值和K值明显降低(P<0.05),表明CAM组血液处于高凝状态;除CAM+PCA(0.5 mg/kg)组外,其它组与CAM组比较,R值、K值和CI明显增加(P<0.05),高剂量(8 mg/kg)组与sham组比较无明显差异(P>0.05),表明血液高凝状态有所缓解,见图1、表1。

Figure 1. Thrombelastogram performance in the blood of different rats.A:TEG parameters;B: sham;C: CAM;D: CAM+PCA (8 mg/kg).
图1不同组大鼠血液血栓弹力图表现

表1 蝮蛇毒PCA组分对大鼠血栓弹力图的影响
*P<0.05vssham;#P<0.05,##P<0.01vsCAM.
2蝮蛇毒PCA组分对大鼠血浆中心肌酶水平的影响
CAM组大鼠血浆中AST、LDH和CK-MB活性均较sham组显著升高(P<0.05); PCA中剂量组和高剂量组大鼠血浆中AST、LDH和CK-MB活性较CAM组显著降低(P<0.05); PCA低剂量组大鼠血浆中AST、LDH和CK-MB活性与CAM组无明显差异(P>0.05)。这提示中、高剂量蛇毒PCA对冠脉微血栓造成的心肌细胞损伤有一定的保护作用,见表2。

表2 PCA对各组大鼠血浆中AST、LDH和CK-MB水平的影响
*P<0.05vssham;#P<0.05,##P<0.01vsCAM.
3蝮蛇毒PCA组分对大鼠血浆中P-selectin和ET-1含量的影响
CAM组大鼠血浆中P-selectin和ET-1含量较sham组显著升高(P<0.01); PCA中剂量组和高剂量组大鼠血浆中P-selectin和ET-1的含量较CAM组显著降低(P<0.05);PCA低剂量组大鼠血浆中P-selectin和ET-1的含量与CAM组无明显差异(P>0.05),见表3。
4蝮蛇毒PCA组分对大鼠冠脉微血栓形成的影响
CAM组和PCA低剂量组心肌病理切片显示:微血管腔内有微血栓形成、炎症细胞附壁、心肌肿胀。Sham组、PCA中剂量组和高剂量组心肌病理切片显示:微血管腔内有大量红细胞、无炎症细胞附壁、无心肌肿胀,见图2。上述结果表明,蝮蛇毒PCA能有效抗凝、溶栓及保护心肌细胞。
表3PCA对各组大鼠血浆中P-选择素和ET-1含量的影响
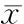
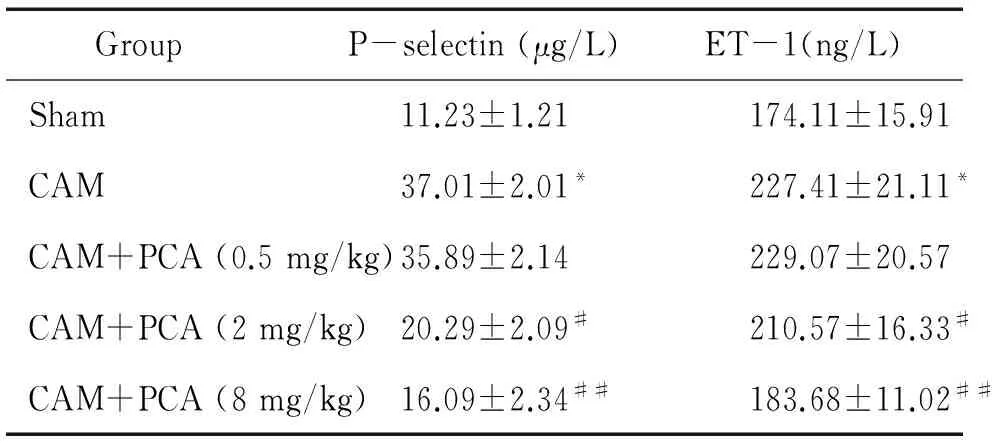
GroupP-selectin(μg/L)ET-1(ng/L)Sham11.23±1.21174.11±15.91CAM37.01±2.01*227.41±21.11*CAM+PCA(0.5mg/kg)35.89±2.14229.07±20.57CAM+PCA(2mg/kg)20.29±2.09#210.57±16.33#CAM+PCA(8mg/kg)16.09±2.34##183.68±11.02##
*P<0.05vssham;#P<0.05,##P<0.01vsCAM.

Figure 2. Comparison of myocardium in different groups of rats(HE staining,×400). A: sham; B: CAM; C: CAM+PCA(0.5 mg/kg); D: CAM+PCA(2 mg/kg); E: CAM+PCA(8 mg/kg).
图2不同组大鼠心肌病理切片比较
5蝮蛇毒PCA组分对心肌中TNF-α和P-选择素含量的影响
与sham组比较,CAM组大鼠心肌中TNF-α和P-selectin含量明显增加(P<0.05)。PCA中、高剂量组大鼠心肌TNF-α和P-selectin含量较CAM组明显降低(P<0.05),见图3。
讨 论
冠状动脉血栓性疾病是心室重构和心力衰竭的常见原因,其中微血栓的形成是造成冠脉微循环障碍的主要因素。实验中月桂酸钠制造的外周动脉血栓模型依靠月桂酸钠有强烈的内皮损伤作用,可造成内皮的脱落,甚至穿孔;触发炎症性介质如肿瘤坏死因子、白细胞介素、黏附分子等的释放,触发血小板活化[4-5]。聚集成血小板血栓并阻塞远端血管而形成冠状动脉微血栓。
蛇毒是从毒蛇毒腺中分泌出来的一种液体,其成份十分复杂,主要含有多种酶、蛋白质和多肽等生物活性大分子。众多研究已经表明,从蛇毒粗毒中提取的活性分子具有非常广泛的药理学作用,部分已应用于临床止血、抗凝、镇痛、抗肿瘤等领域。近年来我室从蝮蛇毒中提取的蛋白C激活物被实验证明可影响凝血过程、影响血小板黏附、聚集和保护血管内皮细胞功能,具有高效低毒的抗凝、溶栓效应[6-7]。
实验发现,PCA组大鼠心肌酶较模型组有明显改善,表明经PCA治疗,大鼠心肌损伤减轻。在血栓弹力仪监测模型组及PCA干预组时,发现PCA干预组的R值、K值较模型组明显增大,CI减小;同时病理切片显示,PCA干预组的心肌细胞形态正常,组织间水肿和炎症反应较轻,微血管内未形成微血栓,而模型组的心肌细胞水肿和炎症反应明显,微血管内有微血栓形成,也可看到微小梗死病灶,通过检测内皮损伤物ET-1也显示PCA干预后的大鼠血浆中ET-1含量明显低于模型组,提示PCA可能通过抑制血栓的形成而改善血液流变学对心肌起保护作用。

图3各组大鼠心肌中TNF-α和P-selectin的含量
研究提示,炎症网络机制在血栓的形成起着重要作用。TNF-α是一种重要的炎症细胞因子,能促进炎症细胞如中性粒细胞、单核细胞等黏附至内皮细胞。选择素家族是重要的黏附分子,TNF-α能迅速刺激这类黏附分子的合成和表达。其中P-选择素是存在于内皮细胞Weibel-Palade(WP)小体和血小板a颗粒中的一种糖蛋白。当血管内皮损伤及TNF-α刺激时,储存于内皮细胞WP小体内的P选择素可通过出胞作用迅速转移至质膜上[8],介导中性粒细胞减速并沿血管壁滚动[9]。Juliana 等[10]在肿瘤坏死因子诱导中性粒细胞聚集实验中证实,在敲除内皮细胞P-选择素大鼠模型中, TNF-α诱导的白细胞聚集、黏附现象较野生鼠中的减轻,因此血管内炎性反应是通过TNF-α介导内皮细胞释放P-selectin而启动,并导致内皮功能紊乱, 进一步促进血小板活化[11]。Mami等[12]和Ishikawa 等[13]研究显示血小板的聚集、黏附需要以白细胞向内皮迁移、黏附为前提,因此内皮细胞Ps 参与介导血小板在管腔内的聚集和黏附。
本研究中以蝮蛇毒PCA干预月桂酸钠损伤的CAM模型,Western blotting结果显示,大鼠心肌中P-选择素和TNF-α的表达较模型组明显降低,与病理结果相符。提示PCA可能通过调控TNF-α和P-selectin表达抑制白细胞及血小板的聚集、黏附,减轻血栓的形成,从而改善冠脉微血栓后的血液流变学变化。
综上所述,我室提取的蝮蛇毒PCA活性物质能明显抑制微血栓形成,减少心肌酶释放,改变血液的高凝状态,对缺血心肌和血管内皮有改善和保护作用,其机制可能是通过抑制炎症反应和血小板活化,改善血管内皮细胞功能,也可能是通过减轻微血管栓塞改善心肌损伤。因此,明确蝮蛇毒PCA调节血液流变学改变的主要途径,是我们进一步研究的方向[14-17]。
[1] Davies MJ,Thomas AC,Knapman PA,et al.Intramyocardial platelet aggregation in patients with unstable angina suffering sudden ischemic cardiac death[J].Circulation,1986,73(3):418-427.
[2] Falk E.Unstable angina with fatal outcome:dynamic coronary thrombosis leading to infarction and/or sudden death.Autopsy evidence of recurrent mural thrombosis with peripheral embolization culmilating in total vascular occlusion[J].Circulation,1985,71(4):699-708.
[3] 叶明芳,陈良龙,陈 丹,等.大鼠冠状动脉微血栓模型[J].福建医科大学学报,2003, 37(1):58-59.
[4] Hartford M, Wiklund O, Mattsson Hultén L, et al. CRP, interleukin - 6, secretory phospholipase A2group IIA, and intercellular adhesion molecule-1 during the early phase of acute coronary syndromes and long-term follow-up[J].Int J Cardiol, 2006, 108(1): 55-62.
[5] Roy S, Khanna S, Kuhn DE, et al. Transcriptome analysis of the ischemia-reperfused remodeling myocardium: temporal changes in inflammation and extracellular matrix[J].Physiol Genomics, 2006, 25(3):364-374.
[6] 张根葆,陈冬云,周志泳,等.蝮蛇毒蛋白C激活物的纯化与抗血小板活性[J]. 皖南医学院学报, 2005, 24(1):8-10.
[7] 王海华,张根葆. 蝮蛇毒蛋白 C激活物对内毒素性离体大鼠心脏功能的影响[J]. 蛇志,2007,19(1):4-7.
[8] Thomas WS,Mori E,Copeland BR,et al.Tissue factor contributes to microvascular defects after focal cerebral ischemia[J].Stroke, 1993,24(6):847-853.
[9] Lefer AM. Role of selectins in myocardial ischemia reperfusion injury[J].Ann Thorac Surg,1995,60(3): 773 -777.
[10]Carvalho-Tavares J, Hickey MJ, Hutchison J, et al. A role for platelets and endothelial selectins in tumor necrosis factor-α-induced leukocyte recruitment in the brain microvasculature[J].Circ Res,2000, 87(12): 1141-1148.
[11]Fasching P, Waldhausl W, Wangner OF, et al. Elevated circulating adhesion molecules in NIDDM:potential mediators in diabetic macroangiopathy[J].Diabetologia,1996, 39(10): 1242-1244.
[12]Mami L, Karen YS, Zhang JH, et al. Cerebral microvascular responses to hypercholesterolemia: roles of NADPH oxidase and P-selectin[J].Circ Res, 2004, 94(2): 239-244.
[13]Ishikawa M, Cooper D, Arumugam TV, et al. Platelet-leukocyte-endothelial cell interactions after middle cerebral artery occlusion and reperfusion[J].J Cereb Blood Flow Metab, 2004,24(8): 907-915.
[14]Nichols TC. NF-κB and reperfusion injury[J].Drug News Perspect, 2004,17(2):99-104.
[15]Yeh CH, Lin YM, Wu YC,et al.Inhibition of NF-κB activation can attenuate ischemia/reperfusion-induced contractility impairment via decreasing cardiomyocytic proinflammatory gene up-regulation and matrix metalloproteinase expression[J].J Cardiovasc Pharmacol, 2005,45(4):301-309.
[16]Di Paola R, Mazzon E, Paterniti I, et al. Olprinone, a PDE3 inhibitor, modulates the inflammation associated with myocardial ischemia-reperfusion injury in rats[J].Eur J Pharmacol, 2011,650(2-3):612-620.
[17]Di Paola R, Esposito E, Mazzon E, et al. GW0742, a selective PPAR-β/δ agonist, contributes to the resolution of inflammation after gut ischemia/reperfusion injury[J].Leukoc Biol ,2010, 88(2):291-301.
AgkistrodonhalysvenomPCAimproveshemorheologyinratswithcoronaryarterymicrothrombosis
LI Shu1, ZHANG Gen-bao1,2, HONG Yun3, LU Xiao-hua4
(1DepartmentofPathophysiology,2InstituteofSnakeVenom,3DepartmentofUltrasonography,YijishanHospital,4ExperimentalCenterforFunctionalSubjects,WannanMedicalCollege,Wuhu241002,China.E-mail:zgb858@163.com)
AIM: To explore the effect of protein C activator (PCA) from WannanAgkistrodonhalysvenom on hemorheology in the rats with coronary artery microthrombosis(CAM).METHODSFifty SD rats were randomly divided into sham operation group, CAM group, low dose (0.5 mg/kg), medium dose (2 mg/kg ) and high dose (8 mg/kg) of PCA treatment groups. The model of CAM was induced by injecting sodium laurate at dose of 1.0 mg/kg with the concentration of 10 g/L from aortic root to left ventricle. Thrombelastogram was obtained by thromboelastography instrument system. The content of endothelin-1(ET-1) and P-selectin, and the activity of creatine kinase-MB (CK-MB),lactate dehydrogenase (LDH) and aspartate aminotransferase (AST) in plasma were determined by ELISA. The protein expression of myocardial P-selectin and TNF-α was detected by Western blotting. The structural changes of the myocardial cells and interstitial tissues were observed under microscope.RESULTSCompared with CAM group, clotting time and clot formation time significantly prolonged in high-dose PCA group. The alpha angle, maximum amplitude, coagulation index, and the levels of ET-1, P-selectin, CK-MB, LDH and AST in plasma were decreased. The protein expression levels of P-selectin and TNF-α in myocardial tissues were down-regulated (P<0.05). Cardiac histological observation showed that coronary microthrombi in medium-dose and high-dose PCA groups were not found.CONCLUSIONAgkistrodonhalysvenom PCA inhibits the formation of coronary microthrombi, down-regulates the expression of P-selectin and TNF-α, improves the abnormal hemorheology after microthrombi, and effectively protects myocardial cells.
Agkistrodonhalysvenom; Protein C activator; Microthrombus; Hemorheology
R543.3
A
10.3969/j.issn.1000-4718.2012.04.004

