肌球蛋白轻链激酶在失血性休克大鼠离体淋巴管收缩性双相变化中的作用*
张玉平, 牛春雨, 赵自刚, 秦立鹏, 司永华, 张立民, 张 静
(河北北方学院微循环研究所,基础医学院病理生理学教研室,河北 张家口 075000)
1000-4718(2012)04-0589-06
2011-10-08
2012-02-29
国家自然科学基金资助项目(No.30770845);河北省自然科学基金资助项目(No.C2008000503);河北省教育厅科学研究重点项目(No.ZH2007101);河北省百名优秀人才支持计划(No.CPRC047)
△通讯作者 Tel:0313-4029168;E-mail:ncylxf@126.com
肌球蛋白轻链激酶在失血性休克大鼠离体淋巴管收缩性双相变化中的作用*
张玉平, 牛春雨△, 赵自刚, 秦立鹏, 司永华, 张立民, 张 静
(河北北方学院微循环研究所,基础医学院病理生理学教研室,河北 张家口 075000)
目的探讨肌球蛋白轻链激酶(MLCK)在失血性休克(HS)大鼠离体淋巴管收缩性双相变化中的作用机制。方法Wistar雄性大鼠随机均分为对照组和HS组(复制HS模型,分为HS 0 h、0.5 h、1 h、2 h和3 h亚组),留取胸导管组织,检测磷酸化MLCK(p-MLCK)含量;制备对照、HS 0.5 h与2 h组的淋巴管条,采用离体淋巴管收缩性观察技术,观察MLCK抑制剂ML-7和激动剂P物质(SP)对HS 0.5 h及2 h淋巴管收缩频率(CF)、收缩末期直径、舒张末期直径和被动直径的影响,计算淋巴管紧张性指数(TI)、收缩幅度(CA)和泵流分数(FPF),评价淋巴管收缩性。结果HS 0 h和0.5 h淋巴管组织p-MLCK蛋白显著高于对照组;随着休克发展,p-MLCK含量逐渐降低。在1、3、5 cmH2O等多个跨壁压下,HS 0.5 h组淋巴管的CF、TI和FPF均显著高于对照组,ML-7可显著下调这些指标,SP则可明显降低ML-7的作用,使之恢复至HS 0.5 h水平;HS 0.5 h组淋巴管的CF、TI和FPF均显著低于对照组,SP可显著上调这些指标,ML-7则可显著降低SP的作用。HS 0.5 h与2 h离体淋巴管CA与对照组相比无显著变化,SP可降低HS 2 h淋巴管的CA,ML-7可抑制该作用,但二者对HS 0.5 h无明显作用。结论MLCK作为影响淋巴管平滑肌细胞收缩的关键酶,参与了HS发展进程中淋巴管收缩性的双相调节。
休克,出血性; 淋巴管; 收缩性; 肌球蛋白轻链激酶
研究发现,在失血性休克(hemorrhagic shock,HS)发展进程中存在淋巴微循环障碍,表现为淋巴管收缩性降低[1-2],且淋巴微循环状况影响休克的转归[3-4],因此淋巴管收缩功能与休克的发展密切相关[5];进一步发现淋巴管收缩受交感神经[6]、降钙素基因相关肽[7]等体液因子调控;为了排除神经、体液因素对淋巴管收缩性的影响,独立研究休克发展过程中淋巴管本身收缩性的变化,参照文献[8]的研究方法,我们建立了休克离体淋巴管收缩性观察技术平台,发现在休克不同发展过程中淋巴管收缩性表现为双相变化,即休克早期淋巴管收缩性增强(休克即刻、休克0.5 h)、重症休克期淋巴管收缩性降低(休克2 h、休克3 h)[9],P物质(substance P,SP)也具有增强休克离体淋巴管泵功能的作用[10]。研究表明,淋巴管平滑肌细胞(lymphatic smooth muscle cells,LSMC)外的钙离子进入细胞内引起细胞内钙离子浓度升高,活化钙调蛋白,与钙离子结合后,与肌球蛋白轻链激酶(myosin-light-chain kinase,MLCK)结合从而活化MLCK,引起20 kD肌球蛋白轻链(20 kD myosin light chain,MLC20)磷酸化,最终导致LSMC收缩,引起淋巴管收缩,可见MLCK是淋巴管收缩的关键酶[11]。那么,在休克淋巴管收缩性双相变化过程中,LSMC中MLCK活性有何变化?MLCK是否参与淋巴管收缩性的变化?为此,本研究测定了休克发展过程中磷酸化MLCK(p-MLCK)水平的变化,采用微血管压力-直径肌动仪观察MLCK对离体淋巴管泵活性的影响,探讨MLCK在休克淋巴管收缩性双相变化中的作用。
材 料 和 方 法
1主要试剂、实验动物与分组
MLCK特异性抑制剂ML-7、激动剂SP购自Enzo,p-MLCK的ELISA试剂盒购自江苏希望生物科技有限公司(抗体由R&D生产);SPF级雄性Wistar大鼠123只,体重250~330 g,购自中国军事医学科学院动物繁殖中心,所有动物实验前自由饮水、禁食12 h。其中,72只动物随机均分为对照组(control)、HS 0 h组、HS 0.5 h组、HS 1 h组、HS 2 h组和HS 3 h组,用于留取淋巴管组织;51只动物随机分为control组(n=8)、HS 0.5 h组(n=8)、HS 0.5 h+ML-7组(n=7)、HS 0.5 h+ ML-7+SP组(n=7)、HS 2 h组(n=8)、HS 2 h+SP组(n=6)和HS 2 h+SP+ML-7(n=7),用于制备离体淋巴管条。
2失血性休克模型复制
大鼠经1%戊巴比妥钠(50 mg/kg)肌肉注射麻醉后,行股部手术。分离左侧股静脉和股动脉,股静脉注射肝素钠(500 U/kg)抗凝,股动脉插管并通过RM6240BD 型生物信号采集处理系统(成都仪器厂)监测平均动脉血压(mean artery pressure,MAP);同时,分离右侧动脉,插管备放血用。手术完成后,稳定30 min,经右股动脉使用NE-1000型程控微量注射泵(New Era Pump Systems)缓慢匀速放血,10 min 内至MAP 40 mmHg,实验中通过失血量的调整维持MAP在(40±2)mmHg水平,复制HS模型。
3淋巴管组织的留取与p-MLCK含量检测
对照组在完成所有手术稳定30 min后、HS各组大鼠在相应时点,腹腔注射1%戊巴比妥钠120 mg/kg后,侧切口打开胸壁,切除胸骨及与其相连的约一半肋骨,靠近膈肌结扎并切断下腔静脉。将心、肺推向身体左侧,暴露胸主动脉和脊柱之间包含胸导管的组织,紧贴脊柱迅速剪取长3~4 cm包含胸导管的组织,移入盛有0~4 ℃、通气(95%O2、5%CO2)的冷PSS缓冲液(mmol/L:NaCl 118.99、KCl 4.69、CaCl22.50、MgSO41.17、KH2PO41.18、NaHCO325.0、EDTA·Na20.03、葡萄糖 5.50)的培养皿中。SSZ型手术显微镜(上海光学仪器厂)下分离、去除胸导管周围的脂肪组织,留取淋巴管组织,置于-70 ℃冰柜中保存。
取出每组12条淋巴管,随机分为6亚组(6个重复),即每亚组2条淋巴管,移入EP管后,用显微手术器械在冰浴上剪碎后,加入组织细胞裂解液,超声波细胞破碎仪破碎组织15 min后,应用低温高速离心机在4 ℃、14 000×g离心5 min,保存上清。应用p-MLCK蛋白ELISA检测试剂盒,应用标准品绘制标准曲线(p-MLCK=0.05697x+0.0051x2+0.000157x3,R2=0.998)后,检测各组淋巴管组织p-MLCK蛋白含量。淋巴管组织匀浆蛋白以考马斯亮蓝法定量。
4离体淋巴管的制备、固定、孵育与收缩性观察
按前述方法留取淋巴管组织、去除周围脂肪组织后,按我室常规方法[9-10,12]制备离体淋巴管条,移入微血管压力-直径测定仪浴槽内,固定于毛细玻璃管上,通过压力伺服系统(Living Systems Instrumentation PS/20)控制管腔内压力(3 cmH2O),保证淋巴管壁无渗漏、无损伤和扭转,进行升温、孵育,直至淋巴管出现自发性收缩后,进行淋巴管收缩性观察。
调节压力伺服系统使淋巴管跨壁压分别维持在1、3和5 cmH2O下,记录control、HS 0.5 h和HS 2 h组淋巴管的收缩频率(contraction frequency,CF)、舒张末期直径和收缩末期直径;HS 0.5 h+ML-7、HS 0.5 h+ML-7+SP、HS 2 h+SP和HS 2 h+SP+ML-7组,在浴槽内分别加入ML-7(10-5mmol/L)、ML-7(10-5mmol/L)+SP(10-7mmol/L)、SP(10-7mmol/L)和SP(10-7mmol/L)+ML-7(10-5mmol/L)孵育10 min后检测相关指标;待各组实验结束之后,测得相应压力下淋巴管的最大被动舒张直径[10, 13],计算紧张指数(tonic index,TI)、收缩幅度(contraction amplitude,CA)和泵流分数(fractional pump flow,FPF),结合CF评价淋巴管收缩性(参见文献[9-10,12-13])。
5统计学处理
结 果
1失血性休克发展过程中淋巴管组织p-MLCK蛋白含量的变化
如图1示,与对照组比较,HS 0 h和0.5 h淋巴管组织MLCK蛋白显著增高(P<0.05,P<0.01);随着休克发展,MLCK蛋白表达逐渐降低,表现为HS 1 h、HS 2 h和HS 3 h显著低于HS 0 h和HS 0.5 h(P<0.01)。
2MLCK对休克淋巴管紧张性指数的影响
与对照组比较,HS 0.5 h组淋巴管在1、3和5 cmH2O跨壁压下的紧张性指数增高,HS 2 h组淋巴管在1、3 cmH2O跨壁压下的紧张性指数降低;与MLCK特异性抑制剂ML-7孵育的HS 0.5 h+ML-7组淋巴管在各跨壁压下的紧张性指数均显著低于HS 0.5 h组,而再与MLCK激动剂SP孵育后的HS 0.5 h+ML-7+SP组淋巴管在3、5 cmH2O跨壁压下的紧张性指数显著增高,高于HS 0.5 h+ML-7组;HS 2 h组与SP孵育后,淋巴管紧张性指数在各跨壁压下均显著高于HS 2 h组,HS 2 h组淋巴管与SP孵育后再与ML-7孵育,其紧张性指数显著降低,在各跨壁压下均显著低于HS 2h+SP组,而与HS 2 h组相比无显著差异,见图2。
3MLCK对休克淋巴管收缩频率的影响
由图3可见,HS 0.5 h组淋巴管在1、3和5 cmH2O跨壁压下的CF均显著高于、HS 2 h组淋巴管在各跨壁压下均显著低于对照组;与ML-7孵育后,HS 0.5 h+ML-7组淋巴管在各跨壁压下的CF均显著低于HS 0.5 h组,再与SP孵育后的HS 0.5 h+ML-7+SP组淋巴管在各跨壁压下,CF均得到回升,高于HS 0.5 h+ML-7组;HS 2 h组与SP孵育后,淋巴管CF在各跨壁压下均显著高于HS 2 h组,再与ML-7孵育后的HS 2 h+SP+ML-7组的淋巴管CF在各跨壁压下均显著低于HS 2 h+SP组,而与HS 2 h组差异无统计学意义。
4MLCK对休克淋巴管收缩幅度的影响
由图4可见,HS 0.5 h与HS 2 h组淋巴管在各跨壁压下的CA均与对照组无显著差异;HS 0.5 h组淋巴管分别与ML-7或ML-7+SP孵育后,CA亦未见显著变化。HS 2 h组淋巴管与SP孵育后,其CA值在1、3 cmH2O跨壁压下显著下降,低于对照组与HS 2 h组;再与ML-7孵育后的HS 2 h+SP+ML-7组淋巴管CA值显著高于HS 2 h+SP组。
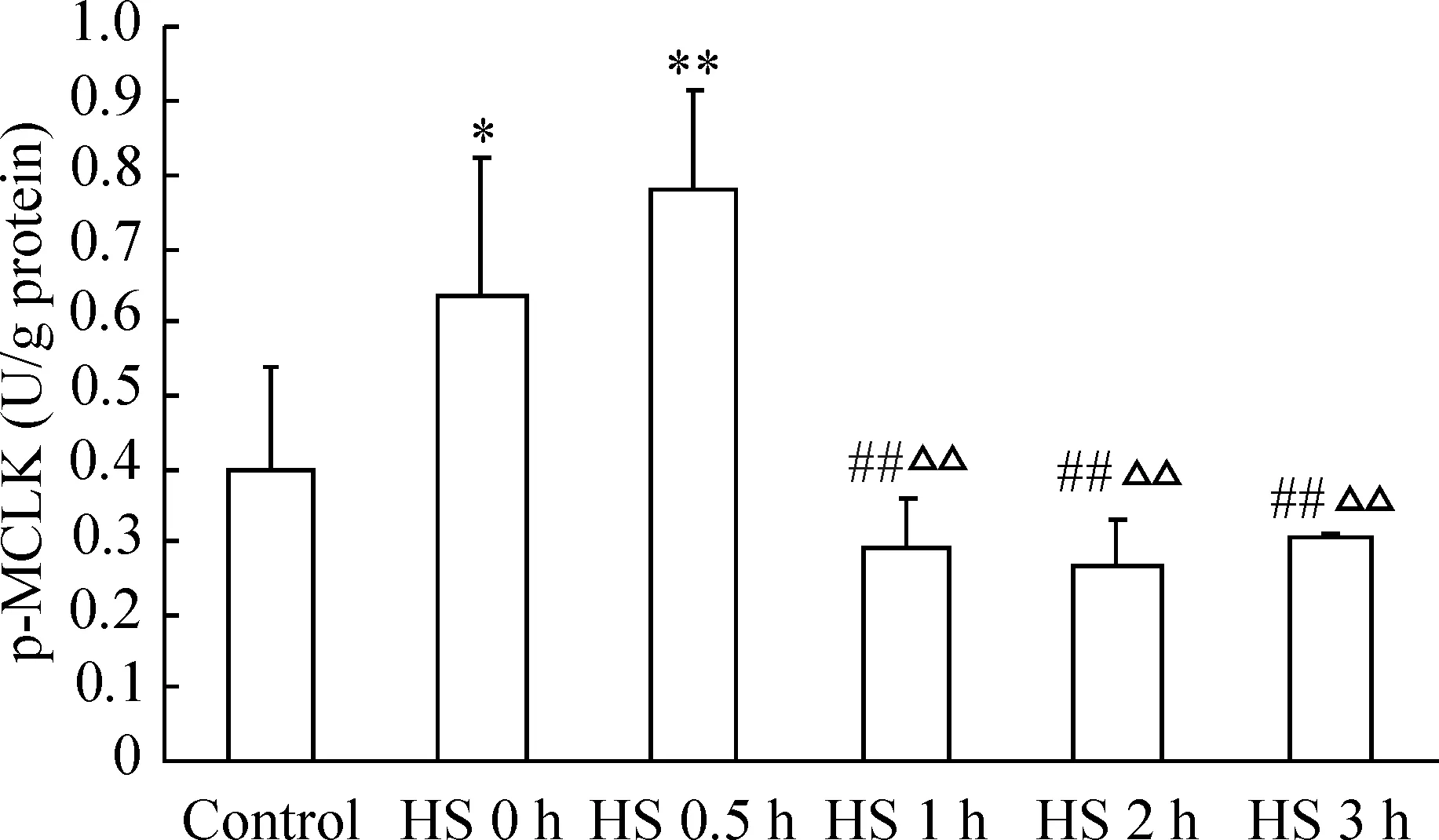

图1失血性休克发展过程中淋巴管组织p-MLCK蛋白的水平
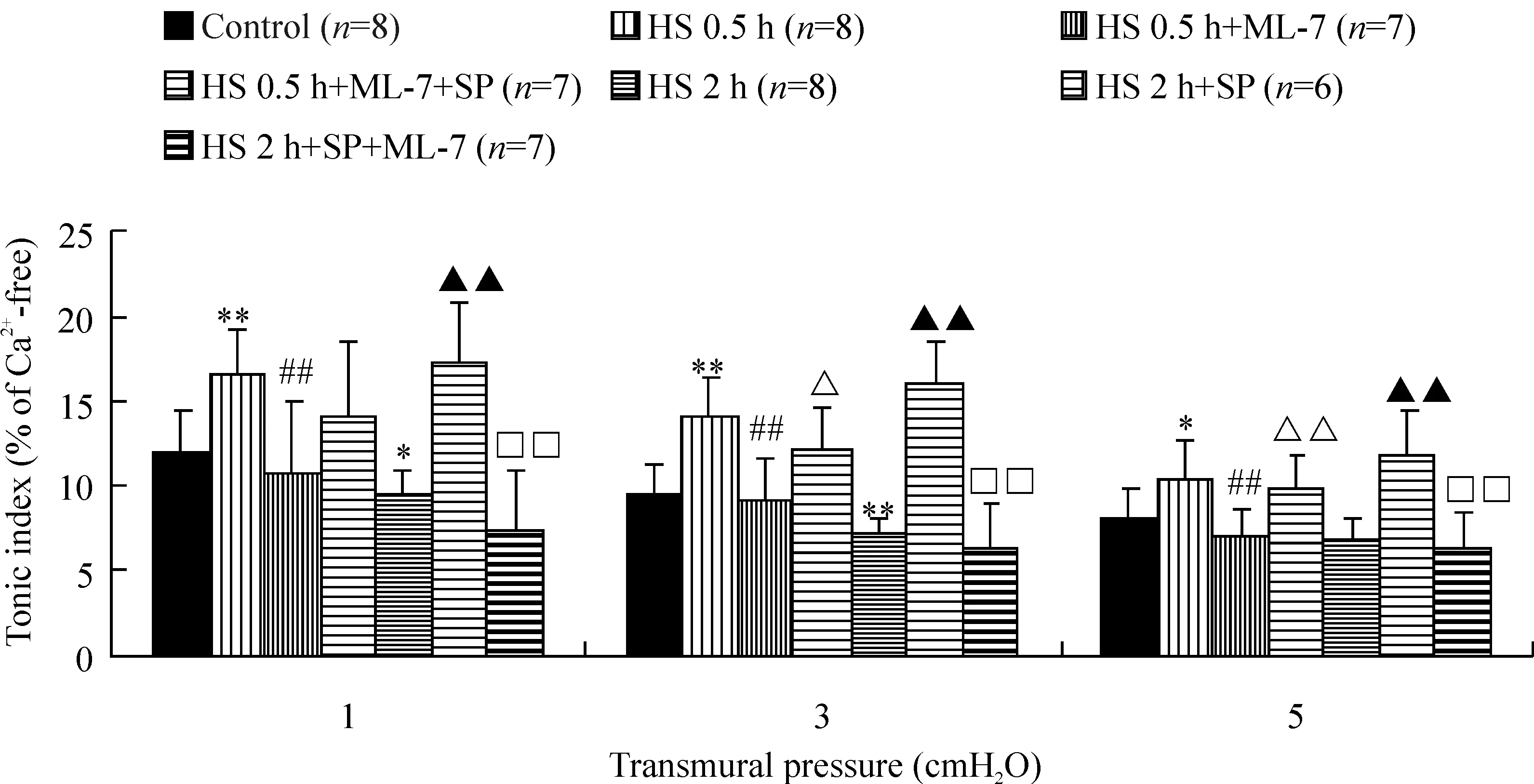
图2ML-7和(或)SP对休克大鼠离体淋巴管紧张性指数的影响
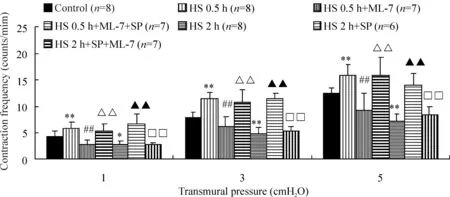
图3ML-7和(或)SP对休克大鼠离体淋巴管收缩频率的影响
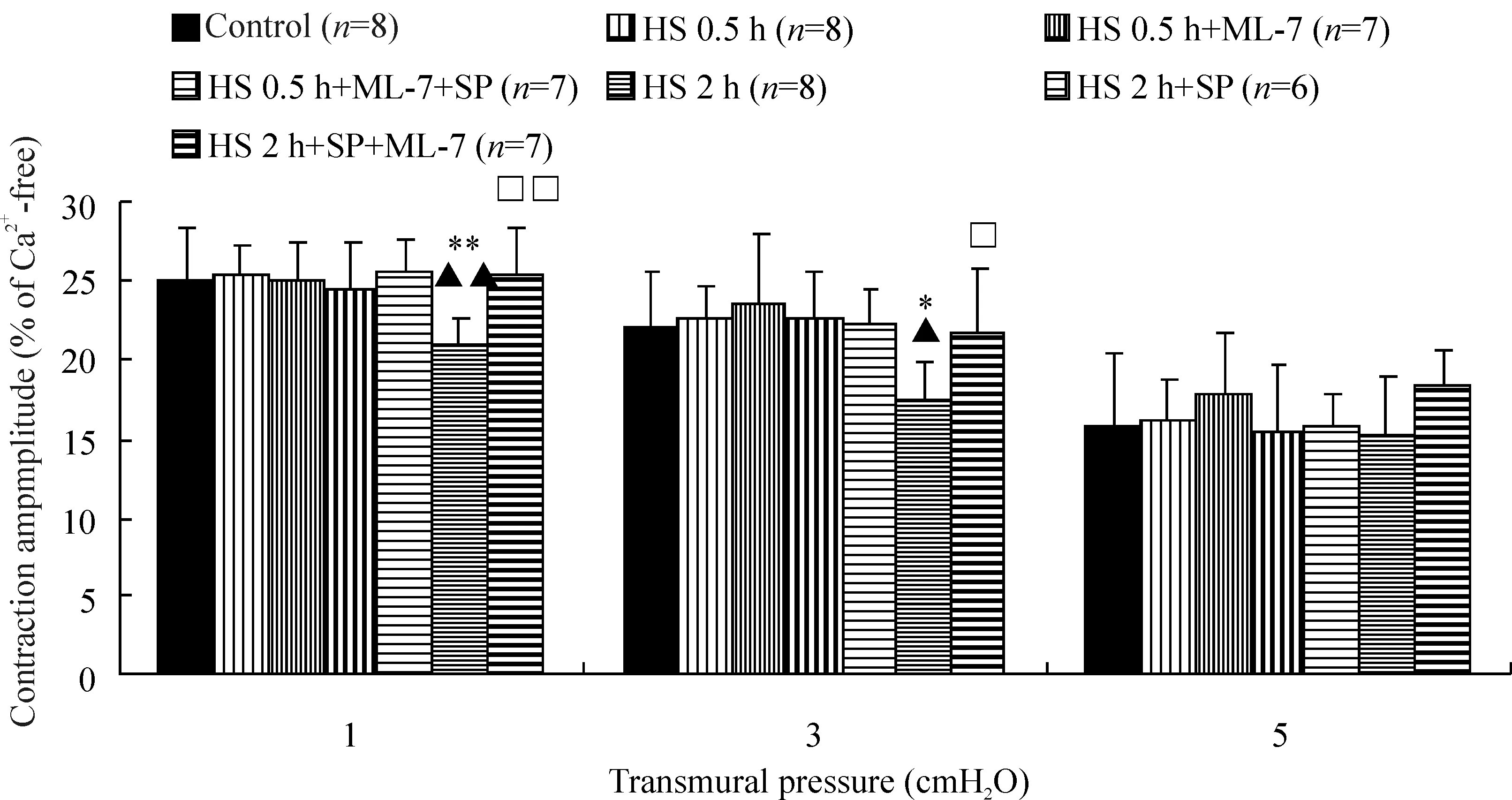
图4ML-7和(或)SP对休克大鼠离体淋巴管收缩幅度的影响
5MLCK对休克淋巴管泵流分数的影响
在各跨壁压下,HS 0.5 h组淋巴管的FPF均显著高于对照组,与ML-7孵育后,HS 0.5 h+ML-7组淋巴管的FPF均显著低于HS 0.5 h组,再与SP孵育后的HS 0.5 h+ML-7+SP组淋巴管FPF均显著高于HS 0.5 h+ML-7组,恢复到HS 0.5 h水平;HS 2 h组淋巴管的FPF均显著低于对照组,与SP孵育后,FPF显著增高,而再与ML-7孵育后的HS 2 h+SP+ML-7组淋巴管FPF均下降至HS 2 h组水平,均显著低于HS 2 h+SP组,见图5。
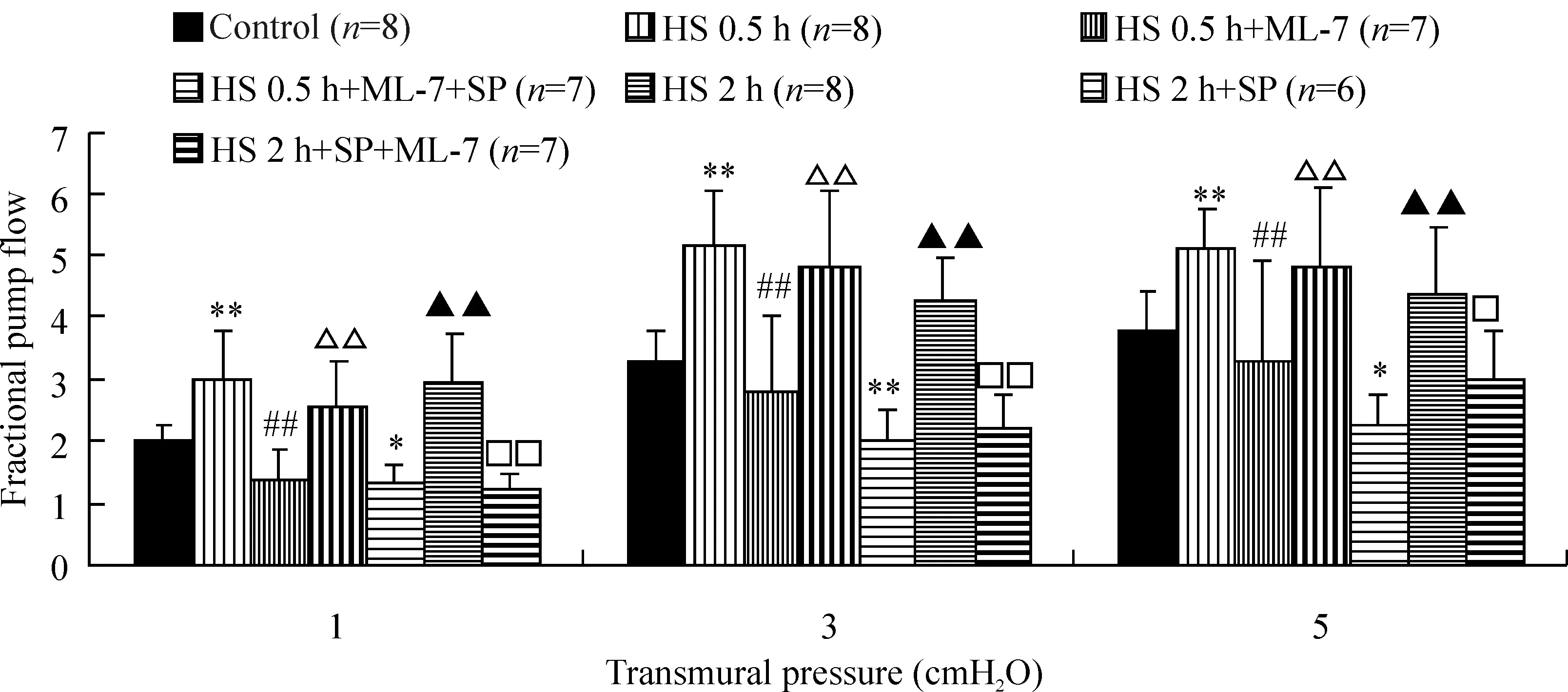
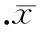
图5ML-7和(或)SP对休克大鼠离体淋巴管泵流分数的影响
讨 论
本研究运用微血管压力-直径测定系统体外检测休克不同时程淋巴管在1、3和5 cmH2O跨壁压下内源性泵活性的变化。实验中采用4个指标评价淋巴管的功能状态:紧张性指数反映淋巴管紧张性收缩状态,为淋巴管时相性收缩的准备状态,受神经、体液、充盈和机械力等多种因素的影响;收缩频率反映单位时间内淋巴管收缩的次数,是淋巴管时相性收缩指标;收缩幅度反映单次淋巴管舒缩的强度;泵流分数反映淋巴管每分钟输送淋巴液的能力,是一个全面衡量淋巴管泵功能活性的指标,紧张指数、收缩频率和收缩幅度都可以引起泵流分数的变化。尽管本实验已排除了神经-体液、渗透梯度、机械挤压、淋巴液生成速率及流量等外源性驱动力对淋巴管收缩性的影响,但休克淋巴管紧张指数、收缩频率和泵流分数等多个指标出现类似于休克血管的先增高后降低的双相性变化[14- 15],说明淋巴管本身的收缩物质也出现了某种变化。
研究表明,在淋巴管平滑肌细胞收缩过程中,细胞内增加的Ca2+,先结合于胞浆中的钙调蛋白(calmodulin, CaM),后者结合4个Ca2+之后活化MLCK,然后,MLCK磷酸化调节MLC20,从而激活肌球蛋白头端的ATP酶活性,最终引起肌球蛋白和肌动蛋白相互作用,启动平滑肌收缩。在MLC20磷酸化过程中涉及多种激酶的作用,其中,Ca2+-CaM-MLCK认为是最重要的途径。许多研究显示,MLCK引起的MLC20磷酸化是一个关键性的枢纽,不同的调节机制通过它来调节平滑肌的收缩行为。通过检测淋巴管组织p-MLCK蛋白含量,发现在休克发展进程中,p-MLCK与淋巴管收缩性的双相变化相一致,即在休克早期表达增多,后期降低。为了进一步观察MLCK在淋巴管收缩双相变化中的作用,实验中我们选取休克0.5 h和2 h时点,初步观察了Ca2+-CaM-MLCK途径激动剂SP[8, 16]和MLCK特异性抑制剂ML-7[8]对失血性休克淋巴管收缩性的影响。结果发现,休克0.5 h离体淋巴管显著增高的紧张指数、收缩频率和泵流分数被ML-7明显抑制,SP可显著改善ML-7对休克0.5 h离体淋巴管上述指标的抑制作用,但休克0.5 h离体淋巴管的收缩幅度未受ML-7和SP的影响;休克2 h离体淋巴管显著降低的紧张指数、收缩频率和泵流分数被SP改善,同样,ML-7也显著抑制了SP对上述指标的提升效应。这些数据表明,失血性休克淋巴管收缩的双相性改变与MLCK密切相关。
值得注意的是,休克2 h离体淋巴管的收缩幅度在给予SP后的1和3 cmH2O压力下明显下降。除此之外,在整个实验中,淋巴管收缩幅度随着压力的增加下降,休克各组、HS 0.5 h+ML-7组、HS 0.5 h+ML-7+SP组和HS 2 h+SP+ML-7组与对照之间无显著差异。休克离体淋巴管收缩幅度的这种变化可能与淋巴管平滑肌舒缩机制的复杂性有关[17-20]。Wang等[8]研究表明,抑制淋巴管平滑肌MLC20磷酸化水平可抑制淋巴管的收缩活性,但是收缩幅度有效运行可能仅需要20%或更低水平的MLC20磷酸化就能够完成;因此可以这样解释,休克过程中MLCK活性的改变引起了MLC20磷酸化水平的变化,出现紧张指数和收缩频率的改变,但是这种改变还不至于影响到收缩幅度。给予SP后休克2 h组在1和3 cmH2O压力下收缩幅度降低,可能是由于SP引起的收缩频率显著增加、压缩了淋巴管的舒张时间,使其舒张不充分造成的[16]。
需要指出,本实验所应用的ML-7为MLCK特异性抑制剂,可显著抑制休克0.5 h淋巴管在不同跨壁压下的收缩功能,同时又具有抑制SP提高休克2 h淋巴管收缩性的作用,尽管SP能促进MLCK的磷酸化及其对淋巴管的收缩,并非MLCK的特异性激动剂,也可说明MLCK参与了休克后淋巴管收缩性双相变化的调节;当然还有待在以后的实验中观察其它与MLCK相关的特异性激动剂在休克后淋巴管收缩中的作用,以寻找更有利的证据。同时,我们在以前的研究中观察到SP作为血管与淋巴管活性的调节物质具有收缩休克淋巴管的作用[10],为本文应用SP这一收缩物质与ML-7作为对比、观察MLCK对休克淋巴管的调节作用提供了实验依据;当然在以后的研究中,我们还应考虑苯肾上腺素、5-羟色胺等其它收缩剂作为参考,以进一步明确休克淋巴管收缩性双相变化的调节机制。
总之,MLCK作为MLC20磷酸化以及Ca2+-CaM-MLCK途径的关键酶,在失血性休克后淋巴管收缩性的双相变化中发挥重要作用,MLCK相关工具药对休克淋巴管收缩性的调控作用为以淋巴管收缩为研究靶点调控淋巴障碍性疾病的干预治疗提供了有效的实验依据。同时,由于p-MLC20水平还取决于肌球蛋白轻链磷酸酶(myosin-light-chain phosphatase,MLCP)对p-MLC20的去磷酸化作用,MLCK/MLCP共同调节MLC20磷酸化水平,引起淋巴管收缩性变化。因此,要阐明失血性休克发展过程中淋巴管收缩性变化的机制,还需进一步研究休克淋巴管MLCK、MLCP和p-MLC20水平的相互关系。
[1] Zhang J, Liu YK. Changes of mesenteric lymph microcirculation and intestinal lymph circulation during shock in rat [J]. Lymphology, 1994, 27(Suppl): 721-724.
[2] 张 静, 薄爱华, 姜 华. 失血性休克时淋巴微循环的变化[J]. 中华医学杂志, 1991, 71(1): 24-28.
[3] Niu CY, Zhang J, Yao T, et al. The antagonistic effect of lymph on shock in rat [J]. Lymphology, 1998, 31(Suppl):159-162.
[4] 牛春雨, 张 静, 穆 铮, 等. 不同转归的过敏性休克大鼠淋巴微循环的变化[J]. 中国病理生理杂志, 1997, 13(6): 620-623.
[5] Zhang J, Niu CY, Zhao ZG. The lymphatic microcirculation & shock[M].∥ Zhao KS,Xu Q. Molecular mechanism of severe shock.1st ed.India: Research Signpost, 2009:131-155.
[6] 张 静, 刘艳凯, 张学锋, 等. 交感神经对大鼠失血性休克过程中淋巴微循环的调控[J]. 生理学报, 1995, 47(2): 179-186.
[7] 樊 贵, 牛春雨, 韩 敏, 等. 肾上腺髓质素对大鼠肠系膜微血管和微淋巴管的作用[J]. 生理学报, 1997, 49(1): 115-118.
[8] Wang W, Nepiyushchikh Z, Zawieja DC, et al. Inhibition of myosin light chain phosphorylation decreases rat mesenteric lymphatic contractile activity [J]. Am J Physiol Heart Circ Physiol, 2009,297(2): H726-H734.
[9] 秦立鹏, 牛春雨, 赵自刚, 等. 一氧化氮对失血性休克大鼠离体淋巴管收缩性双相变化的调节作用[J]. 生理学报, 2011, 63(4): 367-376.
[10]秦立鹏, 牛春雨, 赵自刚, 等. P物质增强失血性休克大鼠离体淋巴管的泵功能[J]. 中国病理生理杂志, 2011, 22(7): 1323-1328.
[11]Zawieja DC. Contractile physiology of lymphatics [J]. Lymphat Res Biol, 2009, 7(2): 87-96.
[12]司永华, 牛春雨, 秦立鹏, 等. 一氧化氮在休克大鼠离体淋巴管对P物质反应性中的作用[J]. 中国病理生理杂志, 2012, 23(1): 29-34.
[13]Davis MJ, Davis AM, Ku CW, et al. Myogenic constriction and dilation of isolated lymphatic vessels [J]. Am J Physiol Heart Circ Physiol, 2009,296(2): H293-H302.
[14]李 涛,徐 竞,杨光明,等. RhoA调节失血性休克大鼠血管反应性的机制[J]. 中国病理生理杂志, 2009, 25(10): 1878-1882.
[15]杨光明, 徐 竞, 李 涛, 等. PKC -α、δ亚型在AVP改善缺氧处理VSMC反应性中的作用及其与MLC20磷酸化调节的关系[J]. 中国病理生理杂志, 2009, 25(1): 54-58.
[16]Davis MJ, Lane MM, Davis AM, et al. Modulation of lymphatic muscle contractility by the neuropeptide substance P [J]. Am J Physiol Heart Circ Physiol, 2008, 295(2): H587-H597.
[17]von der Weid PY, Zawieja DC. Lymphatic smooth muscle: the motor unit of lymph drainage[J]. Int J Biochem Cell Biol, 2004, 36(7): 1147-1153.
[18]Muthuchamy M, Zawieja D. Molecular regulation of lymphatic contractility [J]. Ann N Y Acad Sci, 2008, 1131(1): 89-99.
[19]Gashev AA, Davis MJ, Delp MD, et al. Regional variations of contractile activity in isolated rat lymphatics [J]. Microcirculation, 2004, 11(6): 477-492.
[20]von der Weid PY, Muthuchamy M. Regulatory mechanisms in lymphatic vessel contraction under normal and inflammatory conditions [J]. Pathophysiology, 2010, 17(4): 263-276.
Roleofmyosin-light-chainkinaseinbiphasiccontractileactivityoflymphaticsisolatedfromhemorrhagicshockrats
ZHANG Yu-ping, NIU Chun-yu, ZHAO Zi-gang, QIN Li-peng, SI Yong-hua, ZHANG Li-min, ZHANG Jing
(InstituteofMicrocirculation,DepartmentofPathophysiololgy,BasicMedicalCollege,HebeiNorthUniversity,Zhangjiakou075000,China.E-mail:ncylxf@126.com)
AIM: To elucidate the mechanism by which myosin-light-chain kinase (MLCK) modulates the biphasic contractile activity of lymphatics isolated from the rats subject to hemorrhagic shock (HS).METHODSMale Wistar rats were randomiz to control group and HS group. In HS group, the rats were subject to HS and then further divided into HS 0 h, 0.5 h, 1 h, 2 h and 3 h subgroups. Thoracic ducts of control and shock rats were isolated and used to determine the protein levels of phosphorylated MLCK (p-MLCK). In addition, thoracic ducts obtained from control, 0.5 h- and 2 h-shocked rats were used to observe the contractile properties of lymphatics by a pressure myographinvitro. Lymphatic rings were prepared and incubated with ML-7 (a specific inhibitor of MLCK) or substance P (SP, an agonist of MLCK). During the experiment, the contractile frequency (CF), end-diastolic diameter, end-systolic diameter and passive diameter in Ca2+-free PSS buffer were measured and used to calculate the lymphatic tonic index (TI), contractile amplitude (CA) and fractional pump flow (FPF) as the indexes of lymphatic contraction activity.RESULTSThe levels of p-MLCK in lymphatics in 0 h- and 0.5 h-shocked rats were significantly increased compared with the control rats, and it was gradually decreased with the development of shock. The values of CF, TI and FPF in 0.5 h-shocked lymphatics were significantly increased at transmural pressure of 1, 3 and 5 cmH2O compared with those in control group, and significantly blunted by ML-7. SP obviously increased the suppressive effects induced by ML-7 and restored the values of CF, TI and FPF to the levels of HS 0.5 h group. CF, TI and FPF in 2 h-shocked lymphatics significantly declined under different transmural pressure as compared with those in control group, and significantly elevated by SP. Similarly, ML-7 depressed the effects of SP. No significant difference was found in CA between 0.5 h- and 2 h-shocked lymphatics. SP decreased the CA of lymphatics obtained from 2 h-shocked rats and this effect was suppressed by ML-7. However, both agents had no effects on CA of 0.5 h-shocked lymphatics.CONCLUSIONMLCK, as an essential enzyme that influences the contraction of lymphatic smooth muscle cells, involves in the modulation of biphasic changes of lymphatic contractile activity during the process of HS.
Shock,hemorrhagic; Lymphatics; Contractility; Myosin-light-chain kinase
R364.1+4
A
10.3969/j.issn.1000-4718.2012.04.003

