胰腺导管腺癌和肿块型慢性胰腺炎的化学位移法胰腺水脂比例分析
刘敬禹 田建明 黄文才 陈士跃 陆建平
·论著·
胰腺导管腺癌和肿块型慢性胰腺炎的化学位移法胰腺水脂比例分析
刘敬禹 田建明 黄文才 陈士跃 陆建平
目的探讨胰腺导管腺癌(PDAC)和肿块型慢性胰腺炎(MFP)胰腺水脂比例,为临床诊疗工作提供参考。方法运用GE 3.0T MR扫描仪对13例PDAC患者、8例MFP患者以及20名健康志愿者进行胰腺三点法水脂分离技术(IDEAL)序列扫描,对所得图像进行信号强度测量,利用水脂比例(WF1)=水相信号强度(SW)/脂相信号强度(SF)及水脂比例(WF2)=[同相位信号强度(SIP)+ 反相位信号强度(SOP)]/(SIP-SOP)两种公式进行水脂比例分析。结果运用WF1公式,正常胰腺水脂比例为7.97±0.95,PDAC为9.94±1.19,MFP为5.08±0.49;运用WF2公式,正常胰腺水脂比例为11.51±1.62,PDAC为13.87±1.84,MFP为5.73±0.65。同一公式下,正常胰腺、PDAC和MFP的胰腺水脂比例差异有统计学意义(P<0.05)。PDAC组WF2值>WF1值,并且差异有统计学意义。结论正常胰腺及PDAC与MFP的胰腺水脂比例不同,PDAC的比值最高,其次是正常胰腺,MFP的比值最低。
胰腺; 胰腺炎; 胰腺肿瘤; 磁共振成像
胰腺导管腺癌(pancreatic ductal adenocar-cinoma, PDAC)与肿块型慢性胰腺炎(mass-forming focal chronic pancreatitis, MFP)在临床症状及影像学表现上都极其相似,但两者的治疗和预后不同。对两者做出正确的鉴别诊断有助于指导临床的治疗计划,从而避免对PDAC的延误诊治及对MFP的扩大治疗。虽然随着CT及MR技术的提高,对于病灶的细节显示更加清晰,增强后能提供更多的信息,然而单纯影像形态学的分析已难以满足对两者的鉴别诊断。目前许多学者认为,胰腺多种病变均可引起其水脂含量的改变,因此胰腺水脂比例的分析对疾病的诊断有重要价值。磁共振化学位移成像可以通过定量分析同相位及反相位图像上信号变化来测定肝脏脂肪含量[1-2],同样也可以测定其他组织中水含量。本研究通过三点法水脂分离技术(Iterative Dixon water-fat separation with Echo Asymmetry and Leastsquares estimation, IDEAL)序列对胰腺进行水脂比例分析,旨在探讨PDAC和MFP患者病灶水脂比例的差异。
材料和方法
一、研究对象
收集2010年9月至2011年1月收治的13例PDAC及8例MFP患者。PDAC患者中男性7例,女性6例,年龄43~67岁,平均54岁;5例经手术病理证实,8例在超声引导下经皮细针穿刺(FNA)组织细胞学检查证实。MFP患者中男性4例,女性4例,年龄47~60岁,平均55岁;3例经超声引导下FNA组织细胞学检查证实,5例经随访半年以上临床证实。以同期20例健康志愿者作为对照,其中男性8例,女性12例,年龄23~55岁,平均43岁。
二、磁共振扫描
应用GE Signa Excite 3.0T超导型磁共振仪(通用电气公司,美国),8通道相控阵表面线圈。检查前患者空腹4 h,取仰卧位,行IDEAL序列扫描。参数:TR/TE 5400/68 ms;TI 180 ms;FOV 30.0 cm;矩阵 320×192;层厚6 mm;层间距0 mm;扫描时间约240 s。
通过GE系统工作站采集数据。用工作站自带软件对图像信号强度进行测量,并经计算机重建生成4种图像:水相(W)、脂相(F)、同相位(in-phase, IP)、反相位(out-of-phase, OP),分别见图a~d。对同一患者在相同层面同一位置测量4种图像的信号强度。测量时要确定4种图像在同一层面;感兴趣区(region of interest, ROI)在器官解剖同一位置,面积在40~60 mm2。因ROI不能一次性包括器官整体结构,故采用多点取值(2次以上,图e),并取均值。
水脂含量分析公式有两种。一种是运用水相和脂相计算,即水脂比例(WF1)=水相信号强度(SW)/脂相信号强度(SF);另一种计算方法利用IP相和OP相计算,即水脂比例(WF2)=[同相位信号强度(SIP)+ 反相位信号强度(SOP)]/(SIP-SOP)。
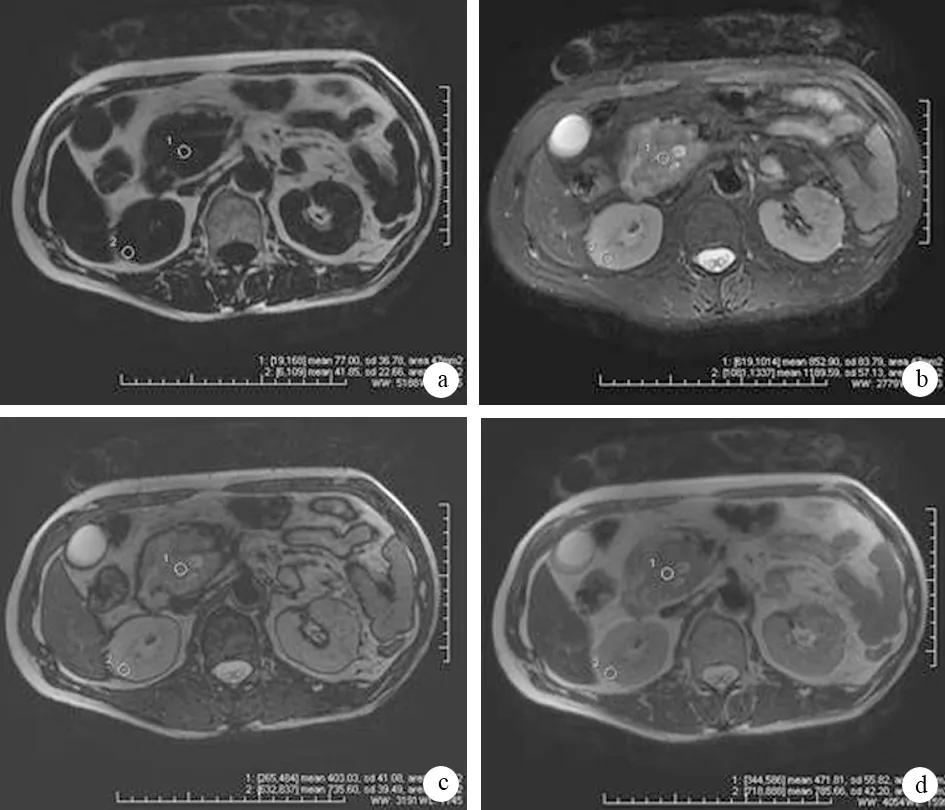
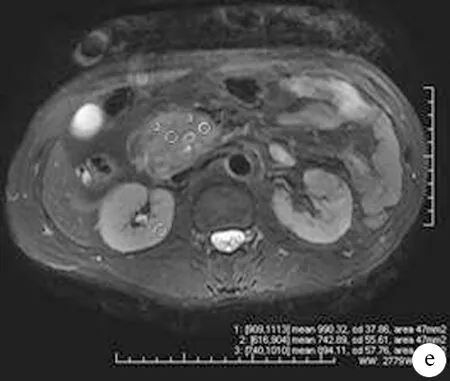
图1IDEAL序列扫描后生成的水相图(a)、脂相图(b)、同相位图(c)、反相位图(d)及对同一病灶进行多点测试图(e)
三、病理学检查
取得的病理标本行HE染色后,经有经验的病理科医师在低倍光镜下(10×10)对标本的组成进行分类评估,并记录不同成分的百分比。
四、统计学分析
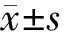
结 果
一、健康志愿者胰腺水脂分析
按WF1公式计算,胰头水脂比例为7.97±0.95,胰体尾为8.04±0.81,两者差异无统计学意义(t=0.073,P=0.942)。按WF2公式计算,胰头水脂比例为11.51±1.62,胰体尾为11.35±1.52,两者差异无统计学意义(t=0.197,P=0.860),但均显著高于同部位WF1的计算值(t=6.687,P<0.001;t=6.524,P<0.001)。同一公式下,同一部位、不同年龄组间差异无统计学意义(表1)。
二、PDAC与MFP水脂分析
PDAC的WF1、WF2值分别为9.94±1.19、13.87±1.84,WF2值显著高于WF1值;MFP的WF1、WF2值分别为5.08±0.49、5.73±0.65,WF1与WF2值间差异无统计学意义。但应用同一个公式计算,PDAC的值均显著高于MFP的值(表2)。

表1 健康志愿者不同年龄组水脂比例分析

表2 PDAC与MFP患者水脂比例分析
三、病理学改变
无论是PDAC,还是MFP,光镜下可见病变主要由3种成分组成:腺泡或腺泡样结构、纤维组织、炎性细胞。MFP主要表现为残存的正常腺泡周围包裹有大量纤维成分,残存的腺泡周围及周围纤维组织中浸润有炎性细胞,3种成分的比例分别占(27±5)%、(44±10)%、(28±12)%。PDAC主要表现为异型细胞组成的腺泡样结构,且与正常腺泡比较,大小不一,形态欠规整,细胞成分或者腺泡内成分占优势,周围包裹有纤维组织,并见炎性细胞,3种成分的比例分别为(57±11)%、(30±12)%、(13±10)%。
讨 论
所谓化学位移(chemical shift)是指在不同化学环境中的相同原子核在外磁场作用下表现出稍有不同的共振频率的现象。在对人体进行MRI检查时,虽然人体内脂肪与水中均含氢核即1H,但是由于水中的1H与氧相连,脂肪中的1H与碳相连,也就是说1H在脂肪与水中的化学环境的差异使其产生化学位移。在脂肪中1H的共振频率小于水中1H的共振频率。一般来说,主磁场越强,化学位移越大。在低场强时,这种差异并不显著[3]。
根据化学位移法成像原理,同相位图像和反相位图像会交替出现。在反相位图像上水脂混合组织信号会有明显衰减,而纯脂肪组织信号不会有明显衰减[4],但肉眼观察时难免会产生误差,难以准确估算其水脂比例,因此图像的信号强度测量是必须的。
IDEAL序列利用1H在不同组织中的化学位移不同的特性,实现组织中的脂肪及水信号分离,能够一次扫描后得到4种图像,优化了水脂分离显像,并可有效消除水脂信号混淆给临床诊断带来的干扰。
Schwenzer等[5]证明IP/OP技术用于评估胰腺脂肪含量是可靠的。Le等[6]研究发现,西班牙人的胰腺脂肪含量明显高于非洲裔美国人,且随年龄的增长这种差异逐渐变大,此外相同年龄组男性的脂肪含量要高于女性。本组23~55岁的健康者的胰腺头部和体尾部水脂比例没有明显差异;不同年龄组、不同部位水脂比例亦没有明显差异,与Le的研究结果明显不同。分析原因可能有以下几点:(1)本研究收集的志愿者的年龄区间相对有限,病例数相对较少;(2)亚洲人的胰腺脂肪含量可能与西班牙及非洲裔美国人有差异;(3)Le等所测量的是胰腺的脂肪含量,本研究计算的是水脂比例,两者计算公式的不同可能导致差异。
本组分析了PDAC患者和MFP患者胰腺的水脂比例,结果显示,MFP患者胰腺的水脂比例小于PDAC患者。从病理上分析,MFP可以始发于胰腺间质细胞、胰管及腺泡上皮细胞[7],可以表现为胰腺内胶原沉积、毛细血管数量减少、纤维化等,其中相对特异的改变是胰腺实质的纤维化[8]。由于病灶处大部为纤维化组织取代,腺泡减少,分泌量减少,导致组织水含量减少。PDAC由多种组织混杂而成,包括肿瘤细胞和残存的胰腺组织及其组成的腺泡及类腺泡样结构、纤维成分、炎性细胞等,在诸多的成分中,并无明显分界,而且往往以一种或几种成分为主[9],因此在肿瘤细胞或者腺泡占优势的情况下,病灶组织水含量较不伴发急性炎症的MFP病灶组织高。
但本研究病例数有限,所选择患者不伴发明显的急性炎症。而在临床工作中所遇到的PDAC及MFP患者多数症状较重,伴发急性炎症,因此本研究结果对两者的鉴别价值的大小有待进一步考证。此外,普通病理切片行HE染色时,脂肪细胞往往被洗脱掉,难以对其定量。因此对两者脂肪含量的改变亦有待进一步深入。
根据我们测量所得到的结果,两种公式所得到的比例虽趋势相同,但数值大小有差异,由此可见同相位与反相位图像的信号强度并不是水脂信号的单纯相加和相减。然而现有的文献中,对于水脂信号的处理基本以单纯的相加与相减为主[10-12]。笔者认为,目前的计算能够一定程度反应病灶水脂变化趋势,但对于其精确比例的计算有待探讨。
[1] Kim H, Taksali SE, Dufour S,et al. Comparative MR study of hepatic fat quantification using single-voxel proton spectroscopy, two-point dixon and three-point IDEAL. Magn Reson Med,2008,59:521-527.
[2] Guiu B,Petit JM,Loffroy R,et al. Quantification of liver fat content: comparison of triple-echo chemical shift gradient-echo imaging and in vivo proton MR spectroscopy.Radiology,2009,250:95-102.
[3] 张秀梅,金宝荣.MRI中化学位移的利弊及临床意义.数理医药学杂志,2006,19:77-78.
[4] 杨正汉.磁共振成像技术指南.北京:人民军医出版社,2010:196-199.
[5] Sehwenzer NF,Maehann J,Martirosian P,et al.Quantification of pancreatic lipomatosis and liver steatosis by MRI:comparison of in/opposed-phase and spectral-spatial excitation techniques.Invest Radiol,2008,43:330-337.
[6] Le KA,Ventura EE,Fisher JQ,et al. Ethnic differences in pancreatic fat accumulation and its relationship with other fat depots and inflammatory markers.Diabetes Care,2011,34:485-490.
[7] Klöppel G,Detlefsen S,Feyerabend B.Fibrosis of the pancreas:the initial tissue damage and the resulting pattern.Virchows Arch,2004,445:1-8.
[8] Apte MV,Wilson JS.Mechanisms of pancreatic fibrosis.Dig Dis,2004,22:273-279.
[9] NinoMurcia M, Jeffrey RB Jr. Multidetector-row CT and volumetric imaging of pancreatic neoplasms.Gastroenterol Clin North Am,2002,31:881-896.
[10] Kim H, Taksali SE, Dufour S,et al. Comparative MR study of hepatic fat quantification using single-voxel proton spectroscopy, two-point dixon and three-point IDEAL. Magn Reson Med,2008,59:521-527.
[11] Namimoto T,Yamashita Y,Mitsuzaki K,et al. Adrenal masses: quantification of fat content with double-echo chemical shift in-phase and opposed-phase FLASH MR images for differentiation of adrenal adenomas. Radiology,2001,218:642-646.
[12] Guiu B,Petit JM,Loffroy R,et al. Quantification of liver fat content: comparison of triple-echo chemical shift gradient-echo imaging and in vivo proton MR spectroscopy.Radiology,2009,250:95-102.
Pancreaticductaladenocarcinomaandmass-formingfocalchronicpancreatitis:water/fatanalysisbyusingchemicalshiftmethod
LIUJing-yu,TIANJian-ming,HUANGWen-cai,CHENShi-yue,LUJian-ping.
DepartmentofRadiology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
TIANJian-ming,Email:tianjianming1952@hotmail.com
ObjectiveTo study the water/fat ratio of patients with pancreatic ductal adenocarcinoma (PDAC) and mass-forming focal chronic pancreatitis (MFP), and to provided guide for the clinicians.MethodsThirteen patients with PDAC, 8 patients with MFP and 20 healthy volunteers were scanned by GE 3.0T MR IDEAL sequence. The signal strength of outcome images was measured; the water/fat ratio analysis was performed. Two kinds of formula were applied, the first was WF1=SW/SF, the second was WF2=(SIP+SOP)/(SIP-SOP). SW was the signal strength of water, SF was the signal strength of fat, and SIP was the signal strength of in-phase, while SOP was the signal strength of opposite phase.ResultsBy using the WF1 formula, the water/fat ratio of normal pancreas, PDAC, MFP was 7.97±0.95, 9.94±1.19, 5.08±0.49, respectively. By using the WF2 formula, the water/fat ratio of normal pancreas, PDAC, MFP was 11.51±1.62, 13.87±1.84, 5.73±0.65, respectively. The difference among the three groups was statistically significant (P<0.05) under the same formula. The value of WF2 was higher than that of WF1, the difference in PDAC groups was also statistically significant (P<0.05).ConclusionsThe water/fat ratio of pancreas among PDAC, MFP and normal pancreas is different. PDAC has the highest water/fat ratio, followed by the normal pancreas; MFP has the lowest ratio.
Pancreas; Pancreatitis; Pancreatic neoplasms; Magnetic resonance imaging
10.3760/cma.j.issn.1674-1935.2012.02.010
200433 上海,第二军医大学长海医院影像科
田建明,Email:tianjianming1952@hotmail.com
2011-06-28)
(本文编辑:吕芳萍)

