药理浓度抗坏血酸诱导胰腺癌PANC1细胞的死亡方式及机制研究
高燕 粱丹红 宋薇 杜冀晖 张厚德 徐克成
·论著·
药理浓度抗坏血酸诱导胰腺癌PANC1细胞的死亡方式及机制研究
高燕 粱丹红 宋薇 杜冀晖 张厚德 徐克成
目的探讨抗坏血酸(Asc)对胰腺癌PANC1细胞的生物学影响及其作用机制。方法PANC1细胞用不同浓度(0~40 nmol/L)Asc处理24、48、72 h。采用四甲基偶氮唑蓝(MTT)法观察Asc对胰腺癌PANC1细胞增殖的影响,流式细胞仪检测细胞周期及凋亡率,倒置显微镜和透射电镜观察细胞形态,应用JC-1染色流式细胞仪检测线粒体膜电位。同时,观察Asc对抗氧化剂过氧化氢酶(catalase)及红细胞(RBC)预处理的PANC1细胞形态及线粒体膜电位的影响。结果药理浓度Asc选择性抑制PANC1细胞增殖,并呈浓度、时间依赖性。5 mmol/L Asc处理后PANC1细胞被阻滞在G2/M期[(32.55±7.14)% 比(22.00±1.27)%,t=5.808,P<0.05],但凋亡率未见增加[(1.98±1.80)% 比(1.09±0.16)%]。≥5 mmol/L Asc诱导PANC1细胞发生胀亡性死亡,细胞线粒体膜电位呈浓度依赖性明显降低。catalase及RBC预处理能明显抑制细胞线粒体膜电位的下降,减轻细胞发生胀亡的程度。结论Asc在体外对胰腺癌PANC1细胞有明显的增殖抑制作用。Asc诱导PANC1细胞发生胀亡性死亡,而不是凋亡,其机制可能与线粒体膜电位下降有关。
胰腺肿瘤; 抗坏血酸; 细胞死亡; 过氧化氢; 线粒体膜电位
抗坏血酸(ascorbic acid,Asc)又称维生素C,它在肿瘤治疗中的作用一直颇具争议。近几年的药代动力学研究发现,Asc通过不同途径给药(静脉、口服)产生的血药浓度完全不同,不具有可比性[1]。自此人们开始重新认识Asc的抗肿瘤作用。Chen等[2-3]最近报道,静脉给药能获得的药理浓度使Asc具有选择性杀伤肿瘤细胞的作用,这种杀伤作用与过氧化氢的产生有关。另一方面,Asc作为营养补充剂广泛应用于临床已多年,具有安全、低廉、无明显不良作用的优点,故其抗肿瘤作用更加引人注意。目前尚未见Asc对胰腺癌作用的相关报道。为此,本研究观察Asc对胰腺癌PANC1细胞株的生物学效应,初步探究其作用机制,为寻找治疗胰腺癌的理想药物提供线索。
材料与方法
一、细胞增殖检测
人胰腺癌细胞株PANC1和正常人肝细胞株HL-7702由深圳市第六人民医院中心实验室馈赠,常规培养、传代。接种适量对数生长期细胞于96孔培养板,实验分Asc组、三氧化二砷(As2O3)组、过氧化氢(H2O2)组和常规培养对照组。Asc组培养液内加入0.3、1.0、2、5、10、15、20、40 mmol/L的Asc(Sigma公司);As2O3组加入32 μmol/L的As2O3;H2O2组加入50 μmol/L的H2O2;只加培养液作空白对照。每组设3个复孔。加药后培养24、48、72 h,采用四甲基偶氮唑蓝(MTT)法检测。以空白对照孔调零,酶标仪测定各孔490 nm波长的吸光度(A490值)。细胞存活率(%)=(实验组A490值-空白组A490值)/ (对照组A490值-空白组A490值)×100%。应用GraphPad Prism软件绘制剂量反应曲线,并计算半数抑制浓度(IC50值)。
二、细胞死亡检测
制备各组细胞爬片,每6 h在倒置显微镜下观察细胞形态变化并摄片。
另将PANC1细胞接种至75 cm2培养瓶中,应用10 mmol/L Asc处理12、24 h,用细胞刮收集约5×106个细胞至EP管,离心弃上清,加入电镜固定液1 ml,再次离心后4℃保存送检。经脱水、浸透、包埋、修块、制备切片后用透射电子显微镜(Philips CM10型)观察细胞超微结构。
三、细胞周期及凋亡检测
PANC1细胞接种于24孔板,分别加入0.3、5、20 mmol/L的Asc,32 μmol/L的As2O3,50 μmol/L的H2O2,以PBS作为阴性对照,继续培养48 h。收集各孔细胞至相应流式管,离心、弃上清,加入PI染液(0.1 g/L)0.5 ml/管,4℃避光染色30 min,于1 h内流式细胞仪检测,利用MultiCycle 软件行细胞周期分析,亚二倍体(Sub)-G1期细胞比率即为凋亡率。
四、细胞线粒体膜电位(△Ψm)的检测
采用线粒体膜电位检测试剂盒(JC-1,Sigma公司)。PANC1细胞接种于24孔板。分为阴性对照组,5、20 mmol/L Asc组,H2O2组(50 μmol/L)和CCCP组(CCCP为线粒体电子传递链抑制剂,作为阳性对照),培养24 h。CCCP在收集细胞前30 min加入,终浓度10 μmol/L。收集细胞,离心去上清,调整每个试管细胞数为1.5×105个,每管加入500 μl JC-1(5×)染色工作液,混匀,37℃避光孵育20 min,用JC-1(1×)缓冲液1 ml洗涤2次,弃上清后每管用500 μl JC-1(1×)缓冲液悬浮细胞。流式细胞仪检测荧光颜色(激发波长490 nm,发射波长530 nm)。MnY/MnX示红色荧光与绿色荧光的比值,比值降低提示线粒体膜电位降低。FL-Green表示绿色荧光所占百分比,其值越高提示线粒体膜电位下降越明显。
五、过氧化氢酶(catalase)干预
应用细胞外抗氧化剂过氧化氢酶(catalase,Sigma 公司,100 μg/ml)预处理细胞30 min,再加入10 mmol/L Asc作用24 h,分别行电镜观察及线粒体膜电位(△Ψm)检测。
六、红细胞干预
取健康人肝素抗凝血2 ml,离心沉淀红细胞(RBC)。吸取RBC,按25%、50%的血细胞比容(HCT)比例加入PANC1细胞培养体系,再分别加入0.3、1.0、2、5、10、15、20、40 mmol/L Asc作用1 h,弃上清,PBS液洗涤1次去除RBC,加入完全培养液继续培养24 h后分别进行电镜观察及MTT检测。
七、统计学处理
结 果
一、Asc对PANC1细胞增殖的影响
随着Asc浓度增加、作用时间延长,PANC1细胞存活率逐渐降低(图1)。Asc处理PANC1细胞24、48、72 h的IC50分别为4.432、2.070、1.093 mmol/L。同等条件下Asc对正常人肝细胞株HL-7702生长无明显抑制作用,其IC50>100 mmol/L。两者差异具有统计学意义(t=-22.265,P<0.01)。
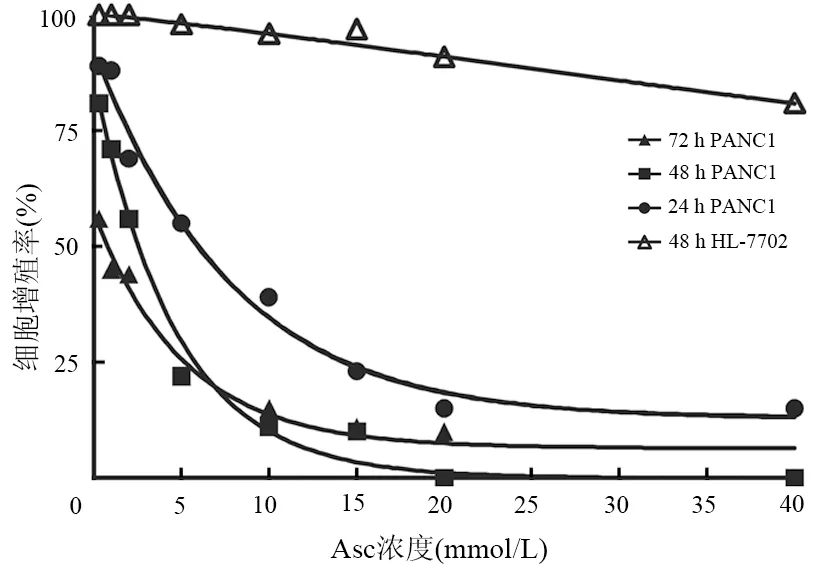
图1 不同Asc浓度、不同培养时间PANC1细胞的存活率
二、细胞形态及超微结构的变化
作用12 h开始,≥5 mmol/L的Asc各组和H2O2处理组细胞的体积变大,密度稀疏;24 h时见大量细胞肿胀、变大、变圆;48 h时细胞溶解成碎片、崩解死亡。As2O3组24 h可见悬浮细胞明显增多,细胞固缩、体积变小呈圆形,细胞质内颗粒明显,细胞碎片较少(图2)

图2对照组(a),10 mmol/L Asc处理24(b)、48 h(c)组,H2O2组(d),As2O3组(e)PANC1细胞的形态学改变(×100)
对照组细胞外形完整,膜上绒毛丰富,线粒体等细胞器形态正常(图3a)。10 mmol/L Asc处理组12 h时见线粒体肿胀,内嵴减少缩短,细胞核染色质疏松(图3b),24 h时整个细胞类似气球样变,胞质中见大量空泡形成,线粒体肿胀、嵴消失,胞核肿胀、核内染色质分散、凝集在核膜及核仁周围,以后核溶解,外膜消失、基质透明呈气球样,未见凋亡小体及凋亡表现(图3c)。H2O2处理组细胞超微结构变化与Asc组相似(图3d)。

图3对照组(a),ASc 12 h(b)、24 h(c)组,H2O224 h组(d)细胞的超微结构(×5000)
三、细胞周期及凋亡率
Asc作用于PANC1细胞48 h后,G2/M期细胞呈剂量依赖性明显增多,5、20 mmol/L组与对照组比较差异均具有统计学意义(t=5.808、7.821,P值均<0.05;表1);G0/G1期细胞比例逐渐减少,20 mmol/L组与对照组比较差异具有统计学意义(t=5.464,P<0.05);Sub-G1期细胞比例无明显变化。H2O2组细胞的周期变化与Asc组一致(表1)。As2O3组细胞的Sub-G1期细胞比例明显升高,与对照组比较差异具有统计学意义(t=12.686,P<0.05;表1)。

表1 各组PANC1细胞周期的变化
注:与对照组比较,aP<0.05
四、PANC1细胞线粒体膜电位(△Ψm)变化
Asc处理后细胞线粒体膜电位呈剂量依赖性明显降低,表现为MnY/MnX的比值下降和FL-Green百分比增加,与H2O2组变化一致(表2)。
五、Catalase对Asc介导的PANC1细胞死亡的影响
Catalase预处理30 min再经10 mmol/L Asc处理,细胞体积略增大,线粒体、胞核肿胀程度均较未预处理组明显减轻(图4a),而细胞线粒体膜电位较未处理组明显增加,恢复到对照组水平(表2)。


组别MnY/MnXFL⁃Green(%)对照组3.61±0.24.45±0.27Asc 5mmol/L组3.04±0.12a8.47±0.97a 20mmol/L组2.35±0.03ab14.40±0.50abCCCP组1.94±0.21a56.2±2.55aH2O2组3.10±0.11a9.8±1.13aAsc5mmol/L+catalase组3.53±0.23c5.29±0.07cAsc20mmol/L+catalase组3.39±0.15c7.6±1.04c
注:与对照组比较,t=3.374~30.328,aP<0.05;与5 mmol/L Asc组比较,t=3.413、-9.412,bP<0.05;与相应Asc组比较,t=-3.272、5.664、11.776、10.207,cP<0.05
六、RBC对Asc介导的PANC1细胞死亡的影响
PANC1细胞培养体系加入不同比积的RBC以模拟血管内环境,再经5 mmol/L Asc处理后,PANC1细胞较未加RBC组体积略增大,线粒体、胞核肿胀均明显减轻,细胞胀亡性损伤的表现亦明显减轻(图4b)。对照组、加25%及加50% RBC的对照组的细胞存活率分别为(90.00±4.11)%、(87.62±3.88)%、(93.25±4.03)%,无明显变化。Asc处理组、加25%及加50%RBC的Asc处理组的细胞存活率分别为(33.16±4.39)%、(81.22±3.81)%、(88.94±4.53)%,逐渐恢复到对照组水平。其Asc的IC50为40.63 mmol/L,明显高于未加RBC的IC50(4.432 mmol/L,t=3.374,P<0.01)。

图4 经catalase、RBC干预后的细胞超微结构(×500)
讨 论
对于肿瘤患者是否应该使用Asc的争论持续了多年。早在上世纪七十年代,著名的诺贝尔奖获得者Pauling就发表了每日10g Asc可延长肿瘤患者生存时间的论文[4-5]。但随后,在Mayo医院进行的两项双盲对照研究中,研究者发现每日10 g Asc对肿瘤患者生存并没有明显影响[6-7]。于是,Asc作为抗肿瘤药被弃用。随着Asc药代动力学研究的深入,人们对它在肿瘤治疗中的作用有了全新的认识。近年的研究[1]显示,相同剂量Asc通过不同的给药途径所产生的血浆浓度截然不同,静脉给予10 g Asc所产生的血药浓度可达约6 mmol/L,是同一剂量口服给药所产生的血药浓度的25倍以上。静脉给药所产生的血药浓度可达0.3~15 mmol/L,而口服给药所产生的最大血药浓度不超过0.22 mmol/L。Pauling等当时采用的是口服与静脉给药,而Mayo医院采用的仅仅是口服给药,所以这些研究结果之间无法进行比较。由此,Asc的抗肿瘤作用重新引起了人们的兴趣。最近,Chen等[2-3]模拟临床静脉给药途径重新对Asc的抗肿瘤作用进行研究,发现药理浓度Asc对一些肿瘤细胞具有选择性杀伤作用,而这种作用与细胞外过氧化氢的产生有关。但Asc对胰腺癌细胞作用尚不清楚。
本研究结果显示,Asc对胰腺癌PANC1细胞增殖有明显的抑制作用,并呈浓度、时间依赖性。药理浓度Asc对PANC1细胞有显著的细胞毒作用,但对正常人肝细胞株HL-7702生长无明显抑制,表明Asc对肿瘤细胞具有选择性杀伤作用。从细胞周期来看,Asc使PANC1细胞受阻于G2/M期,但对Sub-G1期细胞比例无明显影响,表明Asc抑制PANC1细胞增殖,但并未诱导凋亡。
本研究通过光镜及电镜观察,发现经Asc作用后,胰腺癌PANC1细胞形态学变化特征明显有别于经典的凋亡表现,而与近年来提出的一种细胞死亡方式——胀亡(oncosis)一致[8-10]。同时,Asc可导致PANC1细胞线粒体膜电位降低。细胞外抗氧化剂catalase能明显抑制Asc介导的细胞线粒体膜电位下降,减轻细胞发生胀亡的程度。提示Asc介导的PANC1细胞死亡可能与细胞外某种能被catalase抑制的物质诱导线粒体膜电位下降有关。而红细胞可拮抗Asc对PANC1细胞的细胞毒作用,提示Asc诱导的这种物质的产生发生在组织中,而不是血管中。
对于Asc介导的细胞死亡机制,Chen等[2-3]报道,药理浓度Asc对肿瘤细胞的杀伤作用直接与细胞外Asc作为电子供体诱导H2O2产生相关,也就是说Asc是通过作为前药传递H2O2至组织而对肿瘤细胞产生细胞毒作用的。本结果显示,H2O2对PANC1细胞产生的生物学效应与Asc及其相似。结合catalase能明显抑制Asc介导的细胞线粒体膜电位下降,减轻细胞发生胀亡的程度以及Chen等的研究结果,我们推断细胞外某种能诱导线粒体膜电位下降的物质就是H2O2。有研究报道,活性氧族(包括H2O2)可能通过对膜蛋白造成氧化损伤、线粒体通透性增加、抑制呼吸链的电子传递、ATP 水平下降等机制参与细胞胀亡的发生[11],由此我们推测Asc介导产生的H2O2可能是通过降低线粒体膜电位,干扰线粒体能量合成,进而介导PANC1细胞发生缺乏ATP的被动死亡——胀亡。RBC拮抗Asc对PANC1细胞毒作用的结果进一步证实Asc诱导的H2O2产生发生在组织中,而不是血管中。这与红细胞内丰富的catalase和谷胱甘肽过氧化物酶使血管内Asc产生的H2O2被快速分解代谢有关[12]。所以只有转运至组织中的Asc产生的H2O2可以聚集起来发挥细胞毒作用,这也解释了为什么只有达到一定浓度的Asc才具有杀伤作用,而口服给药因产生的血药浓度过低,转运至组织的Asc过少而无法起效。那么,在人体应用时,究竟有多少Asc能逃过血管内丰富的抗氧化剂的分解代谢作用进入组织内?Asc在体内能产生和体外一样的效应吗?这些问题值得进一步研究。
[1] Padayatty SJ, Sun H, Wang Y, et al. Vitamin C pharmacokinetics: implications for oral and intravenous use. Ann Intern Med, 2004, 140: 533-537.
[2] Chen Q, Espey MG, Krishna MC,et al.Pharmacologic ascorbic acid concentrations selectively kill cancer cells: action as a pro-drug to deliver hydrogen peroxide to tissues. Proc Natl Acad Sci USA, 2005,102:13604-13609.
[3] Chen Q, Espey MG, Sun AY, et al. Ascorbate in pharmacologic concentrations selectively generates ascorbate radical and hydrogen peroxide in extracellular fluid in vivo. Proc Natl Acad Sci USA, 2007,104:8749-8754.
[4] Cameron E, Pauling L. Supplemental ascorbate in the supportive treatment of cancer: Prolongation of survival times in terminal human cancer. Proc Natl Acad Sci USA, 1976,73:3685-3689.
[5] Cameron E, Pauling L. Supplemental ascorbate in the supportive treatment of cancer:reevaluation of prolongation of survival times in terminal human cancer. Proc Natl Acad Sci USA, 1978,75:4538-4542.
[6] Creagan ET, Moertel CG, O′Fallon JR, et al. Failure of high-dose vitamin C(ascorbic acid) therapy to benefit patients with advanced cancer.A controlled trial. N Engl J Med,1979, 301: 687-690.
[7] Moertel CG, Fleming TR, Creagan ET, et al. High-dose vitamin C versus placebo in the treatment of patients with advanced cancer who have had no prior chemotherapy. A randomized double-blind comparison. N Engl J Med,1985, 312:137-141.
[8] Saraste A. Morphologic criteria and detection of apoptosis. Herz, 1999,24:189-195.
[9] Trump BF, Berezesky IK, Chang SH, et al. The pathways of cell death: oncosis, apoptosis, and necrosis. Toxicol Pathol, 1997,25:82-88.
[10] Majno G, Joris I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol, 1995,146:3-15.
[11] Saikumar P, Dong Z, Patel Y, et al. Role of hypoxia-induced Bax translocation and cytochrome c release in reoxygenation injury. Oncogene, 1998, 17: 3401-3415.
[12] Motoyama S, Saito S, Inaba H, et al. Red blood cells attenuate sinusoidal endothelial cell injury by scavenging xanthine oxidase-dependent hydrogen peroxide in hyperoxic perfused rat liver. Liver, 2000, 20: 200-208.
ThedeathwayanditsmechanismsofpancreaticcancerPANC1cellsinducedbypharmacologicascorbicacidconcentrations
GAOYan,LIANGDan-hong,SONGWei,DUJi-hui,ZHANGHou-de,XUKe-cheng.
NanshanHospital,GuangdongMedicalCollege,Shenzhen518052,China
ZHANGHou-de,Email:szzhanghoude@126.com
ObjectiveTo investigate the biological effects and its mechanisms of ascorbic acid on pancreatic cancer PANC1 cells.MethodsPANC1 cells were treated by ascorbic acid of different concentrations (0~40 mmol/L) for 24,48,72 hours. The proliferation of PANC1 cells was analyzed by MTT method; cell cycle and apoptosis were assessed by flow cytometry (FCM); inverted microscopy and transmission electron microscopy were used to observe cell morphology. The membrane potential of mitochondria were mearured by with JC-1 staining and FCM. Meanwhile, the changes of cell morphology and mitochondrial membrane potential induced by ascorbic acid after pretreatment with hydrogen peroxide-scavenging enzyme (catalase) and red blood cells were also detected.ResultsAscorbic acid in pharmacologic concentrations selectively inhibited the proliferation of PANC1 cells in a dose and time dependent manner. PANC1 cells were arrested in G2/M phase after treatment with 5 mmol/L ascorbic acid [(32.55±7.14)%vs(22.00±1.27)%,t=5.808,P<0.05], but there was no changes on apoptosis rate [(1.98±1.80)%vs(1.09±0.16)%]. Inverted microscope and transmission electron microscopy showed that oncosis-like cell death of PANC1 cells was induced after treatment with ≥5 mmol/L ascorbic acid. Mitochondrial membrane potential of PANC1 cells was significantly lower than that of the control group in a dose dependent manner. The descent of mitochondrial membrane potential was significantly inhibited by pretreatment with catalase and red blood cells, and the degree of cell oncosis was attenuated.ConclusionsAscorbic acid significantly inhibited the proliferation of pancreatic cancer PANC1 cells in vitro. Ascorbic acid induced PANC1 cell oncosis, but not apoptosis. The possible mechanisms of inducing oncosis may be related to the descent of mitochondrial membrane potential.
Pancreatic neoplasms; Ascorbic acid; Cell death; Hydrogen peroxide; Membrane potential, mitochondrial
10.3760/cma.j.issn.1674-1935.2012.02.007
辽宁省博士启动基金(20081044);辽宁省教育厅基金(L2010627)
518052 深圳,广东医学院附属南山医院消化内科(高燕、杜冀晖、张厚德);东莞市中医院消化内科(梁丹红);广东省中医院内分泌科(宋薇);广州复大肿瘤医院(徐克成)
张厚德,Email:szzhanghoude@126.com
2011-09-06)
(本文编辑:屠振兴)

