超滤制备海带岩藻聚糖的工艺研究
王 健,吴永沛,于立国
(集美大学生物工程学院,福建厦门 361021)
超滤制备海带岩藻聚糖的工艺研究
王 健,吴永沛*,于立国
(集美大学生物工程学院,福建厦门 361021)
本文以海带为原料,研究应用超滤技术提取岩藻聚糖的工艺技术参数,研究结果表明:冷浸提法可以防止岩藻聚糖的降解;pH低于2.5时80%以上的褐藻酸会被除去;超滤过程中,压力在0.1~0.3MPa范围内随着压力的升高膜通量升高;浸提液经稀释0~2倍下膜通量升高,多糖得率变化不大。研究结论:在4℃下以料液比1∶30浸提5h所得浸提液,调pH至2.0以除去褐藻酸,补蒸馏水至3000mL,采用50ku超滤膜组件在0.2MPa下超滤纯化岩藻聚糖,经醇沉冷冻干燥制得高纯度海带岩藻聚糖干品,其得率为2.32%,总糖含量为38.24%,硫酸基团含量达到21.49%。
海带,岩藻聚糖,超滤
岩藻聚糖是具有多种生物活性的硫酸多糖[1],主要含有L-岩藻糖和硫酸基团,除此之外还含有半乳糖、甘露糖、葡萄糖、糖醛酸、木糖、鼠李糖、阿拉伯糖、氨基己糖等,化学成分极为复杂,具有抗病毒、抗凝血、抑制肿瘤以及调节免疫等功能[2-3]。岩藻聚糖分子量分布很广,从几万到上百万,具有种属差异性[4]。海带中含有丰富的岩藻聚糖,在功能性食品、医药等方面具有广阔的应用前景。福建省海岸线长,海带养殖基地带已成规模,为海带深加工奠定了基础。膜分离技术是一门新兴多学科交叉的分离纯化技术,由于其在分离过程中不发生相变,选择性高,低能耗,可在常温和低温下进行操作,适合处理具有热敏性和生物活性的物质[5-6],现已广泛应用于果蔬汁加工、纺织印染及中药分离纯化等领域[7],近年来发展十分迅速,尤其在食品行业中应用广泛。本论文以过80目筛的海带粉为原料,采用超滤膜分离纯化分子量50ku以上的天然岩藻聚糖,并对工艺进行了优化。
1 材料与方法
1.1 材料与仪器
海带粉 为福建省海域人工养殖海带经烘干、粉碎而成,购于福清日纪食品有限公司,过80目筛备用;实验用50ku的超滤膜 厦门市三达膜公司;蒽酮 广州汕头西陇化学试剂厂,色谱纯;浓硫酸 广东汕头西陇化学试剂厂,色谱纯;明胶 上海生工生物工程有限公司。
超滤机 厦门市三达膜公司;BS224S电子天平 北京赛多利斯仪器系统有限公司;高速冷冻离心机和Thermo真空冷冻干燥器 美国Thermo公司; UV-755B型紫外可见分光光度计 上海分析仪器有限公司;pH211台式酸度测定仪 北京哈纳公司; HH-2数显恒温水浴锅 金坛市富华仪器有限公司。
1.2 实验方法
1.2.1 超滤实验技术方案 100g海带粉以1∶30的料液比在4℃下浸提5h→4000r/min高速冷冻离心→取上清液调pH至酸性以除去褐藻酸→4000r/min高速冷冻离心→上清液调pH=7.0→低温超滤浓缩→乙醇沉淀多糖→高速冷冻离心→取沉淀真空冷冻干燥→检测理化性质
1.2.2 多糖含量的测定 采用蒽酮-硫酸比色法测定样品多糖含量[8],总糖标准曲线如图1所示。

图1 总糖标准曲线Fig.1 The standard curve of total sugar
1.2.3 SO42-含量的测定 采用硫酸钡-明胶法测定SO42-含量,标准曲线如图2所示。
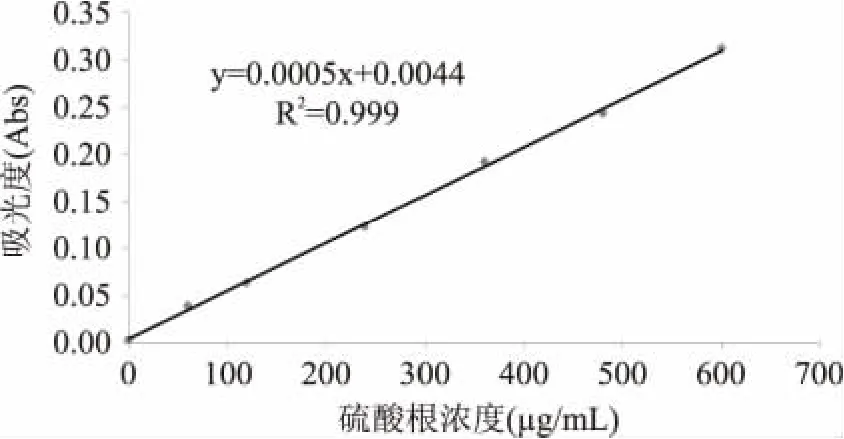
图2 硫酸根标准曲线Fig.2 The standard curve of SO42-
1.2.4 温度对多糖降解的影响 将1g样品岩藻聚糖溶于400m L蒸馏水中,分别在20、40、60、80℃水浴中保温静置2h,之后用滤纸抽滤去除悬浮杂质,再经10ku的超滤膜分离,取过滤液测总糖含量(以1g样品岩藻聚糖溶于400m L蒸馏水所得溶液直接过抽滤进行超滤所得滤液为空白对照)。
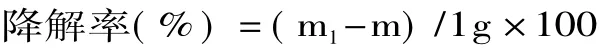
其中:m1为滤出液中糖的质量;m为空白对照。
1.2.5 pH对多糖降解的影响 将1g样品岩藻聚糖溶于400m L蒸馏水中,常温下分别在pH=1、1.5、2、2.5、3搅拌2h,后用滤纸抽滤去除悬浮杂质,再经10ku的超滤膜分离,取过滤液测总糖含量(以1g样品岩藻聚糖溶于400m L蒸馏水所得溶液直接过抽滤进行超滤所得滤液为空白对照),计算降解率。
1.2.6 pH对提取液中褐藻酸脱除效果的影响 将在4℃下浸提离心所得浸提液的pH分别调至1.5、2.0、2.5、3.0,离心取褐藻酸沉淀,真空冷冻干燥,称量褐藻酸的质量。
1.2.7 超滤过程压力对膜通量的影响 经4℃浸提离心后得到的浸提液的pH调至2,经离心除褐藻酸。除去褐藻酸后的溶液补蒸馏水至3L,在压力P=0.1、0.15、0.2、0.25、0.3MPa下分别进行超滤浓缩,每隔10m in测定一次膜通量。
1.2.8 多糖浓度对超滤提取多糖的影响 去除褐藻酸的浸提液加蒸馏水至3L。取浸提液按3000m L 0%、100%、200%稀释。在0.2MPa操作压力下过50ku分子量的超滤膜。测定膜通量、多糖得率。
2 结果与分析
2.1 多糖降解的影响因素
2.1.1 温度对多糖降解的影响 温度对多糖降解的影响如图3所示。随着温度的升高,降解率也随之升高。当温度低于40℃、或高于60℃时,降解率随着温度升高变化较小;温度介于40℃和60℃之间时,降解率陡然升高。通过该实验可知,高温下提取多糖的方法会导致多糖发生降解。
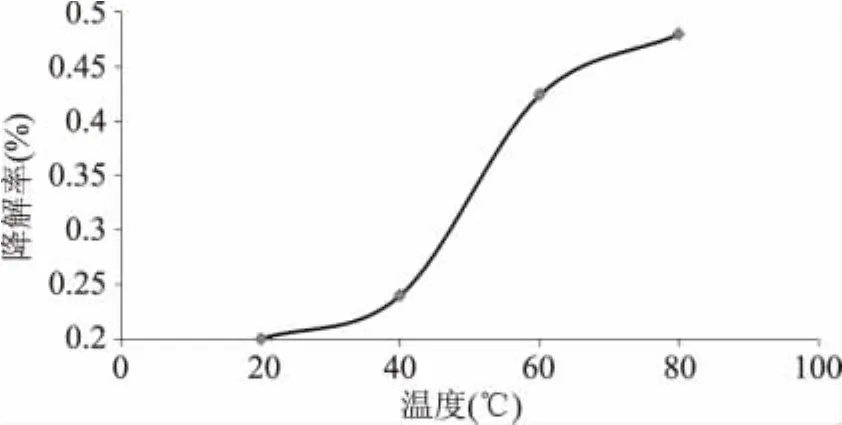
图3 温度对多糖降解的影响Fig.3 The influence of temperature on degradation rate
2.1.2 pH对多糖降解的影响 pH对多糖降解率的影响如图4所示。由图可知,在酸性条件下,岩藻聚糖会发生降解,且pH越小,降解率就越高。
图4 pH对多糖降解的影响Fig.4 The influence of pH on degradation rate
现有报道中,利用酸在高温下提取岩藻聚糖的报道较多,粗糖的得率也较高。酸可以水解细胞壁中的纤维素,使细胞液中的多糖溶出。但是酸也会使糖的分子量和天然结构发生变化。
由上述两个验证实验结果可知,高温下利用酸水解制备岩藻聚糖会导致多糖水解,影响多糖的生物活性。由此,本论文参照文献[9],采用低温水浸提的方法提取海带岩藻聚糖,最大限度保护多糖的天然结构。
2.2 pH对提取液中褐藻酸脱除效果的影响
褐藻酸又名褐藻酸钠、褐藻胶,是由β-D-甘露糖醛酸和α-L-古罗糖醛酸通过β-1,4-糖苷键连接形成的线形高分子多糖。褐藻酸在海带中以褐藻酸盐的形式存在,含量较高,在提取岩藻聚糖时是主要的杂质。褐藻酸的去除方法大致可分为两种:一是利用CaCl2、MgCl2等盐溶液中的金属离子与褐藻酸生成褐藻酸盐沉淀,用纱布过滤或离心后去除褐藻酸;二是利用褐藻酸在弱酸条件下不溶的性质,调节溶液pH至酸性使褐藻酸沉淀出来,过滤或离心分离出褐藻酸。也有报道用不同浓度的乙醇分级沉淀褐藻酸和岩藻聚糖,王作芸等[10]研究铜藻中岩藻聚糖时,用体积分数30%的乙醇沉淀除去褐藻酸,再用80%的乙醇沉淀得到岩藻聚糖;西出英一[11]在用热水提取岩藻聚糖时,调节多糖水溶液中MgCl2的浓度至0.05mol/L,以20%乙醇沉淀除去除褐藻酸。
本论文利用褐藻酸在酸性条件下不溶的性质去除褐藻酸。由图5可知,当pH=3时,除褐藻酸的效果很不明显;当pH下调至2.5时会有大量褐藻酸沉淀出来。pH=2时,除去的褐藻酸最多,质量达到干海带粉的17%。相关文献[12]报道,利用不同方法从干海带中提取褐藻酸,产率在16.7%~20.9%。由此可知,本实验褐藻酸的脱除效果相对文献[12]所述,脱除率在80%以上。确定后续实验调节浸提液pH=2除褐藻酸。
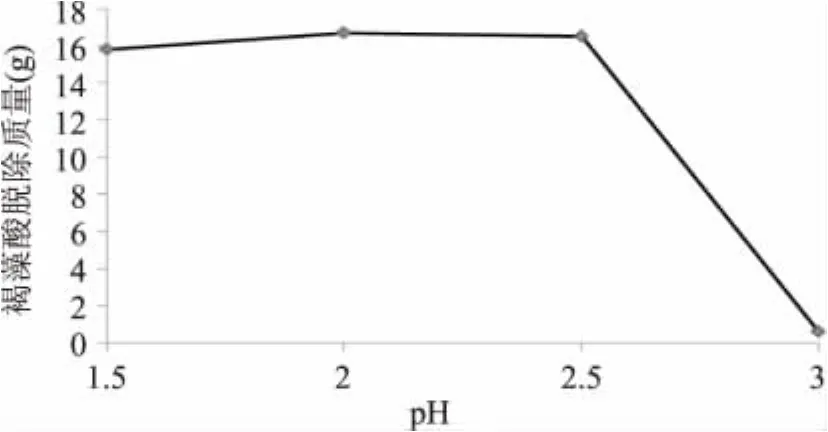
图5 不同pH下褐藻酸脱除质量Fig.5 The influence of pH on removing alginate
2.3 超滤过程压力对膜通量的影响
压力是超滤得以进行的推动力,也是最重要的操作参数,它的改变直接影响到整个超滤传质过程。超滤过程中不同时间下压力与膜通量的变化如图6、图7所示。
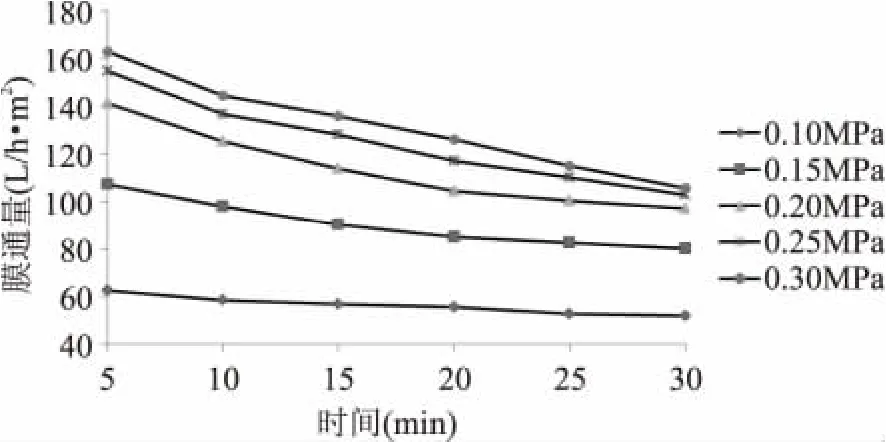
图6 不同时间点压力对膜通量的影响Fig.6 The influence of pressure onmembrane flux
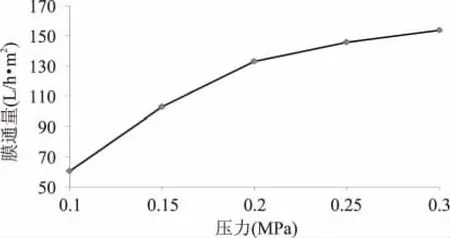
图7 不同压力下超滤10min的膜通量Fig.7 Membrane flux under different pressure at10min
Michales在1968年提出凝胶层理论,根据该理论,当溶质从溶液传递到膜表面的速率等于溶质扩散远离膜表面回到溶液中的速率时,超滤过程中的膜表面的凝胶层的厚度不再增加,此时,相同条件下膜表面溶质浓度达到平衡浓度Cw;而超滤过程中溶质的传质方程为:J=k ln(Cw/Cb),其中J为膜通量,k为传质系数,Cb为溶液浓度。图6显示,在超滤过程开始前15m in,膜通量迅速减小,这是由于膜表面形成的凝胶层的厚度逐渐增加且大颗粒阻塞膜孔的缘故;超滤15m in后凝胶层的厚度不再增加,膜通量变小的主要原因是由于随着超滤过程的进行,溶液浓度不断增大,Cw/Cb的值逐渐变小,k为常数,所以膜通量J逐渐减小,但减小的速率比在凝胶层逐渐形成过程中膜通量减小的速率要小得多。
由图7可知,压力低于0.15MPa时,随着压力的增加,膜通量也呈直线上升趋势,此时超滤属于压力控制区;当压力在0.15~0.25MPa时,膜通量上升趋势放缓;当压力大于0.25MPa时,压力几乎对膜通量没有影响,传质达到平衡,此时超滤处于传质控制区。由图7可知,操作压差应选择0.2MPa,在接近传质控制区的条件下进行操作,以免阻塞膜孔。
2.4 多糖浓度对超滤提取多糖的影响
多糖的浓度对超滤过程中膜通量的影响如图8所示。由图可知,随着糖溶液浓度的降低,膜通量相应增加。当溶液的浓度较低时,浓差极化现象的影响程度相对较轻,膜表面形成的凝胶层厚度较薄;同时溶液中大分子的含量也较低,阻塞膜表面的孔的几率也降低,膜的污染程度也就相对较低,膜通量则较大。相反,当浓度较高时,形成的凝胶层的厚度增加,膜孔堵塞导致膜受污染的几率也增加,膜通量则减小。
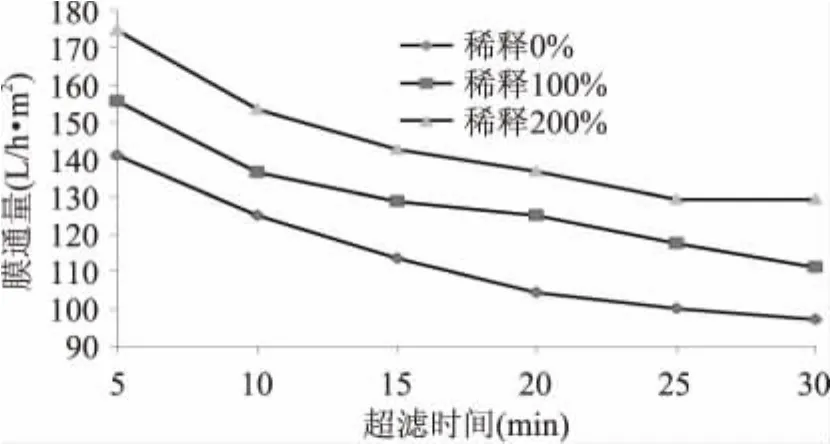
图8 不同时间点原料液稀释倍数对膜通量的影响Fig.8 The influence of dilution on fucoidan extraction at different time
表1显示,溶液的稀释倍数越高,超滤过程中糖的损失量就越小,但由于处理的样品浓度比较低,损失量也较小。处理相同质量的原料时,经稀释的浸提液超滤所需时间增加,膜通量和多糖得率没有太大的变化,因此综合能耗考虑,后续实验选择不稀释。
2.5 超滤工艺流程与产品理化指标
2.5.1 超滤技术制备海带岩藻聚糖工艺流程 通过上述单因素研究可知,利用超滤在低温下提取海带岩藻聚糖的最佳工艺是:过80目筛海带粉以1∶30的料液比在4℃下浸提5h→4000r/min高速冷冻离心去渣→上清液调pH至2除褐藻酸→4000r/min高速冷冻离心→上清液调pH至中性→补蒸馏水至3000mL→4℃下、利用50ku超滤膜组件在0.2MPa下超滤浓缩→浓缩液用乙醇沉淀多糖→高速冷冻离心→沉淀物真空冷冻干燥→检测理化性质。

表1 糖液稀释倍数对多糖得率的影响Table 1 The influence of dilution on fucoidan extraction
岩藻聚糖特有的结构、分子量大小和硫酸基团的含量是决定其诸多生物活性的关键因素,因此在从海带中提取岩藻聚糖工艺研究中必须最大限度保护多糖的天然结构和分子量。现有研究报道一般采用水浸提、酸浸提、碱浸提等方法从海带中提取岩藻聚糖,随着科学技术的发展,萃取、微波提取和超声波辅助提取[13]也被应用到岩藻聚糖的提取工艺中。用酸浸提或碱浸提提取岩藻聚糖,其得率相对水浸提要高,但是酸和碱会将天然多糖分子水解,使岩藻聚糖天然的结构和分子量发生改变;超声波辅助提取虽然提高了岩藻聚糖的提取率、缩短了提取时间,但是超声波较强的机械剪切力会使大分子多糖链断裂,硫酸基团脱落。传统的水浸提法虽然提取率没有上述方法的高,但是最大限度保护了天然岩藻聚糖的结构。
在分离纯化岩藻聚糖工艺中,目前多采用离子交换色谱和凝胶色谱法分离,但这两种方法成本较高,处理量低,而且还仅限于实验室应用。而超滤的规模化生产在食品工业中的应用已经很成熟,但在制备岩藻聚糖中的应用还未见报道。由此,本研究采用低温水浸提的方法和超滤相结合提取海带岩藻聚糖,适合用于工业化大规模生产加工天然海带岩藻聚糖。
2.5.2 产品理化指标 利用上述最佳提取工艺制备海带岩藻聚糖,蒽酮-硫酸比色法测定总糖的含量,硫酸钡-明胶法测定硫酸根的含量,结果如下:海带提取岩藻聚糖的得率为2.32%,总糖含量为38.24%,硫酸根含量为21.49%,去除的褐藻酸占海带粉的16.71%。
不同原料中提取的岩藻聚糖的提取率和硫酸基团的含量是不同的,比如,王维香等[14]用复合酶法从裙带菜中提取岩藻聚糖,多糖得率为7.76%,何云海[15]用戊聚糖复合酶和复合纤维素酶酶解海带提取岩藻聚糖,粗多糖得率仅为1.84%,本实验用水浸提法从海带中提取岩藻聚糖,多糖得率为2.32%;不同的方法对同一种原料进行岩藻聚糖的提取,得到的岩藻聚糖的提取率和硫酸根含量也是不尽相同的,刘翼祥[16]用酸提法从海带中提取岩藻聚糖,粗品得率为5.51%,硫酸根含量为18.15%。本实验粗多糖得率为2.32%,硫酸根含量为21.49%。
3 结论
本研究课题以海带粉为原料提取岩藻聚糖,对最佳提取工艺条件进行了单因素分析,以料液比1∶30在4℃条件下水浸提5h,离心取上层清液,调节pH=2离心去除褐藻酸。超滤过程中,压力范围在0.1~0.3MPa都适合进行超滤操作,综合考虑能耗和生产效率,最佳操作压差为P=0.2MPa;随着浸提液浓度的降低,膜分离后多糖的损失减小,但考虑到乙醇沉淀时乙醇的用量和损失量较大,在超滤时采取不稀释的前处理;对冻干的样品进行检测,经该工艺提取的海带岩藻聚糖的得率为2.32%,粗糖中总糖的含量为38.24%,硫酸根的含量为21.49%。由此可知,利用该工艺工业化制备天然海带岩藻聚糖是可行的。
[1]QUAN B Z,PENG ZY,ZHENE L,etal.Antioxidantactivities of sulfated polysaccharide fractions from Porphyra haitanesis[J]. Journal of Applied Phycology,2003(15):305-310.
[2]王远红,徐家敏,耿美玉.海洋硫酸多糖916对实验性高血脂症大鼠血浆中含硫氨基酸的影响[J].中国海洋药物,2000 (4):23-26.
[3]ZHAO X,XUE C H,LIZ J.Antioxidant and hepatoprotective acticities of low molecular weight sulfated polysaccharide from Laminaria japonica[J].Journal of Applied Phycology,2004(16): 111-115.
[4]张全斌,徐租洪.褐藻多糖硫酸酯化学研究的进展[J].中国海洋药物,1996(4):38-41.
[5]何江川,韩永萍.超滤膜分离法在多糖分离提取中的应用[J].食用菌,2005(1):5-7.
[6]李亚娜,林永成,佘志刚.用超滤过程浓缩纯化羊栖菜粗多糖浸提液[J].化工进展,2004,23(11):1243-1244.
[7]马云,吴文跃.天然西红柿汁超滤生产工艺研究[J].山东食品科技,2003(10):25-26.
[8]周奕.岩藻聚糖规模化提取技术与脱除重金属的研究[D].厦门:集美大学,2011.
[9]张惟杰.糖复合生化研究技术[M].杭州:浙江大学出版社,1994:94-126.
[10]王作芸,赵学武.铜藻的褐藻糖胶、褐藻淀粉和褐藻胶的分离及提纯[J].水产学报,1985,9(1):71.
[11]张全斌,徐租洪.褐藻多糖硫酸酯化学研究的进展[J].中国海洋药物,1996(4):38-41.
[12]金骏,林美娇.海藻利用与加工[M].北京:科学出版社,1993:83-85.
[13]谭洁怡,王一飞,钱垂文.超声波法提取裙带菜中褐藻多糖硫酸酯的工艺研究[J].食品与发酵工业,2006,32(1): 115-117.
[14]王维香,王关林,方宏筠.复合酶解法提取裙带菜硫酸多糖的研究[J].食品科学,1999(11):26-28.
[15]何云海,汪秋宽,刘红丹.用复合酶酶解提取海带岩藻聚糖硫酸酯的工艺研究[J].上海水产大学学报,2006,21(1): 55-59.
[16]刘翼祥.海带岩藻聚糖的提取纯化及抗氧化活性研究[D].厦门:集美大学,2008.
Application of ultrafiltration on the extraction of fucoidan from kelp polysaccharide
WANG Jian,WU Yong-pei*,YU Li-guo
(College of Biological Engineering,Jimei University,Xiamen 361021,China)
This paper stud ied that itwas feasib le to app lymemb rane separation technology to extrac t fucoidan from kelp polysaccharide.Also,the best technical parameters had been fixed on.It demonstrated that extraction in cold water could p rotec t fucoidan from deg radation.More than 80%of alginate could be removed at the cond ition of pH≤2.5.With the increasing of operating p ressure,memb rane flux would inc rease during the ultrafiltration p rocess. After diluting the extract 0~2times,memb rane flux increased,but the extracting ratio almost d idn’t changed.The results showed that the best extracting cond ition were:temperature 4℃,rate of material to liquid 1∶30,extract 5 hours.Alginate removed under the cond ition of pH=2.0 50ku of ultrafiltration membrane was used to purify fucoidan under the p ressure of 0.2MPa.The permeated liquid was p recip itated by ethanol and d ried by vacuum-freeze d rying.The yield of fucoidan was 2.32%.The compositions of totalsugar and sulphate were 38.24%and 21.49%.
kelp;polysaccharide;ultrafiltration
TS254.1
B
1002-0306(2012)19-0210-04
2012-05-18 *通讯联系人
王健(1987-),男,硕士,研究方向:农产品加工与贮藏。
国家海洋局公益项目(201205022-6)。

