丁香多酚细胞抗氧化活性的研究
张慧芸,申云翔,任国艳
(河南科技大学食品与生物工程学院,河南洛阳 471003)
丁香多酚细胞抗氧化活性的研究
张慧芸,申云翔,任国艳
(河南科技大学食品与生物工程学院,河南洛阳 471003)
目的:研究丁香多酚对由H2O2引起的人肝细胞RBL氧化损伤的保护作用。方法:采用H2O2诱导建立细胞氧化损伤模型,通过测定细胞存活率、细胞抗氧化酶活性、丙二醛等指标,分析探讨丁香多酚对细胞损伤的保护作用。结果:结果表明,100μmol/L H2O2孵育24h可显著诱导RBL细胞损伤,使细胞存活力下降到24.64%,细胞经不同浓度的丁香多酚(0.1、0.5、2、10mg/L)与H2O2共孵育后,特别是10mg/L丁香多酚可使细胞存活率达到59.18%。丁香多酚可通过提高SOD、CAT、GSH-Px酶活性,降低MDA含量,促进受损的RBL细胞修复。结论:丁香多酚对H2O2诱导氧化损伤的RBL细胞具有显著的保护作用,可作为食源性抗氧化剂。
丁香多酚,抗氧化能力,人肝细胞,过氧化氢,保护作用
随着自由基和抗氧化剂理论和研究工作的深入,自由基与疾病、衰老的关系及其自由基清除剂、抗氧化剂的研究逐渐成为国内外研究的热点,然而合成抗氧化剂因为越来越多的被发现有诸多的副作用,高效、低毒的天然抗氧化剂的研究和应用越来越引起人们的重视。植物多酚是一种良好的天然抗氧化剂,其抗氧化功能已经得到广泛肯定[1]。目前多酚物质生理活性的研究已经成为热点。已经有许多实验证明,多酚物质在体内具有良好的抗氧化活性,在心脑血管疾病、抗衰老和抑制肿瘤等方面有明显的预防和治疗效果[2-5]。茶多酚、苹果多酚和葡萄多酚等植物多酚的体外生物活性已有大量实验研究[6-9]。丁香为桃金娘科植物丁香(Eugeniacaryophylla Thunb.)的干燥花蕾,是药食两用植物。研究表明,丁香具有众多功能活性[10-12]。Peter等人[13]报道,丁香中的丁香酚、异丁香酚以及没食子酸等都是重要的抗氧化成分。Chaieb等人[14]提取丁香中的抗氧化物质,进行鉴定得到主要的抗氧化物质为丁子香酚和没食子酸。目前国内外关于丁香在化学体系中抗氧化活性研究方面已有较多报道[15-20],但极少涉及对细胞抗氧化活性方面的研究。通过前期研究发现,丁香多酚提取物在体外具有较好的抗氧化和清除自由基活性[21],为了进一步考察其抗氧化生理功能,本研究主要探讨丁香多酚对人肝细胞RBL H2O2损伤后的保护作用及其可能的作用机制。
1 材料与方法
1.1 材料与仪器
丁香 洛阳好一生大药房;人肝细胞RBL 中国科学院细胞库;含青霉素和链霉素的RPMI-1640培养液 PBS Solarbio公司;0.25%胰酶-EDTA消化液、胎牛血清、DMEM(Dulbecco’s modification of Eagle’s medium)培养基 Gibco公司;二甲基亚砜(DMSO)溶解后避光保存备用、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbrom ide,MTT) Sigma公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒 南京建成生物工程公司。
Model 680酶标仪 BIO-RAD公司;HF-90 CO2培养箱 力康发展有限公司;UV-2401PC紫外分光光度计 日本岛津公司;SinChrom ODS-BP柱(250mm×4.6mm) 大连伊利特;D-1320超净工作台 北京东联哈尔仪器制造有限公司。
1.2 实验方法
1.2.1 丁香多酚提取物的制备方法 将干燥并碾磨成粉状的丁香取10g,于250m L三颈瓶中,加入浓度为60%的乙醇100m L,水浴加热温度为50℃,搅拌器搅拌,提取时间2h,浸出液10000×g离心15m in,沉淀重新用60%乙醇提取,将第二次的提取液10000×g离心15m in,上清液合并后50℃减压浓缩至干,取出浓缩液进行真空干燥(40℃、0.07MPa)得到丁香多酚提取物,4℃冰箱保存。测定前将样品溶于60%乙醇至所需浓度,经0.22μm微孔膜过滤灭菌。
1.2.2 RBL细胞培养与处理 RBL细胞培养基为DMEM,含10%胎牛血清(FBS)、100g/m L双抗、2mmol/L谷胺酰胺,于37℃、5%CO2饱和湿度培养箱培养。细胞处于生长对数期时用0.25%的胰蛋白酶消化,接种于96孔细胞培养板,每孔100μL,接种密度2.0×105个/m L,培养24h后分组培养。正常对照组:细胞,不加任何处理;模型组:细胞+100μmol/L H2O2(H2O2单独处理24h);样品防护组:细胞+样品+100μmol/LH2O2(不同浓度的样品与H2O2同时加入,并共孵24h);样品对照组:细胞+样品(样品单独处理24h)。
1.2.3 细胞存活率的检测 细胞存活率检测:MTT法[22]。96孔板中的细胞分组处理,培养结束后,每孔加20μL(5mg/m L)MTT,培养3.5h后弃上清,每孔加150μL DMSO,充分振荡溶解紫色结晶,于570nm处用酶标仪检测各孔OD值。由MTT转化为不可溶formazan盐的数量可测定细胞相对存活率。对照组细胞形成formazan的OD相当于100%存活率。处理组细胞存活率结果表示为测定组OD和对照组OD的百分比。
1.2.4 细胞裂解液的制备 细胞裂解液的制备参照Lee等[23]的方法,稍加改动。细胞以1.2×104个/m L密度接种于24孔板。于37℃培养16h后,将不同浓度的样品(0.1、0.5、2和10mg/L)加入孔板中。于37℃培养24h后,每孔加入150μL细胞裂解液(1% triton X-100),于4℃裂解12h后测定酶活。细胞裂解液的蛋白质含量由考马斯亮兰法测定。酶活表示为U/mg蛋白。
1.2.5 氧化还原酶系及MDA含量的测定 收集各组处理后的细胞培养基及细胞裂解液(细胞收集后经-20℃与室温下反复冻融三次)。细胞培养液及细胞裂解液的CAT、SOD和GSH-Px水平均按试剂盒说明书进行测定。MDA含量用硫代巴比妥酸(TBARS)方法测定[24]。
1.3 数据分析
每个实验重复3次,结果表示为平均数±SD。数据统计分析采用 Statistix 8.1(分析软件,St Paul,MN)利用软件包中Linear Models程序进行,差异显著性(p<0.05)分析使用Tukey HSD程序。
2 结果与分析
2.1 丁香多酚对RBL存活率的影响
图1为丁香多酚对 H2O2诱导的氧化损伤的RBL细胞存活率的影响,由图可以看出,与正常对照比,H2O2可显著诱导RBL细胞损伤,只经H2O2处理的模型对照组使细胞存活率下降到24.64%。随着丁香多酚添加量的提高,对细胞的保护作用增强,样品防护组中丁香多酚以0.1、0.5、2mg/L浓度与H2O2共孵时,细胞存活率分别提高了 9.72%、20.84%和27.74%(p<0.05);当浓度为10mg/L时,细胞存活率从24.64%提高到了59.18%(p<0.01)。另外,从样品对照组与正常对照组相比较可以看出,样品有促进细胞生长的作用,丁香多酚浓度为2mg/L时,细胞存活率提高了10.94%,效果显著(p<0.05);丁香多酚浓度为10mg/L时,细胞存活率增加了17.59%,效果非常显著(p<0.01)。
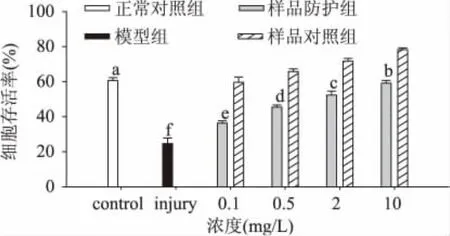
图1 丁香多酚对H2O2诱导的氧化损伤的RBL细胞存活率的影响Fig.1 The effect of clove polyphenols on H2 O2-induced oxidative damage in RBL cells viability
H2O2极易透过细胞膜,可在细胞内通过多种反应而形成高活性自由基,最终对机体造成严重损害[25],因此H2O2已成为研究细胞氧化损伤的重要工具。H2O2对细胞造成不可逆损伤的体现主要是细胞存活率的改变。由于MTT法测细胞存活率方法简单,实验周期短,所需细胞数目较少,已成为检测活细胞和细胞增殖的一个主要手段。本实验的MTT结果表明,与正常对照相比,丁香多酚在0.1~10mg/L浓度范围内,均可对细胞起到一定的保护作用。经丁香多酚保护后的细胞存活率提高,且丁香多酚通过抗氧化机制,淬灭氧自由基,减轻了自由基对细胞的损伤,与文献报道相一致[12]。除此之外,实验发现一定浓度的丁香多酚具有促进细胞生长的作用。
2.2 丁香多酚对RBL细胞抗氧化酶系的作用
为了研究丁香多酚是否具有提高抗氧化酶系统活力的作用,测定了丁香多酚处理后RBL细胞的CAT、SOD和GSH-Px酶的活力。由图2可知,正常对照组CAT、SOD和GSH-Px酶的活力均在较高水平,经H2O2处理24h后,模型组的这些指标显著下降(p<0.05),而丁香多酚均可以剂量依赖性的提高其活性。浓度为0.1~10mg/L的丁香多酚作用后的细胞中的三种酶含量均显著高于损伤对照组(p<0.05)。
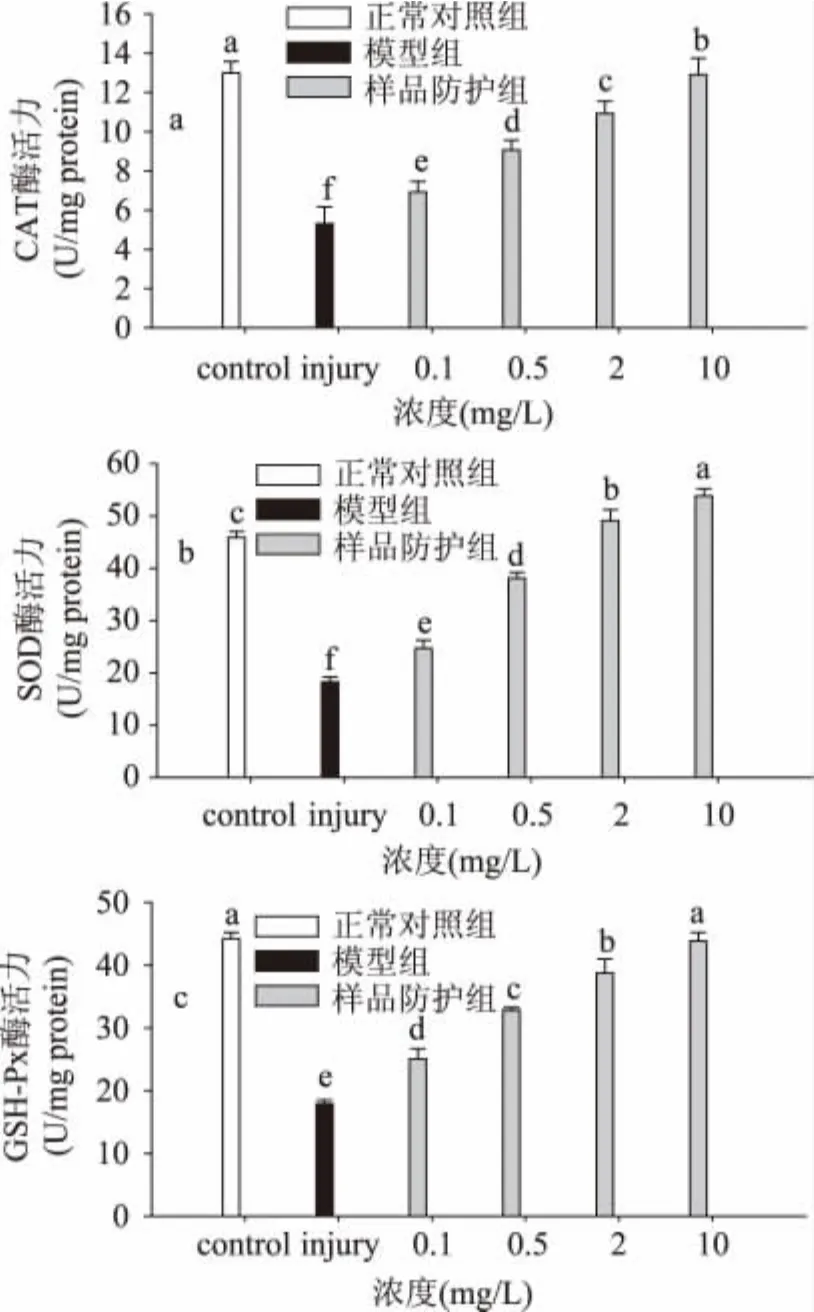
图2 丁香多酚对氧化损伤的RBL内CAT、SOD和GSH-Px酶活力的影响Fig.2 The effect of clove polyphenols on the activityof CAT、SOD and GSH-Px of injured RBL
机体内存在大量具有清除自由基功能的抗氧化酶系,在抵抗细胞和组织氧化损伤方面发挥着重要的作用[26],包括SOD、CAT和GSH-Px在内的抗氧化酶可通过攻击自由基来调节各种疾病的产生。研究表明[27]SOD、GSH-Px、CAT水平是衡量机体及细胞氧化损伤的重要指标。本研究中 H2O2模型组的SOD、CAT和GSH-Px活性下降,而丁香多酚处理后各组的抗氧化酶活性均有所提高,表明丁香多酚可通过抗氧化生理功能,提高细胞抗氧化系统的活性水平,从而减轻了自由基对细胞的损伤。
2.3 丁香多酚对RBL细胞中MDA含量的影响
不同浓度丁香多酚清除MDA的结果见图3。由图可以看出,浓度为0.1~10mg/L的丁香多酚对MDA均有明显的清除作用,随丁香多酚浓度的增加,MDA含量呈下降趋势(p<0.05),模型组的MDA含量与正常对照组相比显著升高(p<0.05),而样品防护组中MDA水平比模型组低,并具有统计学意义(p<0.05),且10mg/L的样品防护组水平与正常对照组相当。MDA是氧自由基攻击生物膜中的多不饱和脂肪酸引发的脂质过氧化作用,形成的脂质过氧化物使组织细胞受损伤,即MDA的含量间接反映细胞的受损程度[28]。从MDA含量变化可以看出,丁香多酚可在一定程度上阻止生物膜的脂质过氧化作用,从而防护了细胞的脂质膜。
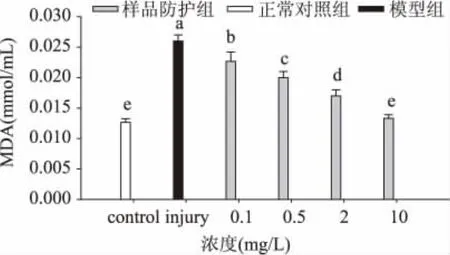
图3 丁香多酚对氧化损伤的RBL内MDA含量的影响Fig.3 The effect of clove polyphenols on the MDA content of injured RBL
3 结论
丁香多酚可在适宜浓度下对由H2O2诱导引起的RBL细胞氧化损伤起到保护作用,并且可以剂量依赖性地显著提高细胞中抗氧化酶SOD、GSH-Px和CAT的活性,降低MDA含量,同时促进RBL细胞生长。因而丁香多酚具有潜在的生理功能和广阔的应用前景。
[1]Gioti E M,Fiamegos Y C,Skalkos D C,et al.Antioxidant activity and bioactive components of the aerial parts of Hypericum pecforatum L.from Epirus,Greece[J].Food Chemistry,2009,117 (3):398-404.
[2]严奉伟,罗祖友,薛照辉,等.菜籽多酚的抗氧化作用[J].中国油脂,2005,30(7):54-57.
[3]赵秀兰,宫爱华,李建华,等.茶多酚对家兔实验性动脉粥样硬化的抑制作用[J].中华老年医学杂志,2003,22(8): 477-450.
[4]焦淑萍,姜虹,丁宁,等.野生山葡多酚对高脂血症小鼠脂代谢的影响及抗氧化作用研究[J].北华大学学报:自然科学版,2005,6(1):30-32.
[5]Huang H,Xu X Q.Anticancer activity of tea:evidence from recent animal experiments and human studies[J].Journal of Tea Science,2004,24(1):1-11.
[6]Yi O S,Meyer A S,Frankel E N.Antioxidant activity of grape extracts in a lecithin liposome system[J].Journal of the American Oil Chemists Society,1997,74:1301-1307.
[7]唐传核,彭志英.葡萄多酚类化合物以及生理功能[J].中外葡萄与葡萄酒,2000(2):12-15.
[8]孙建霞,孙爱东,张晓伟,等.苹果中多酚物质的抗氧化性研究[J].食品研究与开发,2005,26(2):149-150.
[9]Yinrottg L,Yeap F L.Antioxidant and radical scavenging activities of polyphenols from apple pomace[J].Food Chemistry,2000,68:81-85.
[10]刘洪宇,朱姝,小松かつ子,等.丁香水溶性化学成分的研究[J].中药材,2008,31(7):998-1000.
[11]Singh A K,Dhamanigi S S,Asad M.Anti-stress activity of hydro-alcoholic extract of Eugenia caryophy buds(clove)[J]. Indian Journal of Pharmacology,2009,41(1):28-31.
[12]Rodrigues TG,Fernandes A,Sousa JP B,et al.In vitro and in vivo effects of clove on pro-inflammatory eytokines production by macrophages[J].Natural Product Research,2009,23(4): 319-326.
[13]Peter K V.Handbook of herbs and spices[M].Cambridge: CRC PressWood head Publishing,2000.
[14]Chaieb K,Hajlaoui H,Zmantar T,et al.The chemical composition and biological activity of clove essential oil,Eugenia caryophyllata(Syzigium aromaticum L.Myraceae):a short review[J].Phytotherapy Research,2007,21(6):501-506.
[15]Mishra R K,Singh S K.Safety assessment of Syzygium aromaticum flower bud(clove)extract with respect to testicular function in mice[J].Food and Chemical Toxicology,2008,46 (10):3333-3338.
[16]陈文学,豆海港,仇厚援.丁香提取物抗氧化研究[J].食品研究与开发,2006,27(1):149-152.
[17]郭新竹,秦国华.丁香、桂皮抗氧化作用的研究[J].食品科技,1999(1):49-50.
[18]Samusenko A L.Investigation of antioxidant activity of essential oils from lemon,pink grapefruit,coriander,clove and its mixtures by capillary gas chromatography[J].Oxidation Communications,2008,31(3):519-526.
[19]Misharina T A,Samusenko A L.Antioxidant properties of essential oils from lemon,grapefruit,coriander,clove,and their mixtures[J].Applied Biochemistry and Microbiology,2008,44 (4):438-442.
[20]Abdel-Wahhab M A,Aly SE.Antioxidant property of Nigella sativa(black cumin)and Syzygium aromaticum(clove)in rats during aflatoxieosis[J].Journal of Applied Toxicology,2005,25 (3):218-223.
[21]张慧芸,孔保华,孙旭.香辛料提取物抗氧化活性及其作用模式的研究[J].食品科学,2010(5):111-115.
[22]Kima H J,Lee KW,Kima M S,et al.Piceatannol attenuates hydrogen-peroxide-and peroxynitrite-induced apoptosis of PC12cells by blocking down-regulation of Bcl-XL and activation of JNK[J].Journalof Nutritional Biochemistry,2008(19):459-466.
[23]Lee S E,Hwang H J,Ha J S,et al.Screening of medicinal plant extracts for antioxidant activity[J].Life Sciences,2003,73: 167-179.
[24]王光伟,丰昀,邱细敏,等.白术多糖对大鼠创伤性脑损伤后脑水肿的影响[J].食品科学,2008,29(6):675-677.
[25]郑延松,李源,张珊红,等.用低浓度过氧化氢建立心肌细胞氧化损伤模型[J].第四军医大学学报,2001,22(20):1849-1851.
[26]杨静秋.抗氧化乳酸菌的筛选及其对氧化损伤的CT-26细胞的保护作用[D].无锡:江南大学,2010:35-36.
[27]李燕,蔡东联,胡同杰,等.银耳多糖对实验性衰老小鼠的保护作用[J].第二军医大学学报,2004,25(10):1104-1107.
[28]Masella R,DiBenedetto R,VariR,etal.Novelmechanisms of natural antioxidant compounds in biologicalsystems:Involvement of glutathione and glutathione-relatedenzymes[J].Journal of Nutritional Biochemistry,2005,16(10):577-586.
Study on the antioxidant capacity of clove polyphenols in cell
ZHANG Hui-yun,SHEN Yun-xiang,REN Guo-yan
(College of Food and Bioengineering,Henan University of Science and Technology,Luoyang 471003,China)
Ob jective:A study was conducted to investigate the p rotective effects of c love polyphenols extracts on RBL caused by the damage of H2O2and its p rotective mechanism.Method:Oxidative damage was induced by H2O2,and cell viab ility was m easured by the MTT assay.The influence of c love polyphenols extrac ts on H2O2induced RBL injury was assessed by measuring the superoxide d ismutase(SOD),catalase(CAT),and g lutathione peroxidase(GSH-Px)ac tivities and the malond ialdehyde(MDA)content.Result:The results demonstrated that RBL cells were damaged by incubation w ith 100μm ol/L H2O2for 24h,and the viability of RBL cells reduced to 24.64%.The add ition of c love polyphenols extrac ts(0.1,0.5,2 and 10m g/L)into the RBL cell suspensions p rior to the exposure to 100μmol/L of H2O2resulted in a greater survival rate of the cells.In particular,the cell viability reached 59.18%after treating w ith 10mg/L c love polyphenols extrac ts.Moreover,at elevated concentrations,c love polyphenols extrac ts exhibited inc reased repairing capability for injured RBL as well as inc reased p rotec tion of SOD,CAT and GSH-PX while reduced MDA formation.Conc lusion:The c love polyphenols extrac ts possessed p rotec tive effec ts on RBL cell injuries induced by H2O2,and this may be related to the antioxidative activity of c love polyphenols.
c love polyphenols;antioxidant capacity;RBL;H2O2;p rotec tion
TS201.2
A
1002-0306(2012)19-0147-04
2012-03-20
张慧芸(1977-),女,博士,副教授,研究方向:畜产品加工。

