黑木耳多糖-乳清蛋白复合物的制备及其抗原性的研究
齐晓彦,李 春,张 微,刘 宁,*
(1.黑龙江省乳品工业技术开发中心(国家乳业工程技术研究中心),黑龙江哈尔滨 150086; 2.东北农业大学食品学院乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
黑木耳多糖-乳清蛋白复合物的制备及其抗原性的研究
齐晓彦1,2,李 春2,+,张 微1,刘 宁1,2,*
(1.黑龙江省乳品工业技术开发中心(国家乳业工程技术研究中心),黑龙江哈尔滨 150086; 2.东北农业大学食品学院乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
蛋白质和多糖在控制条件下通过美拉德反应会发生一定程度的共价复合,能显示更优越的性能。采用黑木耳多糖作为糖基供体,用糖基化的手段与牛乳中乳清蛋白结合形成木耳多糖-乳清蛋白复合物,并在现有的条件下探索不同质量比与不同反应时间对糖基化进程的影响,采用间接竞争ELISA法测定复合物中β-乳球蛋白和α-乳白蛋白抗原性的影响。结果表明,乳清蛋白与黑木耳多糖质量比为1∶1,反应时间为24h,是糖基化反应最佳条件并且能有效减低乳清蛋白抗原性,其中β-乳球蛋白抗原性降低率为75.7%,α-乳白蛋白抗原性降低率为25%。
黑木耳多糖,多糖提取,乳清蛋白,美拉德反应,抗原性
Key words: auricularia auricula polysaccharides; polysaccharides extraction;whey p rotein; Maillard reac tion;antigenicity
婴儿配方乳粉中主要的成分是乳清蛋白粉,其中β-乳球蛋白占乳清蛋白的48%,α-乳白蛋白占19%,乳蛋白过敏的人中大约有82%对β-乳球蛋白过敏[1]。如何通过蛋白质改性降低乳蛋白的过敏性是近几年国内外的研究热点。糖基化法与酶解法和化学方法比较,使乳清蛋白改性,更好地降低其过敏性。其中相关研究已证实多糖能有效减低乳清蛋白过敏性[2-6],而国内外关于单糖或低聚糖使蛋白糖基化改善致敏性的研究也比较多[7-8]。实际应用中单糖或低聚糖进行糖苷化后的效果并不理想。而Arita K等人[9]以多糖的复合方式降低大豆蛋白致敏性。黑木耳(Auricularia auricula),它能提供丰富的多糖,而且由多种组分组成,如水溶性β-D-葡聚糖(葡聚糖Ⅰ)、水不溶性β-D-葡聚糖(葡聚糖Ⅱ)和两种酸性杂多糖[10],进一步通过纸层析和气相层析分析发现:黑木耳酸性杂多糖组成成分有D-木糖、D-甘露糖、D-葡萄糖和D-葡萄糖醛酸及少量的L-岩藻糖和L-阿拉伯糖[11]。因此,本研究通过提取黑木耳多糖并将其作为糖基供体,探索其对乳清蛋白抗原性的影响,为糖基化能有效降低牛乳过敏性的研究提供基本的技术依据。
1 材料与方法
1.1 材料与仪器
六周龄BALB/c雌性小鼠 哈尔滨市兽医研究所;黑木耳 实验室自制;乳清蛋白(蛋白质质量分数94.1%) 新西兰;β-乳球蛋白(β-LG)、α-乳白蛋白(α-LA) Sigma公司;HRP标记的羊抗鼠IgG 博奥森公司;十二烷基磺酸钠(SDS)、邻苯二甲醛(OPA) 国药集团,其他试剂均为国产分析纯。
包被液:浓度为 0.05mol/L碳酸盐缓冲液,pH9.6;稀释液:浓度为 0.01mol/L磷酸盐缓冲液(PBS),pH7.4;洗涤液:磷酸盐缓冲液(PBS)+0.05% Tween-20;封闭液:磷酸盐缓冲液(PBS)+5%脱脂乳;终止液:浓度为2mol/L的浓硫酸;自制抗体及酶标记抗体:抗原:分别为β-LG、α-LA、WPI和WPIAAP复合物;酶标二抗:HRP-羊抗鼠IgG(1∶1000)。抗体:小鼠抗β-LG血清(1∶12800)和小鼠抗α-LA血清(1∶3200)。
UT-1800紫外-可见分光光度计 北京瑞利; DK-8K恒温水浴锅 上海博迅;Alpha 1-2/LD plus冻干机 德国CHRIST公司;ZFQ85B旋转蒸发仪杭州蓝天;TGL-16C台式离心机 上海离心机械研究所;550型酶标仪 美国伯乐。
1.2 实验方法
1.2.1 黑木耳多糖的提取工艺流程 原料预处理→90℃水浴浸提1h→微波加热10min→4500r/min离心取上清→50℃减压浓缩→Sevage法3次脱蛋白→95%乙醇醇沉→离心取沉淀→无水乙醇,丙酮,乙醚洗涤沉淀→复溶→蒸馏水透析48h→冷冻干燥24h→精制多糖(AAP)。
1.2.2 苯酚-硫酸法测定多糖含量
1.2.2.1 多糖含量标准曲线的制作 将葡萄糖标准液分别配制成16~72μg/m L,9个样品中加6%苯酚1m L,98%浓硫酸5m L放置10m in,然后在490nm下测定吸光值。
1.2.2.2 样品中多糖含量的测定 吸取多糖提取液1m L,定容至100m L,按上述步骤操作测定吸光度,以标准曲线回归方程计算多糖含量。
1.2.3 木耳多糖-乳清蛋白复合物的制备 将木耳多糖和乳清蛋白按照质量比1∶1、1∶2、1∶4、1∶8溶解于磷酸盐缓冲液中,制成60g/L的溶液,在-20℃中预冻过夜后,冷冻干燥48h。干燥后样品磨细,放置于培养皿中,用刺孔的铝箔封口后放置于装有溴化钾的饱和溶液(相对湿度79%)的反应器中,温度分别控制在50℃反应0~30h,室温下冷却,即为乳清蛋白糖基复合物。
1.2.4 褐变程度测定 将待测的样品用去离子水进行稀释,使溶液的质量浓度为1g/L,并在420nm条件下测定其吸光值。
1.2.5 游离氨基酸残留量的测定 采用邻苯二甲醛法(OPA)[12-13]。OPA试剂的配制:称取40mg OPA溶于1m L甲醇中,分别加入浓度为0.1mol/L的硼砂25m L,质量分数为20%的SDS 2.5m L及100μLβ-巯基乙醇,用去离子水定容至50m L。现用现配。将样品液(质量浓度为1g/L)取200μL稀释液加入4m L的OPA试剂中,混合后室温下反应1~2m in,340nm下测定其吸光度。以 L-亮氨酸浓度0~5.0×10-3mol/L制作标准曲线,根据标准曲线回归方程,计算出样品的游离氨基酸残留量的浓度。
1.2.6 抗β-乳球蛋白及α-乳白蛋白多克隆抗体的制备 取10只6周龄健康雌性BALB/c小鼠,首次免疫取(β-LG或α-LA)1.0mg/m L的标准液与等量弗氏完全佐剂充分混匀,每只小鼠0.1m L,腹腔注射。第14和28d换成不完全弗氏佐剂同法进行加强免疫,免疫原的量不变。一周后加强免疫,摘除眼球采血,分离血清,非竞争ELISA法测定抗体效价,分装后-20℃保存备用。
1.2.7 木耳多糖-乳清蛋白抗原性的测定 采用间接竞争ELISA法[14]。抗原包被:用包被液稀释抗原,100μL/孔加入酶标板中,4℃过夜备用。抗原与初级抗体反应:在反应管中加入一定量的待测样品或抗原(β-LG或α-LA)和一定量稀释的小鼠血清。不加抗原或样品的反应管作为无竞争体系。4℃冰箱过夜。洗涤:恢复至室温倾去包被液,加 PBST 200μL/孔,洗板3次,每次5m in,扣干。封闭:每孔加200μL 5%脱脂乳粉作为封闭液,37℃保温1h,以PBST洗涤,扣干。竞争反应:将第一步中抗原或抗体的混合物100μL/孔,于37℃孵育1.5h。洗涤:用PBST洗板3次,扣干。加酶标二抗:每孔加入100μL 1∶1000稀释的HRP标记羊抗鼠IgG,37℃孵育1h。洗涤:用PBST洗板3次,扣干。显色:加入TMB显色液100μL/孔,37℃暗处反应15~20m in,显示蓝色。终止反应:每孔加50μL 2mol/L浓硫酸以终止反应,颜色变黄。比色:用酶联免疫检测双波长(特征波长490nm,非特征波长630nm)各孔吸光值。通常抗原性降低率用以下公式表示:
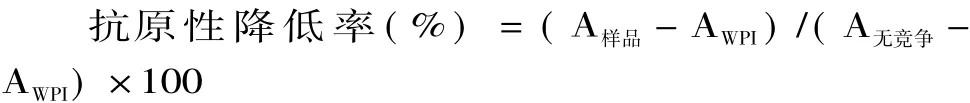
式中:A样品和AWPI分别指包被抗原为糖基化产物和WPI反应体系孔在特征波长492nm和非特征波长630nm测得的吸收值的差。
1.2.8 统计分析 文中所列数据至少为3组数据的平均值。数据采用SPSS 13.0软件进行差异性分析。
2 结果与分析
2.1 黑木耳多糖含量的检测
糖含量标准曲线回归方程(图1):Y=0.0173X-0.0091,相关系数R2≈0.9953。其中,Y表示溶液在490nm处的吸光值。X表示溶液中葡萄糖的含量(μg)。通过苯酚-硫酸法测定木耳多糖含量,得到精制的黑木耳多糖的多糖含量为76.7%。
2.2 木耳多糖和乳清蛋白质量比与反应时间对复合物的影响
L-亮氨酸标准曲线的回归方程(图2)为Y= 0.2531X+0.0271,相关系数R2≈0.9976。式中:Y表示溶液在490nm处的吸光值。X表示L-亮氨酸浓度(mol/L)。游离氨基酸残留量即为糖基化发应后的复合物中游离氨基酸浓度与未反应的WPI中游离氨基酸的浓度的比值。
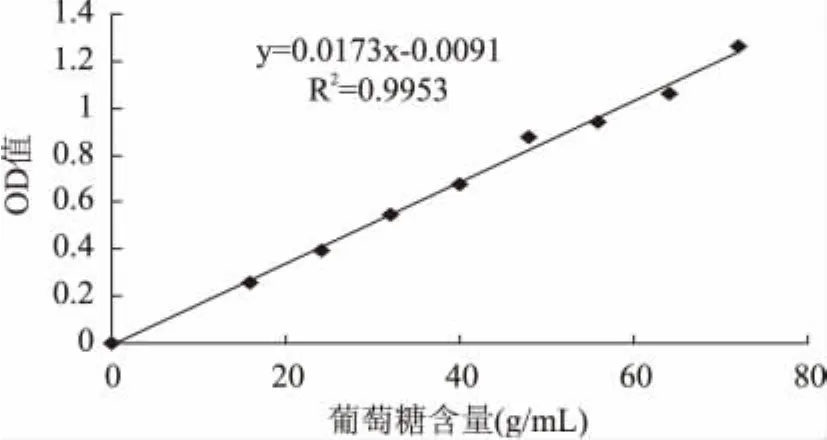
图1 苯酚-硫酸法标准曲线Fig.1 Standard curve by phenol-sulfuric acid method
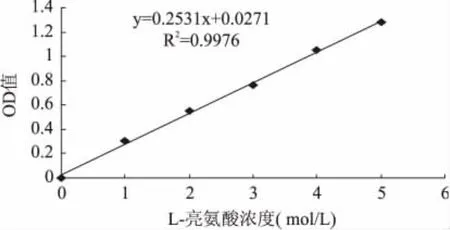
图2 L-亮氨酸浓度Fig.2 The concentration of L-leucine
控制反应条件为相对湿度79%,温度为50℃,木耳多糖和乳清蛋白质量比分别为1∶1、1∶2、1∶4、1∶8,反应时间为0~30h,对复合物褐变指数以及游离氨基酸残留量的影响分别为如图3~图4所示。
统计结果表明,反应时间对复合物的影响显著(p<0.05)。由图可看出,随着糖基化的反应时间越长,褐变指数逐渐增加,游离氨基酸残留量逐渐减少,表明发生了糖基化反应。当时间小于24h,时间对反应进程的影响显著(p<0.05),但是随着时间增加变化趋于平缓,所以确定反应时间为24h。
由图3~图4可知,4种不同质量比的复合物随着美拉德反应的进行,产物的变化趋势基本相似。在实验范围内,随着反应时间的延长,褐变程度增加,但是增大的趋势较为平缓,且不同质量比的复合物差异不明显。而游离氨基酸残留量呈逐渐降低的趋势,当质量比为1∶1、1∶2、1∶4、1∶8,反应时间24h时,游离氨基酸残留量分别为37.9%、41.6%、62.4%、68.9%,进一步说明,黑木耳多糖中的小分子还原性糖和乳清蛋白的美拉德反应发生很快,在短时间内就可以达到。适当的质量比不仅可提高反应速度,还可减少副反应发生。当质量比为1∶1时,游离氨基酸残留量消耗较多,且褐变程度随时间延长增加不明显,因此木耳多糖和乳清蛋白质量比为1∶1较好。
2.3 木耳多糖和乳清蛋白质量比与反应时间对复合物抗原性的影响
利用间接竞争ELISA法测定反应时间及不同质量比对β-乳球蛋白和α-乳白蛋白抗原性降低率,结果如图5~图6所示。不同质量比对β-乳球蛋白抗原性降低率的影响显著(p<0.05)。由图5可以看出,随着乳清蛋白与木耳多糖的质量比不断增加,β-乳球蛋白抗原性降低率明显下降,木耳多糖和乳清蛋白质量比为1∶1时能够最大程度上降低β-乳球蛋白的抗原性,降低率最高可达到75.7%。
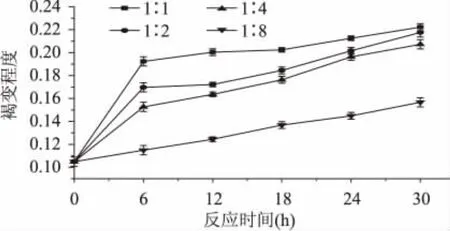
图3 不同质量比对复合物褐变程度的影响Fig.3 Effect ofmass ratio on the degree of browning
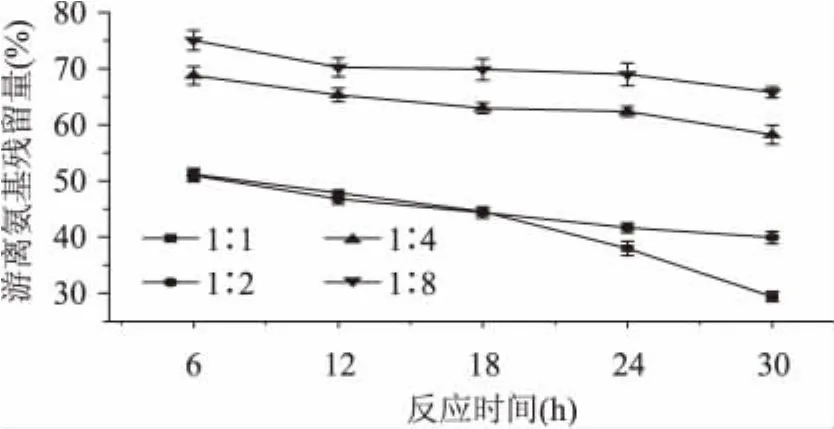
图4 不同质量比对复合物游离氨基残留量的影响Fig.4 Effect of differentmass ratio on the degree of free amino group content
反应时间小于12h时,β-乳球蛋白的抗原性变化比较平缓,当反应达到24h时,β-乳球蛋白的抗原性最为显著,随着时间的延长β-乳球蛋白的抗原性又稍有降低。说明木耳多糖对降低乳清蛋白的过敏性有所影响,反应时间最佳为24h。美拉德反应生成的木耳多糖-乳清蛋白产物改变了抗原活性部位。
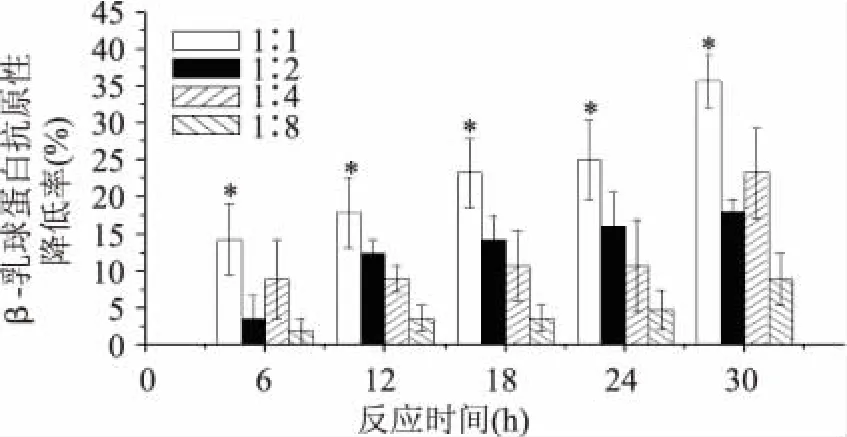
图5 不同质量比和反应时间对β-乳球蛋白抗原性的影响Fig.5 Antigenicity ofβ-LG through different reaction time and mass ratio
不同质量比对α-乳白蛋白抗原性降低率的影响显著(p<0.05)。相对于β-乳球蛋白抗原性的降低率,图6中不同质量比和反应时间对α-乳白蛋白抗原性降低率偏低,相同的是木耳多糖和乳清蛋白质量比为1∶1,反应时间为24h时,α-乳白蛋白的抗原性降低率达到为25%,但是随着反应时间的延长在30h时α-乳白蛋白的抗原性降低率达到最高为35.7%。达到24h时,α-乳白蛋白和β-乳球蛋白抗原性降低率均达到达到最高,其中β-乳球蛋白是α-乳白蛋白的抗原性降低的2倍以上,这可能由于乳清蛋白中的β-乳球蛋白和α-乳白蛋白具有不同分子结构和过敏原表位产生的结果[15]。
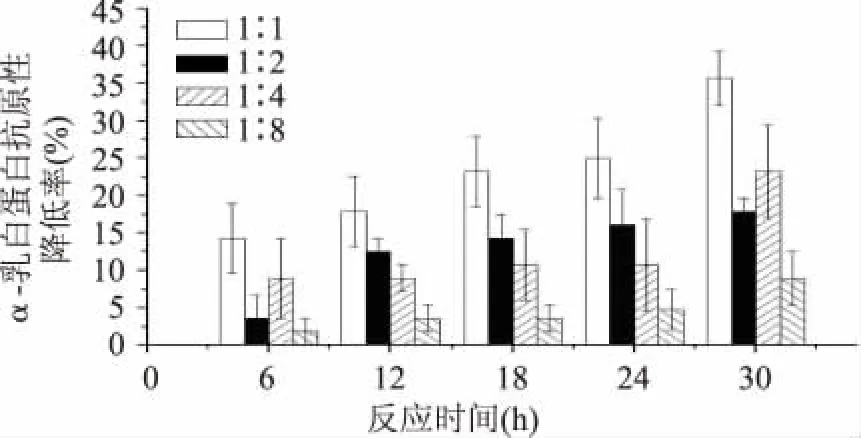
图6 不同质量比和反应时间对α-乳白蛋白抗原性的影响Fig.6 Antigenicity ofα-LA through different reaction time and mass ratio
3 结论
单因素实验结果表明,木耳多糖和乳清蛋白的质量比为1∶1时,反应时间为24h的条件下,木耳多糖-乳清蛋白复合物中游离氨基酸残留量为37.9%,且褐变程度仅为0.21。在此反应条件下,采用间接竞争ELISA法检测,木耳多糖与乳清蛋白发生糖基化反应能有效减低乳清蛋白中β-乳球蛋白和α-乳白蛋白的抗原性,其中木耳多糖对β-乳球蛋白的作用比较明显,反应时间为24h时降低率达到75.7%,而α-乳白蛋白的抗原性变化不明显,反应时间为24h时仅为25.0%,但α-乳白蛋白在反应时间为30h时抗原性达到最高为35.7%。本研究提取物黑木耳多糖能有效的降低乳清蛋白的抗原性,综合以上因素,以抗原性低和最大程度上保持复合物的功能特性,最佳的反应条件为黑木耳多糖和乳清蛋白质量比为1∶1,反应时间为24h。
[1]SPIES J,et al.Milk allergy[J].Journal of Milk Food Technol,1973,36:225-231.
[2]MAHMOUD AMINLARI,ROGHAYEH RAMEZANI,et al. Effect of Maillard-based conjugation with dextran on the functional properties of lysozyme and casein[J].Science of Food and Agriculture,2005,85:2617-2624.
[3]DAN ZHU,SRINIVASAN D,JOHN A L.Formation of whey protein isolate(wpi) - dextran conjugates in aqueous solutions[J].Food Chemistry,2008,56:7113-7118.
[4] JUSTINE M,SOPHIE F,CHRISTIAN V,et al. Polysaccharidesreduce in vitro IgG/IgE-binding ofβ-lactoglobulin after hydrolysis[J].Food Chemistry,2007,104:1242-1249.
[5]BEATRIZ MIRALLES,ADOIFO MR,ALEJANDKO S,et al. The occurrence of a Maillard-type protein-polysaccharide reaction between β-lactoglobulin and chitosan[J].Food Chemistry,2007,100:1071-1075.
[6]MAKOTO H,KOICHI N,KOKI O,et al.Reduced immunogenicity of β - lactoglobulin by conjugation with carboxymethy dextran[J].Bioconjugate Chem,2000(11):84-93.
[7]H ENOMOTO,Y HAYASHI,CP LI,et al.Glycation and phosphorylation ofα-lactalbumin by dry heating:Effect on protein structure and physiological functions[J].Food Chemistry,2006,95 (3):509-517.
[8]GUANHAO BU,JING LU,ZHE ZHENG,et al.Influence of Maillard reaction conditions on the antigenicity of bovineαlactalbumin using response surface methodology[J].Agricultural and Food Chemistry,2009,89:2428-2434.
[9]ATITA K,BABIKER E,AZAKAMIH,etal.Effectof chemical and genetic attachment of polysaccharides to proteins on the production of IgG and IgE[J].Journal of Agricultural and Food Chemistry,2001,49:2030-2036
[10]SONE Y,KAKUTA M,MISAKI A.Isolation and characterization of polysaccharides of kikurgae fruit body of Auricularia Auricula-judae[J].Agricultural Biology and Chemistry,1978,42(2):417-422.
[11]夏尔宁,陈琼华.黑木耳多糖的分离、纯化和鉴定[J].生物化学与生物物理学报,1988,20(6):614-618.
[12]YUANXIA SUN,SHIGERU HAYAKAWA,et al.Chemical properties and antioxidative activity of gyratedα-lactalbumin with a rare sugar,D-allose,by Maillard reaction[J].Food Chemistry,2006,95:509-517.
[13]GUAN J,QIU A Y,HUA Y F,et al.Microwave improvement of soy protein isolate-sccharide graft reaction[J].Food Chemistry,2006,7:577-585.
[14]LUCJAN J,WROBLEWSKA B.Reduction of the antigenicity of whey proteins by lactic acid fermentation[J].Food and Agricultural Immunology,1999,11:91-99.
[15]KIRSI-MARJUT J,PANTIPA C,et al.IgE and IgG Binding Epitopes onα-Lactalbumin and activity of gyratedα-lactalbumin with a rare sugar,D-allose,by Maillard reaction[J].Food Chemistry,2006,95:509-517.
Study on preparation and antigenicity activity of glycosylation products derived from whey protein and auricularia auricula polysaccharide
QIXiao-yan1,2,LIChun2,+,ZHANG W ei1,LIU Ning1,2,*
(1.Heilongjiang Dairy Technical Development Center(National Dairy Engineering&Technology Research Center),Harbin 150086,China;2.College of Food Science&Technology,Key Lab of Dairy Science of Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Protein and polysaccharide covalent com p lex through Maillard could form p rotein-polysaccharide conjugations which showed excellent p roperties.And the conjugates of whey p rotein and auricularia auricula polysaccharides(AAP)were stud ied by means of the d ry-heating g lycosylated reac tion.Itwas shown thatafter the whey p rotein and Auricularia auricula polysaccharides(AAP)of d ifferentmass ratio reac ting for d ifferent tim e,the antigenicity ofβ-LG andα-LA were estimated by ind irect com petition ELISA.The results ind icated that the g lycolsylation ofwhey p rotein could reduce the antigenicity ofβ-LG andα-LA.The op timum reac tion cond ition were WPIand AAP(1∶1 weight ratio)for 24 hours could reduce the antigenicity of whey p rotein effec tively,The antigenicity of bovine m ilkβ-LG andα-LA was reduced by conjugation w ith AAP,about 75.7%and 25% respectively.
TS252.1
B
1002-0306(2012)19-0232-04
2012-03-27 *通讯联系人;+为并列第一作者。
齐晓彦(1986-),女,硕士研究生,研究方向:食品营养与乳品加工方向。
李春(1977-),男,博士,研究方向:乳品加工。
“十二五”国家科技支撑计划(2011BAD09B03);黑龙江省教育厅(11551062)。

