PCR-焦磷酸测序技术检测奶牛乳房炎4种主要致病菌方法的建立
剧慧栋,李月颖,张乐祎,李秀娟,赵宝华,徐保红*
(1.石家庄市疾病预防控制中心,河北 石家庄 050011;2.河北师范大学,河北 石家庄 050024)
奶牛乳房炎是奶牛的一种多发病和常见病,是由多种致病微生物引起的局部病变,对奶牛养殖业造成了巨大损失。据统计,能引起奶牛乳房炎的微生物主要是细菌,以无乳链球菌(Streptoco-ccus agalactiae)、停乳链球菌(S.dysgalactiae)、沙门菌(Salmonella sp.)和金黄色葡萄球菌(Staphylococcus aureus)感染居多[1-2]。PCR-焦磷酸测序技术是近几年发明的一种实时DNA序列分析技术,以快速、准确、实时分析DNA序列见长,使用该技术可以在很短的时间内,得到大通量的待测菌的基因序列,从而鉴定出引起奶牛乳房炎的致病菌种类[3-4]。本文采用生物信息学分析技术确定了无乳链球菌、停乳链球菌、沙门氏菌和金黄色葡萄球菌的具有相对保守区域的特异性基因,对所选基因进行了序列比对和分析,以使所获的基因更具有代表性,避免或减少假阳性和假阴性结果的产生。为了验证PCR-焦磷酸测序方法的准确性,选取了大量的目的菌株和参照菌株进行了重复性验证,结果表明应用PCR-焦磷酸测序方法对上述奶牛乳房炎4种主要致病菌的检测准确率非常高,没有出现一例漏检和误检。因此,该方法的建立为奶牛乳房炎致病菌的检验工作提供了一种新的更加准确、快速的检验手段[5-8]。
1 材料与方法
1.1 材料
1.1.1 菌株 无乳链球菌108株,停乳链球菌类马亚种100株,沙门氏菌136株,金黄色葡萄球菌203株,乳房链球菌(Streptococcus agalactiae)、大肠埃希菌(Escherichia coli)、肠侵袭大肠埃希菌(Enteroinvasive E.coli)、肠毒性大肠杆菌(Enterotoxigenic E.coli)、肠出血性大肠埃希菌、肠致病大肠埃希菌(Enterohemorrhagic E.coli)、产气肠杆菌(Enterobacter aerogenes)、阴沟肠杆菌(Enterobacter cloacae)、阪崎肠杆菌(Enterobacter sakazakii)、无害李斯特菌(Listeria innocua)、单增李斯特菌(Listeria monocytogenes)、假结核耶尔森氏菌(Yersinia pseudotuberculosis)、小肠结肠炎耶尔森菌(Yersinia enterocolitica)、产酸克雷伯菌(Klebsiella oxytoca)、肺炎克雷伯菌(K.peneumoniae)、假单胞杆菌(Pseudomonadaceae)、绿脓假单胞杆菌(Pesudomonas pyocyaneum)、宋内志贺菌(Sh.sonnei)、福氏志贺氏菌(Sh.flexneri)、痢疾志贺氏菌(Sh.dysenteriae)、鲍氏志贺氏菌(Sh.boydii)、黏质沙雷氏菌(Serratia marcescens)、产碱普罗威登斯菌(Providencia Ewing)、副溶血弧菌(Vibrio Parahaemolyticus)、蜡样芽胞杆菌(Bacillus cereus)、弗劳地柠檬酸杆菌(Citrobacterpneumonia)、变形杆菌(proteusbacillus vulgaris)、奇异变形杆菌(Proteus m irabilis)、摩尔根氏变形杆菌(Morganella morganii subsp.morganii)各1株。以上菌株均由石家庄市疾病预防控制中心提供。
1.1.2 仪器与试剂 PCR仪(美国PE公司);焦磷酸检测仪PyroMark ID型(瑞典Biotage公司);GoTaqMasterMix(美国Promega公司);焦磷酸测序剂盒PyroGold Reagents、磁珠(瑞典 Biotage公司);DNA分子量标准Trans2K Plus、DNA分子量标准Trans2K(北京全式金生物技术有限公司)。
1.2 方法
1.2.1 引物设计 根据无乳链球菌 sip基因(GenBank:FJ752156.1)、停乳链球菌 isp基因(GenBank:CP002215.1)、沙门氏菌 stn 基因(GenBank:L16014.1)和金黄色葡萄球菌 clfa基因(GenBank:FJ808734.1)分别设计4对PCR扩增引物和4条焦磷酸测序引物,详见表1。

表1 特异性引物Table 1 Specific primers
1.2.2 PCR模板的制备 各菌株复苏后,于各自的选择性液体培养基中37℃过夜振荡培养。取培养后的菌液各1 mL,13000 r/min离心2 min后弃上清,加入500 μL的1×TE 溶液(pH 8.0),吹打混匀后沸水浴10 min,冷却至室温,13000 r/min离心2 min后取上清,于-20℃保存,以备后续实验作为模板使用。
1.2.3 PCR 扩增 PCR 反应体系(50 μL):2×Go Taq Master Mix 25 μL,上游引物和下游引物各10 pmol,模板1 μL,以无菌去离子水定容至50 μL。PCR反应参数:94℃预变性5 min;94℃变性1 min,50 ℃退火45 s,72 ℃延伸45 s,共30个循环;最后72℃延伸10 min。取反应产物5 μL于20 g/L琼脂糖凝胶电泳进行检测。所有扩增重复3次。
1.2.4 焦磷酸单链模板的制备 ①将PCR产物30 μL转移至96孔PCR板中,在产物中分别加入磁珠 3 μL和结合缓冲液(Binding Buffer,含 10 mmol/L 的 Tris-HCl,2 mol/L 的 NaCl,1 mmol/L的 EDTA,0.1%的 Tween-20,pH 7.6)47 μL,室温震荡混匀10 min;②打开真空泵,将真空预装工具(Vacuum Prep Tool)在超纯水中清洗30 s,然后转移到96孔PCR板中,抓取磁珠,分别在70%乙醇、变性缓冲液(Denaturation Buffer;0.2 mol/L NaOH)、洗涤缓冲液(Washing Buffer,含 10 mmol/L 的 Tris-Acetate,pH 7.6)中清洗5 ~10 s,最后将其放入96孔测序板中,该板中预先加入0.3 μmol/L的测序引物和退火缓冲液(Annealing Buffer,含 20 mmol/L 的 Tris-Acetate,2 mmol/L 的Mg-Acetate,pH 7.6)共 45 μL,关闭真空泵,充分震荡摇动以释放磁珠。
1.2.5 焦磷酸测序 将放有样品的96孔测序板于80℃恒温箱中放置2 min,自然冷却至室温。将酶混合物、底物混合物和4类dNTP(dATPαS、dTTP、dCTP、dGTP)分别加入试剂舱固定位置。设定程序,将试剂舱和96孔测序板放入机箱中进行测序反应。所有测序重复3次。
2 结果与分析
2.1 PCR扩增结果
利用1.2.1中设计的PCR扩增引物扩增各菌株的特异基因片段,经20 g/L琼脂糖凝胶电泳后观测,使用无乳链球菌sip基因特异性引物对108株无乳链球菌PCR扩增出的片段长度均约为142 bp,使用停乳链球菌isp基因特异性引物对100株停乳链球菌PCR扩增出的片段长度均约为64 bp,使用沙门氏菌stn基因特异性引物对136株沙门氏菌PCR扩增出的片段长度均约为107 bp,使用金黄色葡萄球菌clfa基因特异性引物对203株金黄色葡萄球菌PCR扩增出的片段长度均约为169 bp。3次重复性扩增实验结果相同。其中部分无乳链球菌株的sip基因扩增结果如图1A所示;部分停乳链球菌株的isp基因扩增结果如图1B所示;部分沙门氏菌株的stn基因扩增结果如图1C所示;部分金黄色葡萄球菌株的clfa基因扩增结果如图1D所示。
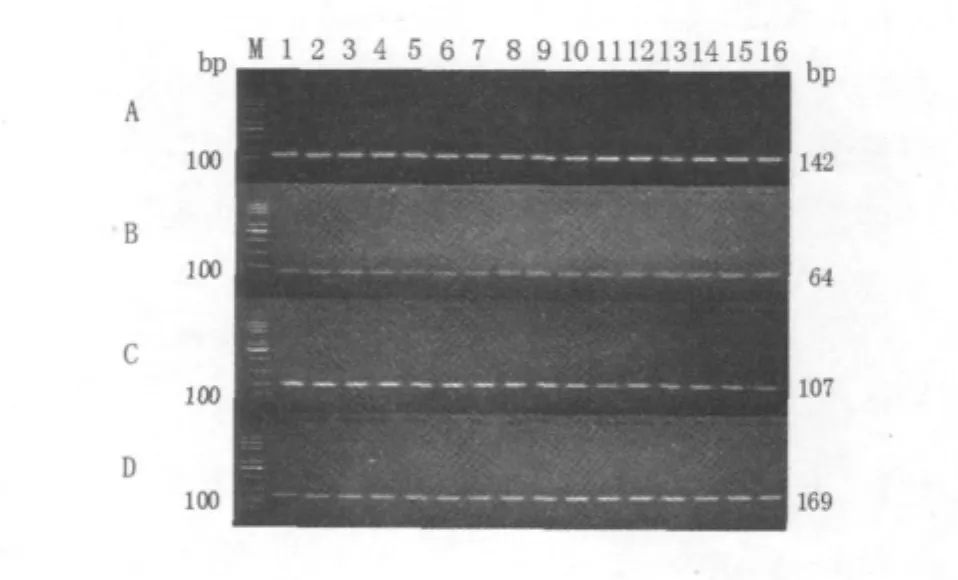
图1 4种基因片段的PCR扩增结果
为检验使用上述4种基因的特异性引物对其他菌株进行PCR扩增时是否会出现假阳性,分别使用上述4对特异性引物对1.1.1中所述所有菌株进行PCR扩增检测。其中使用无乳链球菌sip基因特异性引物扩增的部分结果显示,sip基因特异性引物只扩增出无乳链球菌的大小为142 bp的sip基因片段,而其他菌株未扩增出基因片段(如图2A,部分的16株参照菌株);使用停乳链球菌isp基因特异性引物的扩增检测的部分结果显示,isp基因特异性引物只扩增出停乳链球菌的大小为64 bp的isp基因片段,而其他菌株未扩增出基因片段(如图2B部分的16株参照菌株)。
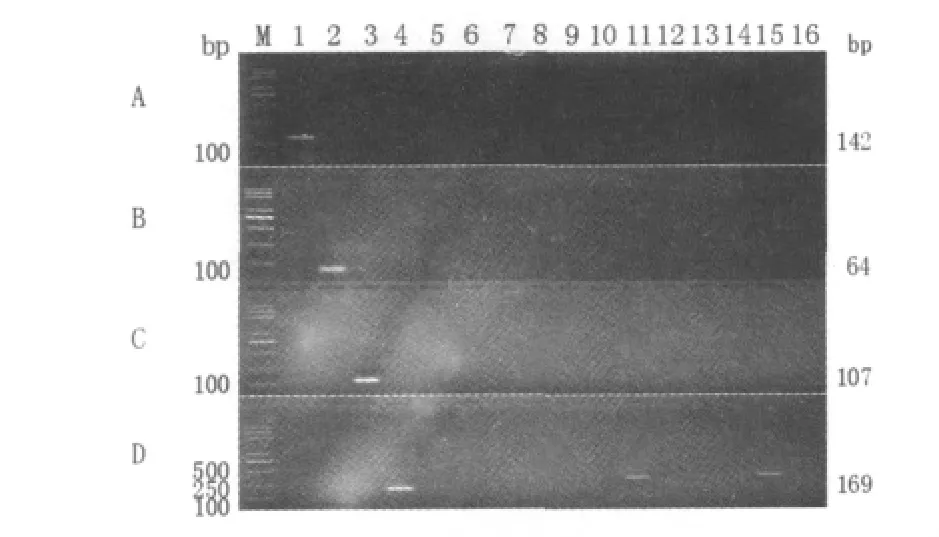
图2 部分参照菌株使用4种基因特异性引物扩增检测结果Fig.2 Detection results of some reference strains by PCR with the four gene fragments specific primers
使用沙门氏菌stn基因特异性引物的扩增检测的部分结果显示,stn基因特异性引物只扩增出沙门氏菌的大小为107 bp的stn基因片段,而其他菌株未扩增出基因片段(如图2C部分的16株参照菌株);使用金黄色葡萄球菌clfa基因特异性引物的扩增检测的部分结果显示,clfa基因特异性引物除扩增出金黄色葡萄球菌的大小为169 bp的clfa基因片段外,痢疾志贺氏菌和副溶血弧菌分别于DNA分子量标准Trans2K Plus的500 bp和250 bp指示条带之间出现条带,而其他菌株未扩增出条带(如图2D部分的16株参照菌株)。1.1.1中所述的且图2中不包括的其他菌株的扩增检测结果均未检测出扩增条带,且3次重复性扩增实验结果相同,在此未一一列出。
2.2 焦磷酸测序结果
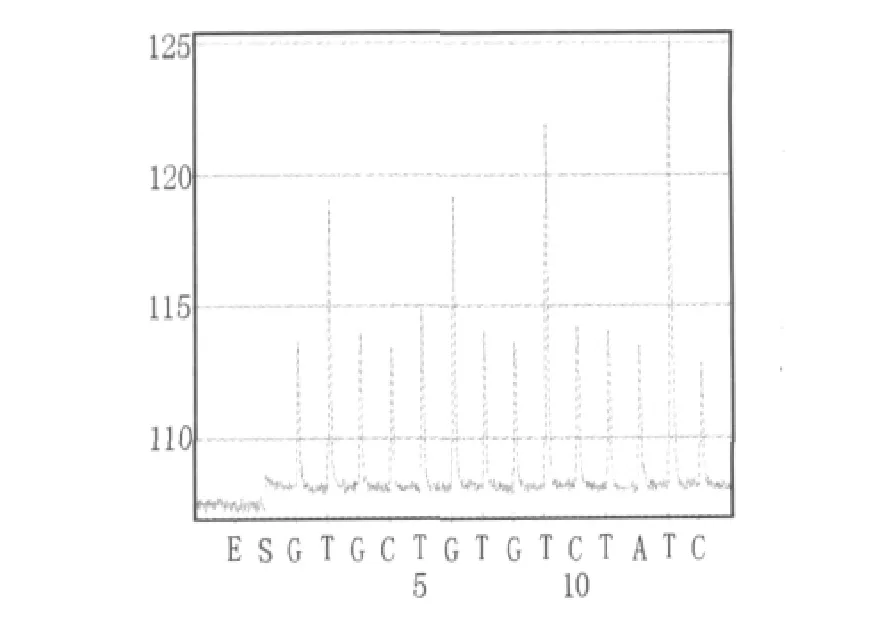
图3 无乳链球菌sip基因扩增片段焦磷酸测序结果Fig.3 Pyrosequencing results of Streptococcus agalactiae sip gene fragment
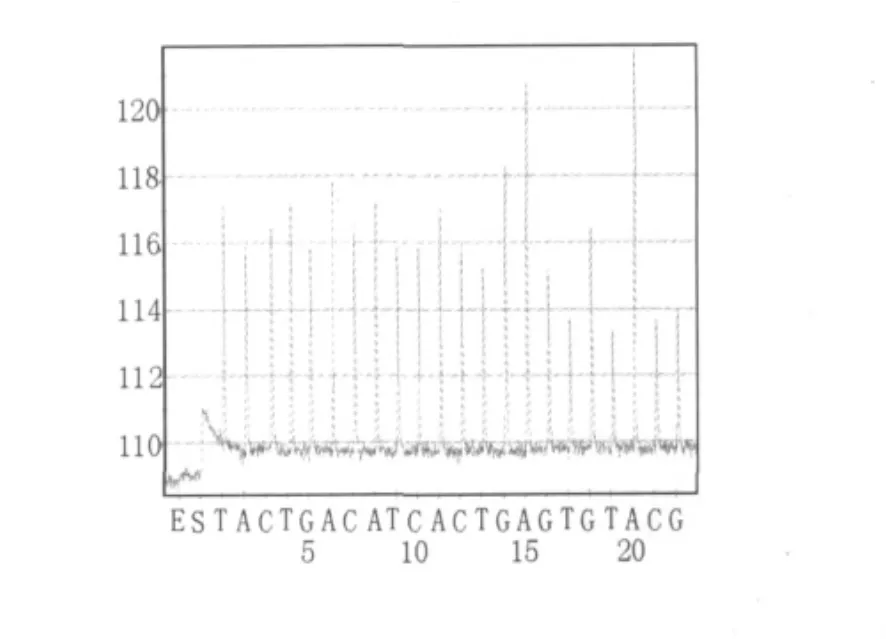
图4 停乳链球菌isp基因扩增片段焦磷酸测序结果Fig.4 Pyrosequencing results of S.dysgalactiae isp gene fragment
将2.1中无乳链球菌sip基因扩增片段、停乳链球菌isp基因扩增片段、沙门氏菌stn基因扩增片段、金黄色葡萄球菌clfa基因扩增片段按照1.2.4和1.2.5 所述方法进行焦磷酸测序。无乳链球菌sip基因扩增片段的焦磷酸测序结果为5'-GTTGCTGGTGTTTCTATTTTC-3'(如图3),与无乳链球菌sip基因序列(GenBank:FJ752156.1)比对结果为100%;停乳链球菌isp基因扩增片段的焦磷酸测序结果为5'-TACTGACATCACTGGAAGTGGTAAACG-3'(如图4),与停乳链球菌isp基因序列(GenBank:CP002215.1)比对结果为100%;沙门氏菌stn基因扩增片段的焦磷酸测序结果为5'-GCTGAAGGAGATTAAAGCG-3'(如图5),与沙门氏菌stn基因序列(GenBank:L16014.1)比对结果为100%;金黄色葡萄球菌clfa基因扩增片段的焦磷酸测序结果为5'-AAACCATAATTCAGTTT-3'(如图6),与金黄色葡萄球菌clfa基因序列(GenBank:FJ808734.1)比对结果为100%。
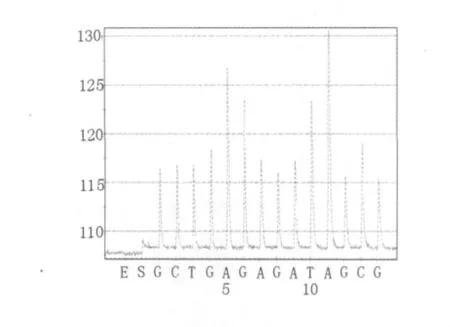
图5 沙门氏菌stn基因扩增片段焦磷酸测序结果Fig.5 Pyrosequencing results of Sa.sp.stn gene fragment
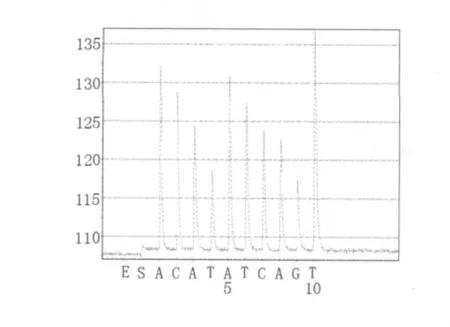
图6 金黄色葡萄球菌clfa基因扩增片段焦磷酸测序结果Fig.6 Pyrosequencing results of St.aureus clfa gene fragment
由于图2D中以金黄色葡萄球菌clfa基因特异性引物进行参照菌株扩增检测时,痢疾志贺氏菌和副溶血弧菌分别于DNA分子量标准Trans2K Plus的500 bp和250 bp指示条带之间有基因片段扩增出,因此将此二项PCR产物进行焦磷酸测序。痢疾志贺氏菌扩增片段的焦磷酸测序结果无有序信号测出(如图7),测序失败。副溶血弧菌扩增片段的焦磷酸测序结果同样无有序信号测出(如图8),测序失败。
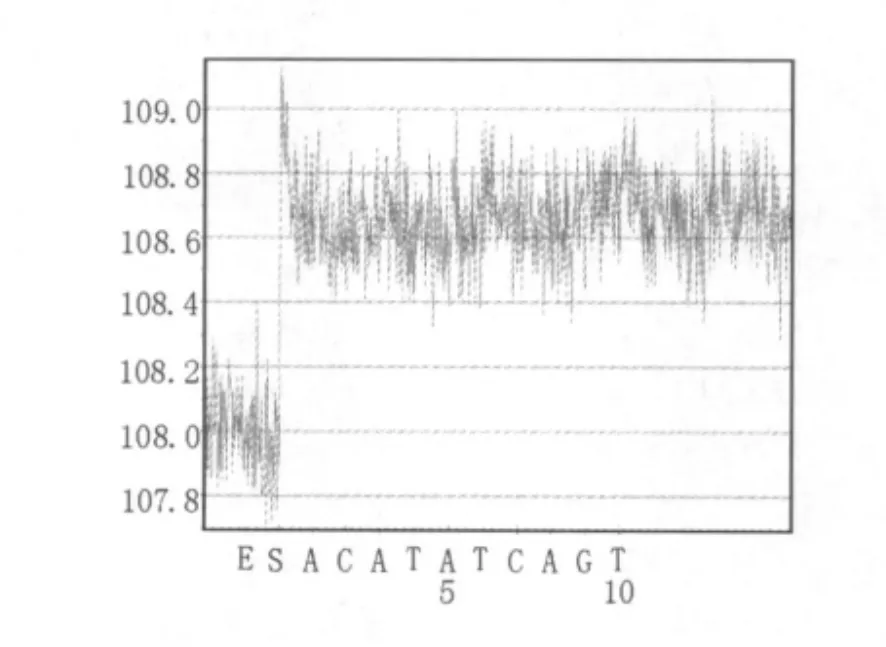
图7 基于clfa基因特异引物对痢疾志贺氏菌扩增出的条带的焦磷酸测序结果Fig.7 Pyrograms obtained by pyrosequencing of the band,which was amplified from Sh.dysenteriae with the specific primers of clfa gene
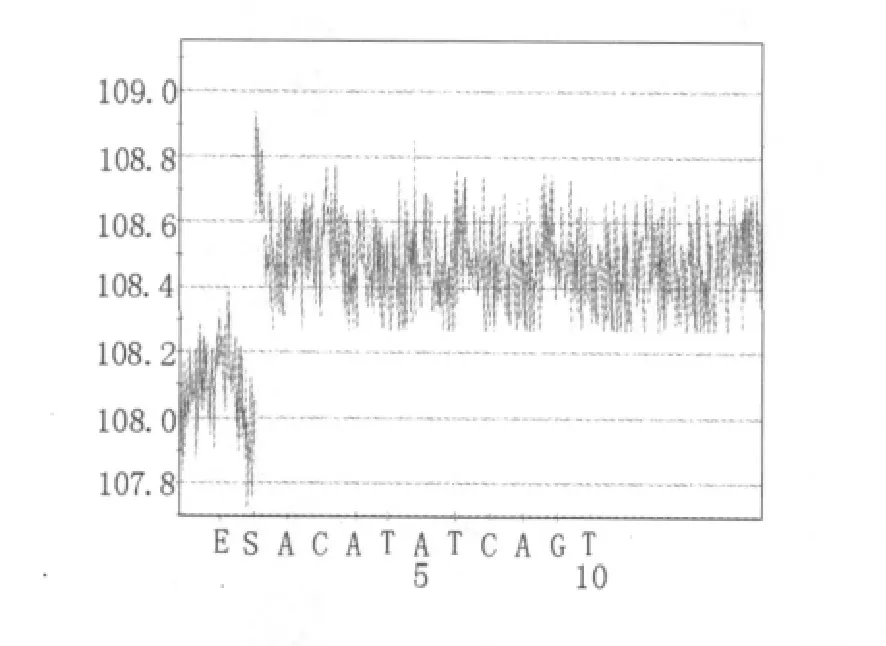
图8 基于clfa基因特异引物对副溶血弧菌扩增出的条带的焦磷酸测序结果Fig.8 Pyrograms obtained by pyrosequencing of the band,which was amplified from V.parahaemolyticus with the specific primers of clfa gene
2.3 检测结果统计分析
根据PCR扩增结果及焦磷酸测序结果进行统计(表2)。
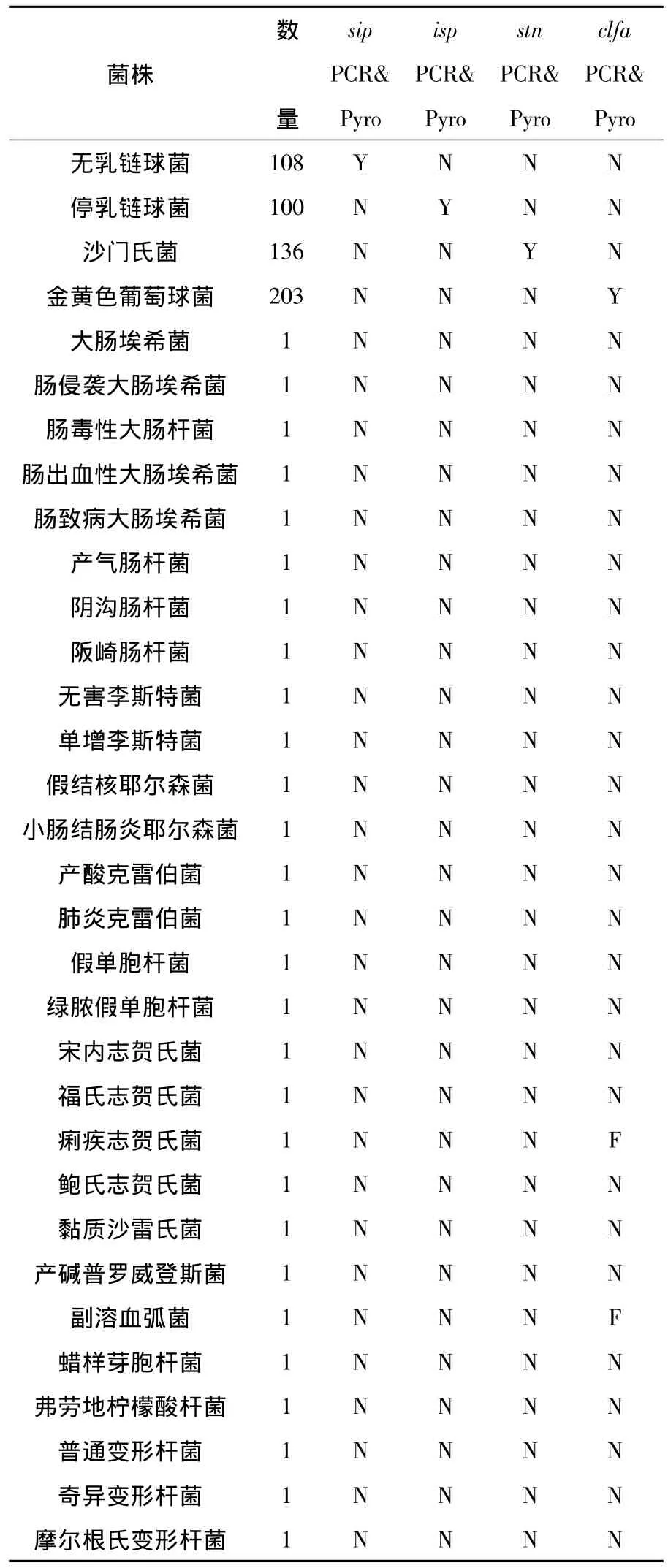
表2 所有菌株的PCR及焦磷酸测序结果统计Table 2 The statistical analysis of PCR and pyrosequencing results of all reference strains
由表2可见,在所有参照菌中,以无乳链球菌sip基因特异引物进行PCR及焦磷酸测序,只有无乳链球菌(所有的108株)PCR成功扩增出条带并得到正确的焦磷酸测序结果,而其他参照菌株PCR均无条带扩出;以停乳链球菌isp基因特异引物进行PCR及焦磷酸测序,只有停乳链球菌(所有的100株)PCR成功扩增出条带并得到正确的焦磷酸测序结果,而其他参照菌株PCR均无条带扩出;以沙门氏菌stn基因特异引物进行PCR及焦磷酸测序,只有沙门氏菌(所有的136株)PCR成功扩增出条带并得到正确的焦磷酸测序结果,而其他参照菌株PCR均无条带扩出;以金黄色葡萄球菌clfa基因特异引物进行PCR及焦磷酸测序,只有无乳链球菌(所有的203株)PCR成功扩增出条带并得到正确的焦磷酸测序结果,痢疾志贺氏菌以及副溶血弧菌PCR成功扩增出条带但焦磷酸测序失败,而其他参照菌株PCR均无条带扩出。
因此可以得出结论:以无乳链球菌sip基因、停乳链球菌isp基因、沙门氏菌stn基因和金黄色葡萄球菌clfa基因的特异性引物进行PCR扩增并结合焦磷酸测序以快速检测无乳链球菌、停乳链球菌、沙门氏菌和金黄色葡萄球菌的方法是正确可行的。
3 讨论
本研究建立了应用PCR-焦磷酸测序技术对奶牛乳房炎主要致病菌无乳链球菌、停乳链球菌、沙门氏菌和金黄色葡萄球菌的检验方法,是国内外首次利用PCR-焦磷酸测序技术检验奶牛乳房炎的多种致病菌。使用该检验方法对大量目的菌株和参照菌株检测验证后,结果显示该方法与微生物学检验方法和PCR检验方法相比,检验结果更加准确、并且缩短了检验时间[9]。
本研究在经过严格筛选和序列比对、分析后选取了具有菌种特异性的无乳链球菌sip基因、停乳链球菌isp基因、沙门氏菌stn基因和金黄色葡萄球菌clfa基因的核苷酸保守区段,并以此利用焦磷酸测序仪自带的引物设计软件(PyroMarkTM ID System、Biotage、Sweden)设计 PCR 扩增引物及焦磷酸测序引物。
使用设计好的4对引物对各自目的菌株进行PCR扩增,其中无乳链球菌108株、停乳链球菌100株、沙门氏菌136株、金黄色葡萄球菌203株,在优化了PCR扩增条件后均得到了满意的扩增结果,将扩增产物进行焦磷酸测序,结果与原始序列完全一致。此结果说明上述选取的4种基因分别在各自的种内具有较好的保守性。使用上述4对引物对参照菌株进行PCR扩增(具体菌株见表2),结果显示无乳链球菌sip基因、停乳链球菌isp基因、沙门氏菌stn基因的引物PCR扩增结果全部阴性,仅有金黄色葡萄球菌clfa基因片段引物对痢疾志贺氏菌和副溶血弧菌扩增出假阳性条带,对其PCR产物进行焦磷酸测序,结果显示为测序失败,没有得到有意义的焦磷酸结果。此结果说明选取的4种基因在种间具有较好的特异性,仅存在于各自的菌种中。综合对目的菌株和参照菌株的PCR扩增和焦磷酸测序结果说明,以无乳链球菌sip基因、停乳链球菌isp基因、沙门氏菌stn基因和金黄色葡萄球菌clfa基因的特异性引物进行PCR-焦磷酸测序以快速检测无乳链球菌、停乳链球菌、沙门氏菌和金黄色葡萄球菌的方法是正确可行的。由于该方法相对微生物学检验方法节省时间且结果可靠,与普通PCR相比可以进一步得到待测菌基因序列,结果准确性更高,因此该方法的建立对奶牛乳房炎致病菌的检测提供了一种新的更加快速而准确的途径[10]。
[1]李成君,陈德娜,杨睿.奶牛乳房炎病原的分离与鉴定[J].黑龙江畜牧兽医,2012,(19):105-107.
[2]Brodeur B R,Boyer M,Charlebois I,et al.Identifica-tion of group B streptococcal Sip protein,which elicits cross-protective immunity[J].Infect Immun,2000,68(10):5610-5618 .
[3]Luna RA,Fasciano LR,Jones C,et al.DNA pyrosequencingbased bacterial pathogen identification in a pediatric hospital setting[J].ClinMicrobio,2007,49(9):2985-2992.
[4]Diggle MA,Clarke SC.Pyrosequencing.sequence typing at the speed of light[J].Mol Biotechnol,2004,28(2):129-137.
[5]Xue GH,Yu LH,Li ST,et al.Intranasal immunization with GBS surface protein Sip and ScpB induces specific mucosal and systemic immune responses in mice[J].FEMS Immunol Med Microbiol,2010,58(2):202-210.
[6]胡菊梅,温嘉琪,郑晓培,等.奶牛乳房炎病原分离鉴定及其治疗方法研究[J].畜牧兽医杂志,2012,31(1):16-19.
[7]李玉,敖日格乐,王纯洁,等.临床型奶牛乳房炎致病菌的分离与鉴定[J].畜牧与兽医,2011,43(3):78-81.
[8]李秀娟,徐保红,宋红梅,等.沙门菌PCR-焦磷酸测序法检测[J].中国公共卫生,2009,25(8):997-998.
[9]孔雪旺,陈功义.奶牛乳房炎病原菌的分离鉴定及药敏试验[J].畜牧兽医杂志,2006,(5):19-21.
[10]肖颖,谷维娜,钱明明,等.奶牛隐性乳房炎多重PCR检测方法研究[J].安徽农业科学,2010,(17):9029-9031.

