CHO细胞连续传代培养对细胞毒性试验结果的影响
夭建华,管 莹,高 茜,米其利,朱洲海,李雪梅,缪明明
(云南烟草科学研究院,云南 昆明650106)
体外细胞毒性试验作为一类重要的体外试验,在新药研发、化学物质毒性评价方面发挥着重要的作用[1~5]。中性红比色法和噻唑蓝(MTT)比色法具有简便、快捷、灵敏等特点,是目前应用较多的毒理学检测细胞毒性的方法。作为评价方法,其结果的可重复性十分重要。
中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞被广泛应用于细胞毒理学试验。但CHO细胞连续传代至一定代次后,在检测参比标准样品的细胞毒性时,结果有显著差异。为了寻找生物学状态稳定的连续传代代次,作者在此比较了连续传代培养的CHO细胞的形态学特征,并研究了CHO细胞连续传代培养对细胞毒性试验结果的影响,拟为提高中性红比色法和MTT比色法进行细胞毒性评价的稳定性提供参考。
1 实验
1.1 试剂与仪器
DMEM/F12(Solarbo 公 司),胎 牛 血 清 (美 国Klark),PBS,胰酶,中性红(Sigma公司),二甲基亚砜(DMSO)。
二氧化碳培养箱(Forma公司),96孔及24孔细胞培养板(Corning公司),酶标仪(Bio-Rad公司),半自动转盘式吸烟机(Borgwaldt RM20/CS)。
1.2 卷烟烟气样品的制备[6]
利用半自动转盘式吸烟机抽吸40支标准测试用卷烟3R4F,用直径92mm的剑桥滤片捕集燃吸后产生的烟气总粒相物(TPM),称重;将剑桥滤片放入三角瓶中,加入适量DMSO,置于超声仪上超声20min;用无菌滤纸过滤,收集TPM提取液,调整TPM在DMSO中的终浓度为10mg·mL-1;将样品分装后储存于-80℃,待用。
1.3 方法
1.3.1 细胞的传代培养
将CHO细胞复苏后制成单细胞悬液,调整细胞密度,接种到细胞培养瓶中,置于37℃、5%CO2培养箱中培养,记为第1代细胞。待细胞汇合率达到80%时,按1∶4比例传代,汇合率再次达到80%时记为第3代细胞。以此类推,连续传代至第17代。
1.3.2 细胞形态的观察
细胞计数后接种于96孔板中,置于37℃、5%CO2培养箱中培养24h后,于倒置显微镜下观察CHO细胞形态,并拍照记录。
1.3.3 中性红比色法测定受试物对细胞的毒性
分别取第1、5、9、13、17代对数生长期的CHO细胞,用胰酶进行消化,吹打均匀,细胞计数后以5×104个·mL-1的细胞密度接种于96孔板中,每孔200μL,置于37℃、5%CO2培养箱中培养24h;加入终浓度分别为10μg·mL-1、75μg·mL-1、120μg·mL-1、160μg·mL-1、200μg·mL-1的受试物,每个浓度6个复孔,置于37℃、5%CO2培养箱中培养24h;加入浓度为100μg·mL-1的 中性红DMEM无血清培养液,每孔200μL,置于37℃、5%CO2培养箱中培养3h;去除中性红溶液,加入1%的甲醛溶液200μL,固定1min;去除固定液,每孔加入200μL中性红萃取液(水∶乙醇∶乙酸 =49∶50∶1,现配),置于微量振荡器上振荡10min,用酶标仪测量540nm处吸光度值。按下式计算细胞抑制率(X):
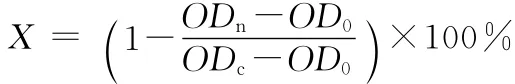
式中:ODn、OD0、ODc分别为样品、空白、细胞对照的多孔平均的吸光度值。
1.3.4 MTT比色法测定受试物对细胞的毒性
分别取第1、5、9、13、17代对数生长期的CHO细胞,用胰酶进行消化,吹打均匀,细胞计数后分别以5×104个·mL-1的细胞密度接种于96孔板中,每孔200μL,置于37℃、5%CO2培养箱中培养24h;加入终浓度分别为10μg·mL-1、75μg·mL-1、120μg·mL-1、160μg·mL-1、200μg·mL-1的受试物,每个浓度6个复孔,置于37℃、5%CO2培养箱中培养24h;加入浓度为5mg·mL-1的 MTT溶液,每孔20μL,置于37℃、5%CO2培养箱中培养3h;去除溶液,加入DMSO溶液,每孔200μL,置于微量振荡器上振荡10min,用酶标仪测量490nm处吸光度值,计算细胞抑制率。
2 结果与讨论
2.1 细胞形态(图1)

图1 光镜下CHO细胞的形态(×200)Fig.1 Morphology of CHO cells under light microscopy
由图1可见,培养初期(第1代),细胞呈短梭状,包浆折光性强,边界清晰,排列整齐有序(图1a);培养中期(第5代、第9代),细胞开始呈长梭状,包浆折光性变弱,边界分明,排列整齐(图1b、c);培养后期(第13代、第17代),胞体扁平且宽大,形态不规则,边界模糊,排列凌乱无序,包浆内累积大量细小颗粒(图1d、e)。
2.2 细胞代次对受试物细胞抑制率的影响
分别采用中性红比色法以及MTT比色法检测3R4F参比卷烟烟气受试剂量为10μg·mL-1、75μg·mL-1、120μg·mL-1、160μg·mL-1、200μg·mL-1时的CHO细胞抑制率,结果见图2。
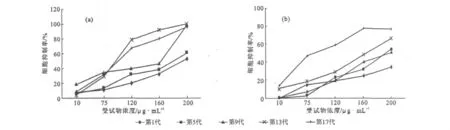
图2 中性红比色法(a)和MTT比色法(b)测定同一受试物对不同代次CHO细胞的抑制率Fig.2 Inhibition rate of the same inhibitor to CHO cells in different passages determined by neutral red assay(a)and MTT assay(b)
由图2a可以看出,采用中性红比色法测试CHO细胞抑制率,随着细胞代次的升高,同一受试剂量下受试物对CHO细胞的抑制率总体呈上升趋势。其中第1代、第5代以及第9代3个试验组的细胞抑制率较为一致,而第13代和第17代2个试验组的测定结果与其余3个试验组有显著差异(P<0.05)。
由图2b可以看出,采用MTT比色法测试CHO细胞抑制率,随着细胞代次的升高,同一受试剂量下受试物对CHO细胞的抑制率呈上升趋势。其中第1代、第5代、第9代以及第13代4个试验组的细胞抑制率较为一致,而第17代测定结果与其余4个试验组有显著差异(P<0.05)。
2.3 讨论
目前CHO细胞被国内外多家烟草公司用于体外细胞毒性试验,以评价卷烟烟气的生物学毒性[7,8]。该细胞具有永生性,属无限细胞系,理论上具有无限传代的寿命。有研究报道,STO永生细胞系长期的连续传代会对其结构与功能特性造成影响[9]。那么同样具有永生性的CHO细胞,长期连续传代培养是否同样会对其结构和功能产生影响[10,11],目前还未见报道。
本研究对连续传代的CHO细胞的形态进行了观察。结果显示,随着细胞连续传代代次的升高,CHO细胞的形态发生了明显的退行性变化。从培养初期的呈短梭状、包浆折光性强、边界清晰、排列整齐有序的状态逐渐转变为培养后期的扁平且宽大、形态不规则、边界模糊、包浆内累积大量细小颗粒、排列凌乱无序的状态。当细胞连续传代培养超过9代后,细胞呈现明显的衰老状态。
为了进一步检测长期连续传代培养对CHO细胞结构产生的差异是否会对细胞毒性试验的结果产生影响,分别取不同代次的CHO对数生长期的细胞,利用中性红比色法以及MTT比色法对3R4F参比卷烟烟气受试剂量为10μg·mL-1、75μg·mL-1、120μg·mL-1、160μg·mL-1、200μg·mL-1时的CHO细胞抑制率进行检测。无论是中性红比色法还是MTT比色法测定的结果均显示,随着细胞代次的升高,同一受试剂量下受试物对CHO细胞的抑制率均呈上升趋势。
用连续培养9代以内的CHO细胞进行中性红细胞毒性试验的结果较为一致,而连续培养13代以内的CHO细胞进行MTT细胞毒性试验的结果无显著差异。从两种方法检测得到的细胞代次对细胞毒性试验结果的不同影响可以看出,中性红比色法较MTT比色法对细胞的衰老更为灵敏。这可能是由于,中性红作为一种阳离子活性染料,以离子扩散方式进入细胞膜并与溶酶体基质的阴离子部分结合[3]。伴随着细胞的衰老,细胞膜的通透性发生了改变(对细胞的形态进行观察可以清楚看到,随着细胞代次的升高,细胞边界变得模糊,细胞膜大面积损伤),导致中性红的摄入下降。而作为针对活细胞线粒体中的琥珀酸脱氢酶的MTT比色法对细胞衰老的反应相对滞后。
无论是用中性红比色法还是MTT比色法对受试物的细胞毒性进行检测,随着细胞连续传代代次的升高,同一受试物在相同剂量下对细胞的抑制率均呈上升趋势。这说明细胞代次的确是影响中性红比色法和MTT比色法检测稳定性的重要因素。因此,为了提高细胞毒性试验结果的可重复性以及可比性,细胞的连续传代培养代次是重要的控制因素。
3 结论
研究了CHO细胞连续传代培养对细胞毒性试验结果的影响。对不同代次CHO细胞形态进行观察,并利用中性红比色法、MTT比色法检测同种受试物对不同代次CHO细胞的抑制率是否有显著差异。结果表明:随着细胞代次的升高,细胞的形态、胞浆折光性、边界、排列均发生了改变;同种受试物对CHO细胞的抑制率随细胞代次的升高呈上升趋势;中性红比色法较MTT比色法对细胞的衰老更灵敏。为了提高细胞毒性试验结果的可重复性以及可比性,细胞代次是需要控制的重要因素。
[1]林祥梅,王建峰,梅琳,等.用人角质细胞评价4种化妆品的细胞毒性[J].毒理学杂志,2008,22(1):75-76.
[2]马亚萍,白剑英.MTT法探讨N-乙酰半胱氨酸对Na2SO3小鼠脾淋巴细胞毒性的影响[J].山西医科大学学报,2006,37(10):1020-1021.
[3]熊习昆,杨颖,谭小华,等.3T3中性红试验在化妆品光毒检测中的应用[J].中国公共卫生,2006,22(10):1207-1209.
[4]刘锐克,周军兰,梁建辉.中性红比色法检测大鼠小脑神经瘤活细胞[J].中国药理学与毒理学杂志,2003,17(1):74-78.
[5]苏建青,褚秀玲,李俊霞,等.中性红染色法检测人参皂苷及其衍生物对CEF增殖的影响[J].安徽农业科学,2009,37(35):17523-17525.
[6]GB/T 19609-2004,卷烟用常规分析 用吸烟机测定总粒相物和焦油[S].
[7]夭建华,缪明明,米其利,等.卷烟主流烟气细胞毒性在5种细胞系中的反应差异[J].中国烟草学报,2011,17(3):67-70.
[8]Johnson M D,Schilz J,Djordjevic M V,et al.Evaluation of in vitro assays for assessing the toxicity of cigarette smoke and smokeless tobacco[J].Cancer Epidemiol Biomarkers Prev,2009,18(12):3263-3304.
[9]剧世强,卢晓,李冬,等.体外连续传代培养对STO细胞生长特性的影响[J].西北农林科技大学学报,2006,34(Z1):190-194.
[10]徐学振,于占革,杨威,等.不同代次兔髓核细胞冻存后的生物学特性比较[J].中国脊柱脊髓杂志,2011,21(8):680-684.
[11]蔡霞,高学军,张鹏,等.体外培养不同代次人成纤维细胞的衰老程度[J].中国临床康复,2005,9(26):60-62.

