荧光猝灭法研究Mn(Ⅱ)和Zn(Ⅱ)与牛血清白蛋白的结合竞争
李 艳,彭艳红
(湖北科技学院核技术与化学生物学院,湖北 咸宁437100)
蛋白质是细胞内重要的生物大分子、功能分子,具有运载和储存功能[1~3]。血清白蛋白是血浆中含量最丰富的重要载体蛋白,药物进入血浆后,首先与血清白蛋白结合,然后再被运送到身体的各部位发挥药效[4~6]。各种金属离子进入人体一般需要通过血浆的储存和运输到达受体部位,产生药理作用。研究金属离子与血清白蛋白的相互作用,对了解金属离子的作用机制具有重要意义。荧光法研究金属离子与蛋白质的结合,灵敏度高、选择性好、操作简便易行,是应用最普遍的研究手段之一。
Zn与Mn都是人体必需的元素。Zn能构成一些酶的活性部位,催化多种化合物的水解、水合和脱羧等反应[7];若缺少 Mn会使人智力低下、发育不良[8]。作者在此首先采用荧光猝灭法研究Mn(Ⅱ)与牛血清白蛋白(BSA)的结合作用,在此基础上进一步研究 Mn(Ⅱ)和Zn(Ⅱ)与BSA的结合竞争。
1 实验
1.1 试剂与仪器
牛血清白蛋白(BSA),分子量68 000,华美公司;Tris-Base(生化试剂);氯化锰、氯化锌、盐酸、氯化钠等均为分析纯;实验用水为二次蒸馏水。
带恒温系统的F-4500型荧光光度计,日本日立公司;PHS-3C型数字式酸度计,上海今迈仪器仪表公司;AYU120型分析天平,日本岛津公司。
1.2 方法
1.2.1 溶液的配制
配制不同温度(T=298K、302K、306K、310K)下pH=7.4的Tris-HCl缓冲溶液;在2cm的比色皿中分别加入2mL 1×10-5mo1·L-1的BSA溶液和不同量的Mn(Ⅱ)溶液,得不同比例(物质的量之比)的Mn(Ⅱ)-BSA系列溶液。同法配制不同比例的Zn(Ⅱ)-BSA 系列溶液、不同比例的 Mn(Ⅱ)-BSA-Zn(Ⅱ)系列溶液。
1.2.2 荧光光谱的测定
(1)Mn(Ⅱ)-BSA体系的荧光光谱测定:选定激发和发射狭缝均为5.0nm,激发波长为295nm,在300~500nm波长范围内扫描并绘制不同浓度Mn(Ⅱ)对BSA的荧光猝灭光谱;固定△λ=15nm或△λ=60nm,在一定波长范围内扫描BSA和 Mn(Ⅱ)-BSA体系,记录Mn(Ⅱ)作用于BSA的同步荧光光谱(测定温度为298K)。
(2)Mn(Ⅱ)-BSA-Zn(Ⅱ)体系的荧光光谱测定:选定激发和发射狭缝均为5.0nm,激发波长为295nm,在300~500nm波长范围内扫描并绘制不同比例Zn(Ⅱ)-BSA和 Mn(Ⅱ)-BSA-Zn(Ⅱ)的荧光猝灭光谱。
2 结果与讨论
2.1 Mn(Ⅱ)对BSA的荧光猝灭特征
BSA是内源性荧光物质,其分子中的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)等芳香性氨基酸残基能够发射荧光。色氨酸、酪氨酸和苯丙氨酸因发色团不同而有着不同的荧光光谱,其最大的荧光发射峰分别位于340nm、305nm和282nm,其中色氨酸的荧光强度最大、苯丙氨酸的最小。故BSA的内源荧光主要来自于色氨酸和酪氨酸。
本实验以295nm作为体系的激发波长,是为了降低酪氨酸和苯丙氨酸的影响,从而使牛血清白蛋白的荧光主要来自色氨酸残基。
固定BSA的量,考察Mn(Ⅱ)对BSA荧光光谱的影响,结果如图1所示。

图1 Mn(Ⅱ)对BSA荧光光谱的影响Fig.1 Quenching of BSA fluorescence spectra by adding Mn(Ⅱ)
由图1可知,随着Mn(Ⅱ)浓度的增大,BSA的最大荧光峰位置不变,但荧光强度却降低。说明Mn(Ⅱ)与BSA的结合较强。
2.2 荧光猝灭机理的确定
荧光猝灭通常分为动态猝灭和静态猝灭两种,动态猝灭是猝灭剂分子和荧光物质的激发态分子之间的相互作用引起的,猝灭常数随温度的升高而增大;静态猝灭是猝灭剂分子与荧光物质分子在基态时生成不发光的配合物引起的,猝灭常数随温度的升高而减小。在动态猝灭过程中,猝灭剂和荧光物质之间的相互作用遵循 Stern-Volmer方程[9]。即:

式中:F0和F分别表示不存在和存在猝灭剂时荧光物质的荧光强度;[Q]为猝灭剂的浓度,mol·L-1;KSV为Stern-Volmer猝灭常数,L·mol-1。
分别测定不同温度(T=298K、302K、306K、310 K)下,Mn(Ⅱ)对BSA的荧光猝灭情况,绘制(F0/F)-1~[Q]曲线,如图2所示。
由图2可知,Mn(Ⅱ)对BSA荧光猝灭的Stern-Volmer曲线具有良好的线性关系。表明Mn(Ⅱ)对BSA的荧光猝灭符合动态猝灭机理。
按式(1)计算出不同温度下的KSV,结果见表1 。
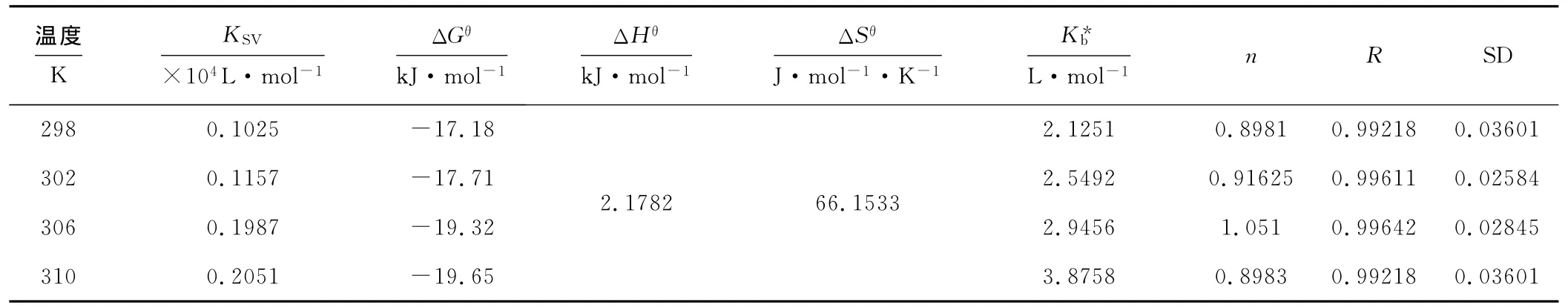
表1 pH=7.4时,不同温度下 Mn(Ⅱ)-BSA体系的KSV、ΔGθ、ΔHθ、ΔSθ、Kb、n,R,SDTab.1 With pH=7.4,the KSV,ΔGθ,ΔHθ,ΔSθ,Kb,n,R,SD for Mn(Ⅱ)-BSA system at different temperatures
由表1 可知,Mn(Ⅱ)对BSA的猝灭常数随着温度的升高而增大,这进一步说明了Mn(Ⅱ)对BSA的荧光猝灭属于动态猝灭。
2.3 作用力类型的确定
有机小分子与蛋白质等生物大分子之间的结合力主要有疏水作用力、氢键、范德华力和静电引力。若ΔH>0、ΔS>0,为疏水作用力;若ΔH<0、ΔS<0,为氢键和范德华力;若ΔH≈0、ΔS>0,为静电引力。
假设在测定温度范围内焓变变化不大,则它的焓变ΔH和熵变△S可以从Vant-Hoff方程求得:

式中K类似于相应温度下Stern-Volmer方程中的猝灭常数KSV。
自由能变△G由下式求得:

以lnK对1/T作图,如图3所示。

图3 Vant-Hoff曲线Fig.3 Vant-Hoff Plot
根据 Vant-Hoff曲线及式(3)计算出 Mn(Ⅱ)与BSA相互作用的有关热力学参数 ΔGθ、ΔHθ、ΔSθ的值,见表1 。
由表1 可知,该反应ΔG<0,表明反应是自发进行的;同时TΔSθ>ΔHθ,表明 Mn(Ⅱ)与BSA的结合主要是熵驱动;ΔH>0、ΔS>0,表明 Mn(Ⅱ)与BSA之间的作用力主要为疏水作用力。
2.4 表观结合常数及结合位点数的计算
当小分子与大分子结合时其表观结合常数与结合位点数由下式求出:

式中:n为结合位点数;Kb为表观结合常数[10]。
绘制不同温度下的lg[(F0/F)-1]~lg[Q]曲线,如图4所示。

图4 lg[(F0/F)-1]~lg[Q]曲线Fig.4 lg[(F0/F)-1]~lg[Q]Plots
依lg[(F0/F)-1]~lg[Q]直线的斜率和截距即可求出Mn(Ⅱ)与BSA的结合位点数n及表观结合常数Kb,结果见表1 。
由表1 可知,在298K、302K、306K、310K时,相关系数R大于0.99,结合位点数约为1,说明 Mn(Ⅱ)与BSA之间有较强的结合作用,可以被蛋白质所储存和运输。
2.5 Mn(Ⅱ)对BSA构象的影响
△λ=15nm和△λ=60nm所得到的同步荧光光谱分别显示蛋白质酪氨酸残基和色氨酸残基的荧光光谱特征。因氨基酸残基的最大发射波长与其所处环境的极性有关,故由发射波长的改变可判断BSA构象变化。
固定BSA浓度,逐渐增大Mn(Ⅱ)的浓度,记录△λ=15nm和△λ=60nm时BSA的同步荧光光谱,结果如图5所示。

图5 △λ=15nm(a)和△λ=60nm(b)时,BSA的同步荧光光谱Fig.5 Synchronous fluorescence spectra of BSA atΔλ=15nm(a)andΔλ=60nm(b)in the presence of Mn(Ⅱ)
由图5可知,BSA的荧光主要由色氨酸残基贡献,Mn(Ⅱ)的加入并未改变BSA的构象。
2.6 Zn(Ⅱ)对BSA的荧光猝灭特征
按照测定Mn(Ⅱ)的方法测定Zn(Ⅱ)与BSA的相互作用。固定BSA体积,逐渐加入一定浓度的Zn(Ⅱ),测其荧光强度。结果表明,Zn(Ⅱ)浓度对BSA的荧光强度影响非常小,可知Zn(Ⅱ)不会对BSA产生荧光猝灭。
2.7 Mn(Ⅱ)-BSA-Zn(Ⅱ)的荧光猝灭特征
考察Mn(Ⅱ)、Zn(Ⅱ)对BSA荧光光谱的影响,结果见图6。

图6 Mn(Ⅱ)和Zn(Ⅱ)对BSA荧光光谱的影响Fig.6 Quenching of BSA fluorescence spectra by adding Mn(Ⅱ)and Zn(Ⅱ)
由图6可知,双金属体系会对BSA荧光光谱产生猝灭效应;随着金属离子浓度的增大,荧光强度降低,但BSA的最大荧光峰位置不变。与Mn(Ⅱ)对BSA的影响比较,双金属离子的影响要小很多,因为Zn(Ⅱ)不会对BSA产生猝灭效应,说明Zn(Ⅱ)的加入会竞争Mn(Ⅱ)与BSA的结合。
2.8 Zn(Ⅱ)和 Mn(Ⅱ)与BSA的结合竞争的讨论
2.8.1 单金属体系与双金属体系的KSV分析
在298K、pH=7.4的条件下分别测定 Mn(Ⅱ)-BSA体系与 Mn(Ⅱ)-BSA-Zn(Ⅱ)体系的荧光猝灭光谱,按式(1)计算出 Mn(Ⅱ)-BSA单金属体系和 Mn(Ⅱ)-BSA-Zn(Ⅱ)双金属体系的 KSV分别为0.1025×104L·mol-1、0.0498×104L·mol-1,双金属体系的KSV小于 Mn(Ⅱ)-BSA单金属体系。说明Zn(Ⅱ)会对Mn(Ⅱ)与BSA的结合产生竞争。
2.8.2 单金属体系与双金属体系的KD分析
由Stern-Volmer方程变形可得:

按式(5)求出 Mn(Ⅱ)-BSA 和Zn(Ⅱ)-BSA-Mn(Ⅱ)的离解常数KD分别为3.5×104、1.68×104。可以看出,两种体系中Mn(Ⅱ)与BSA的结合都较强,但双金属体系中Mn(Ⅱ)与BSA的离解常数更小,说明Zn(Ⅱ)会对Mn(Ⅱ)与BSA的结合产生竞争,可能会使剩下的 Mn(Ⅱ)与BSA结合更稳定,不容易离解。
3 结论
应用荧光光谱法研究 Mn(Ⅱ)和Zn(Ⅱ)与BSA的结合竞争,结果表明:
(1)Mn(Ⅱ)对BSA的荧光猝灭机理是动态猝灭;
(2)Mn(Ⅱ)与BSA以摩尔比1∶1结合,结合过程主要是熵驱动,相互作用力主要为疏水作用力;
(3)Mn(Ⅱ)在与BSA作用的过程中,主要是BSA的色氨酸发生荧光,Mn(Ⅱ)的加入不会改变BSA的构象;
(4)Zn(Ⅱ)不会对BSA产生荧光猝灭效应;
(5)Zn(Ⅱ)会竞争 Mn(Ⅱ)与BSA 的结合,Zn(Ⅱ)与BSA结合稳定性小于Mn(Ⅱ)与BSA的结合稳定性。
[1]Babine R E,Bender S L.Molecular recognition of protein-ligand complexes:Applications to drug design[J].Chem Rev,1997,97(5):1359-1472.
[2]He X M,Carter D C.Atomic structure and chemistry of human serum albumin[J].Nature,1992,358(6383):209-215.
[3]Carter D C,Ho J X.Structure of serum albumin[J].Adv Protein Chem,1994,45(15):153-203.
[4]颜承农,李杨,关中杰,等.荧光光谱法研究丙酮与牛血清白蛋白的相互作用特征[J].环境科学学报,2006,26(11):1180-1185.
[5]王玲,屈凌波,杨冉,等.槲皮素和芦丁与牛血清白蛋白相互作用研究[J].分析科学学报,2006,22(6):719-722.
[6]Hu Y J,Liu Y,Shen X S,et al.Studies on the interaction between 1-hexylcarbamoyl-5-fluorouracil and bovine serum albumin[J].Molecular Structure,2005,738(1-3):143-147.
[7]刘雪锋,夏咏梅,方云,等.中药黄连有效成分盐酸小檗碱与牛血清白蛋白的相互作用[J].高等学校化学学报,2004,25(11):2099-2103.
[8]AndréC,Guillaume Y C.Zinc-human serum albumin association:Testimony of two binding sites[J].Talanta,2004,63(2):503-508.
[10]Il′ichev Y V,Perry J F,Simon J D.Interaction of ochratoxin A with human serum albumin.Preferential binding of the dianion and pH effects[J].Phys Chem B,2002,106(2):452-459.

