蚕豆赤斑病病原菌鉴定
黄 燕, 段灿星, 陆 鸣, 东方阳*, 朱振东*
(1.河北科技师范学院生命科技学院,昌黎 066600;2.中国农业科学院作物科学研究所,国家农作物基因资源与基因改良国家重大科学工程,北京 100081)
蚕豆赤斑病是一种重要的蚕豆叶部病害,广泛发生在世界各蚕豆产区,严重发生时可导致50%~100% 的产量损失[1]。蚕豆赤斑病由蚕豆葡萄孢(Botrytis fabae Sardina)、灰 葡 萄 孢 (B.cinerea Pers.ex Fr.)、拟蚕豆葡萄孢(B.fabiopsis Zhang et al)3种病原菌引起[1-3]。蚕豆葡萄孢被认为是引起赤斑病的主要病原菌,它主要侵染植物的叶、茎、花和豆荚,发病初期叶片上产生红褐色小斑点,后扩大成圆形或椭圆形病斑[4];灰葡萄孢是引起蚕豆赤斑病的另一病原菌,多在花期侵染花部,引起花和幼荚枯死,或因被侵染的花脱落导致叶片感染形成大型病斑,最终使整个叶片变黑、枯死[4];拟蚕豆葡萄孢是新发现的一个病原菌,目前仅在我国湖北报道,其对蚕豆的危害与蚕豆葡萄孢相似[3]。本研究对我国一些主要蚕豆产区蚕豆赤斑病病原菌进行鉴定,以期为蚕豆赤斑病的流行、防治、抗性资源筛选和抗病品种选育提供有价值的信息。
1 材料与方法
1.1 病原菌分离
2010-2011 年在蚕豆生长期分别在甘肃省、青海省、江苏省、四川省、重庆市、河北省等蚕豆主产区采集蚕豆赤斑病植株样品(表1)。用常规组织分离法分离病原菌。参照陆家云[5]描述将鉴定为葡萄孢的分离物(Botrytis spp.)进行单孢分离。蚕豆赤斑病3种病原菌的标准菌株蚕豆葡萄孢菌株BC-25、灰葡萄孢菌株BC-27和拟蚕豆葡萄孢菌株BC-2由华中农业大学李国庆教授提供。
1.2 葡萄孢分离物形态特征
参照张静[6]的方法鉴定葡萄孢分离物。将分离物接种于PDA平板,20℃恒温条件下培养4d后,用灭菌的直径6mm打孔器在菌落边缘打取菌饼,然后将菌饼菌面朝下接种到PDA平板中央,每个分离物设3个重复,于20℃的恒温培养室中培养,观察菌落的形状、颜色及菌核和分生孢子的产生。15d后计算菌核产量和测量菌核直径。
选取蚕豆葡萄孢、灰葡萄孢和拟蚕豆葡萄孢分离物各10株,转移到PDA平板(每皿15mL)进行活化,在20℃条件下培养室中培养3d后转移到另一装有近紫外灯的培养室连续培养7d(12h光照/12h黑暗),再转入4℃冰箱培养10d,观察分离物的产孢情况,显微镜下(Olympus CX31,Japan)测量分生孢子及孢子梗的长度,扫描电镜观察分生孢子形态。
1.3 致病力测定
采用离体叶片的方法进行致病力测定[7]。分离物在PDA培养基20℃条件下培养4d后,用灭菌的直径6mm打孔器在菌落边缘打取菌饼,在超净工作台中将菌饼菌面朝下接种到新鲜健康的蚕豆叶片上(‘成胡17号’,由四川省农业科学院提供)。接种前先用自来水冲洗叶片表面,然后放入铺有湿润滤纸的方形塑料盒子(12cm×12cm×1.5cm)中,每个分离物接种3个叶片,以PDA培养基为对照,20℃条件下放培养箱中光暗交替(12h∥12h)培养,每日观察病斑生长情况,3d后量取病斑直径。
1.4 特异PCR检测
将分离物在铺有灭菌玻璃纸的PDA上培养,3 d后收集菌丝,参照Möller等方法提取DNA[8]。利用检测蚕豆葡萄孢和灰葡萄孢特异性引物对C729+/ C729-(5′-AGCTCGAGAGAGATCTCTGA-3′/5′-CTGCAATGTTCTGCGTGGAA-3′)、灰葡 萄 孢 特 异 引 物 对 BC108+/BC563-(5′-ACCCGCACCTAATTCGTCAAC-3′/5′-GGGTCTTCGATACGG-GAGAA-3′)对分离物基因 DNA 进行 PCR 扩增[9-10]。PCR采用20μL反应体系:10×Buffer缓冲液(含Mg2+)2.0μL,dNTPs(10mmol/L)0.5μL,上下游引物 (10μmol/L)各 0.6μL,Taq 酶 (2U/μL)0.5μL,DNA 模板50ng,灭菌双蒸水14.8μL。PCR扩增反应采用touch down程序:95℃预变性4min(1个循环);94℃变性40s,53℃退火40s,72℃延伸1min(10个循环,每个循环降低0.3℃);94℃变性30s,50℃退火30s,72℃延伸1min(27个循环),72℃预延伸10min(1个循环),扩增后的产物进行1%琼脂糖凝胶电泳,在UV紫外光下观察PCR扩增情况,用凝胶成像分析系统(Tanon 4100,上海)拍照并保存,PCR扩增及电泳检测分别重复两次。
2 结果与分析
2.1 病原菌形态学鉴定
从6个省(市)的20个县区共分离到304个葡萄孢属分离物。通过与蚕豆赤斑病病原菌标准菌株的比较和参考张静[6]的研究结果将这些分离物鉴定为3个葡萄孢种,其中84个分离物为蚕豆葡萄孢、100个为灰葡萄孢、120个为拟蚕豆葡萄孢,分离频率分别为27.6%、32.9%和39.5%(表1)。在江苏省、重庆市、四川省和河北省,以拟蚕豆葡萄孢分离频率为最高,分别为46.0%、57.6%、43.9%和51.4%;甘肃省以灰葡萄孢分离物比例最高,为47.0%;青海省以蚕豆葡萄孢分离频率最高,为41.3%。
在20℃恒温条件下培养,蚕豆葡萄孢在PDA培养基上菌落白色,菌丝绳索状,后期产生褐色至黑色小菌核,菌核圆形至椭圆形,菌核散布整个培养皿,大小为(0.5~6.2)mm×(0.3~4.5)mm,平均产量(500±50)个/皿。分生孢子单胞,倒卵形,透明至灰白色,大小为(10.6~24.3)μm×(8.2~16.5)μm,孢子梗直立,顶端分枝,大小为(836.0~1823.0)μm×(13.0~20.0)μm(图1)。
灰葡萄孢菌丝体白色,比较浓密,菌核黑色,形状不规则,散乱分布于整个培养皿,灰葡萄孢菌核大小为(1.2~11.9)mm×(1.1~5.8)mm,平均每皿(60±20)个菌核。灰葡萄孢在PDA培养基直接可以产生孢子,分生孢子单胞,椭圆形,无色至淡褐色,大小为(6.3~17.2)μm×(4.8~11.4)μm,孢子梗蓬松,单生或丛生,大小为(767.0~1784.0)μm×(5.0~15.0)μm(图1)。
拟蚕豆葡萄孢菌丝绒毛状,菌落白色至灰白色,菌核形状不规则,球形或椭圆形,菌核排列比较规则,呈同心环状或轮纹状,菌核大小为(1.9~12.1)mm×(1.5~5.9)mm,平均产量(140±30)个/皿。分生孢子单胞,透明,表面不光滑,卵圆至椭圆形,大小为(14.8~26.2)μm×(8.9~20.1)μm,孢子梗大小为1 459.0μm×(13.0~18.0)μm(图1)。
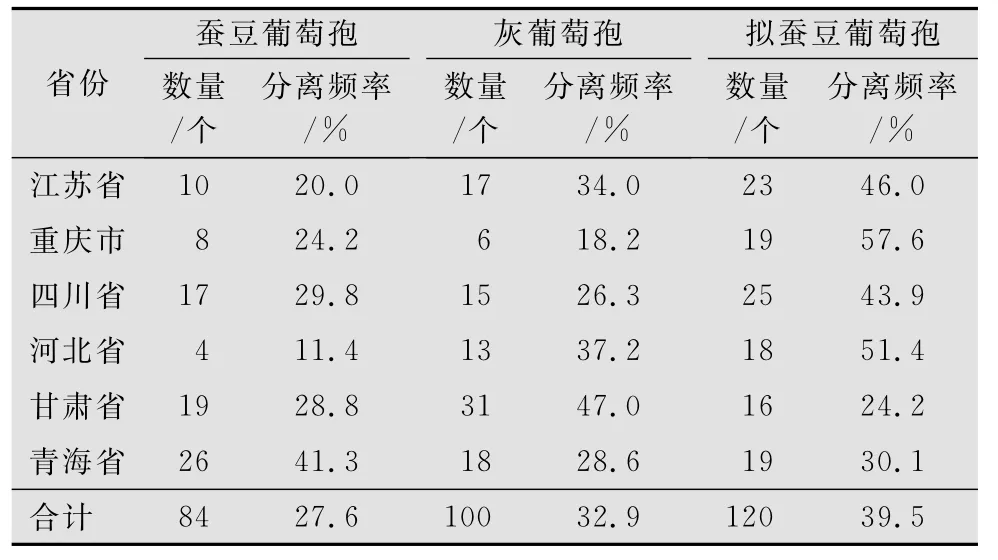
表1 不同省份葡萄孢分离物的种类及分离频率

图1 三种葡萄孢分离物的菌核产生、孢子梗和分生孢子形态
2.2 致病力测定
对304个葡萄孢分离物进行致病性测定,所有分离物对蚕豆品种‘成胡17号’均致病。接种3d后接种叶片产生大小不同的黑色病斑。将病斑直径大于20mm的归为强致病力,小于7mm的为弱致病力,介于两者之间的为中等致病力,在304个分离物中,强致病力分离物有232个,其中蚕豆葡萄孢60个,灰葡萄孢74个,拟蚕豆葡萄孢98个,分别占每种葡萄孢分离物的71.4%、74.0%和81.7%;中等致病力分离物44个,其中蚕豆葡萄孢18个,灰葡萄孢17个,拟蚕豆葡萄孢9个,分别占每种葡萄孢分离物的21.4%、17.0%和7.5%;弱致病力分离物28个,包括蚕豆葡萄孢6个,灰葡萄孢9个,拟蚕豆葡萄孢13个,分别占每种葡萄孢分离物的7.1%、9.0%和2.5%(图2)。
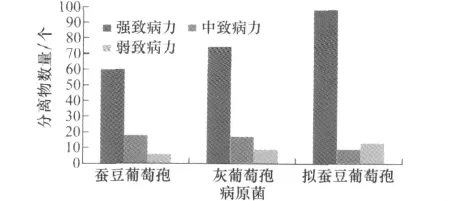
图2 蚕豆赤斑病病原菌分离物致病力测定
2.3 特异PCR检测
利用特异引物BC108+/563-和引物C729+/C729-对分离物基因组DNA进行PCR扩增,引物BC108+/563-在灰葡萄孢分离物中扩增480bp单一条带,在蚕豆葡萄孢和拟蚕豆葡萄孢分离物中不扩增;引物C729+/C729-在灰葡萄孢和蚕豆葡萄孢分离物中扩增600bp单一条带,在拟蚕豆葡萄孢分离物中不扩增(图3)。通过特异PCR检测,在304个分离物中,100个分离物为灰葡萄孢,84个分离物为蚕豆葡萄孢,120个分离物为拟蚕豆葡萄孢,该结果与形态学观察结果一致。

图3 葡萄孢分离物的PCR检测
3 结论与讨论
基于菌落、菌核和分生孢子特征并结合致病性及特异性PCR检测结果将分离自甘肃省、青海省、江苏省、河北省、四川省和重庆市6个省市共20个区县的304个蚕豆赤斑病病原菌分离物鉴定为3个葡萄孢种:蚕豆葡萄孢、灰葡萄孢和拟蚕豆葡萄孢,其中以拟蚕豆葡萄孢分离频率最高,为39.5%。拟蚕豆葡萄孢为最近被鉴定的一个新蚕豆赤斑病病原菌,目前只 在 湖 北 省 有 报 道[3-6]。 张 静[6]研 究 表 明:拟蚕豆葡萄孢在湖北省分布广泛,在调查的56个县市中有35个分离到该病原菌,分离频率为36.4%。本研究结果表明,在江苏省、河北省、四川省和重庆市蚕豆赤斑病病原菌分离物中拟蚕豆葡萄孢分离物的分离频率最高,分别为46%、51%、44%和58%,表明该菌是引起这些地区蚕豆赤斑病的主要病原菌。
在甘肃省,灰葡萄孢分离物的分离频率最高,为47.0%,拟蚕豆葡萄孢和蚕豆葡萄孢分离物的分离频率相近,分别为24.2%和28.8%。这一结果与甘肃省的一些地区发生蚕豆灰霉病有关。2010年7月中旬,作者在甘肃省进行蚕豆病害调查时发现,在康乐县、临夏州的一些蚕豆田发生一种新的蚕豆病害—蚕豆灰霉病,该病症状为蚕豆上部叶片从叶尖和叶缘开始焦枯,坏死组织上产生灰霉层,但无赤斑病症状。甘肃省蚕豆大多种植在冷凉湿润地区,气候条件适合作物灰霉病的发生。
张静[6]的研究表明,拟蚕豆葡萄孢比蚕豆葡萄孢和灰葡萄孢具有更宽的生长温度范围和pH范围,虽然寄主范围相对较窄,但对蚕豆的致病力与蚕豆葡萄孢相近。随着全球气候变暖,拟蚕豆葡萄孢的较大温度范围适应性特性,其对蚕豆的危害程度有可能进一步加剧,应该引起重视。
[1] Harrison J G.The biology of Botrytis spp.on Vicia beans and chocolate spot disease-a review[J].Plant Pathology,1988,37:168-201.
[2] Stoddard F L,Nicholas A H,Rubiales D,et al.Integrated pest management in faba bean[J].Field Crops Research,2010,115:308-318.
[3] Zhang J,Wu M D,Li G Q,et al.Botrytis fabiopsis,a new species causing chocolate spot of broad bean in central China[J].Mycologia,2010,102:1114-1126.
[4] 王晓鸣,朱振东,段灿星,等.蚕豆豌豆病虫害鉴别与控制技术[M].北京:中国农业科学技术出版社,2007.
[5] 陆家云.病原植物真菌学[M].北京:中国农业出版社,2000.
[6] 张静.湖北省灰霉病病菌区系和灰葡萄孢菌多样性研究[D].武汉:华中农业大学,2010.
[7] Castro M,Kramer K,Valdivia L,et al.A double-stranded RNA mycovirus confers hypovirulence-associated traits to Botrytis cinerea[J].FEMS Microbiology Letters,2003,228:87-91.
[8] Möller E M,Bahnweg G,Sandermann H,et al.A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi,fruit bodies and infected plant tissues[J].Nucleic Acids Research,1992,20:6115-6116.
[9] Rigotti S,Viret O,Gindro K.Two new primers highly specific for the detection of Botrytis cinerea Pers.:Fr.[J].Phytopathologia Mediterranea,2006,45:253-260.
[10] Mirzaei S,Mohammadi Goltapeh E,Shams-Bakhsh M,et al.Identification of Botrytis spp.on plants grown in Iran[J].Journal of Phytopathology,2008,56:21-28.

