番茄抗枯萎病I-2基因的SNP分型
徐薪惟, 李景富, 姜景彬, 张 贺,康立功, 陈秀玲, 王傲雪, 许向阳
(东北农业大学,哈尔滨 150030)
番茄是世界各地广泛栽培的重要经济作物,随着其大棚种植面积的迅速扩大,靠土壤传染的菌量逐年累积,番茄枯萎病的发生日趋严重。程爱昀[1]对山东济宁地区大棚番茄枯萎病进行了调查,发现番茄枯萎病的一般发病率为20%~30%,严重地块达80%~90%,甚至全部毁种。而培育优良抗病品种是解决番茄病害问题的有效途径。早在1940年Wellman[2]就发现番茄枯萎病菌有生理小种的分化,并存在3个生理小种[3-5],且相应在野生番茄中找到了3个抗病基因即I-1、I-2、I-3。它们都是由显性单基因或半显性单基因控制的[6]。I-1基因对生理小种1具有抗性,但对其研究不够深入。Paddock[7]通过研究将I-1基因定位到第11条染色体上,Sarfatti[8]则将其定位于第7条染色体上。李发玲等[9]对 I-1 基 因 进 行 分 析,发 现 AFLP 标 记E41M60-D标记与该基因紧密连锁。Sarfatti等[10]获得了番茄I-2基因的RFLP标记TG105,该标记与I-2基因紧密连锁(0.4cM)。I-2 基因来源于醋栗番茄的显性基因,被定位到第11条染色体长臂的7个相似的基因簇内[11]。于拴仓等[12]根据I-2 的基因序列设计特异扩增引物,建立了I-2基因的共显性分子标记,Fukuta等[13]根据I-2 基因序列设计特异扩增引物,开发出了可以区分含有I-2基因和不含I-2基因的材料。I-3基因被定位到第7条染色体的长臂上[14],Lim等[15]利用31对基于PCR技术的标记绘制了I-3基因在第7条染色体的高分辨率图,将I-3基因定位于分子标记RGA332和bP23/gPT之间的0.38cM的间隔内。由于I-2基因同时抗番茄枯萎病生理小种1和2,因此受到重视。
目前,分子标记辅助选择已成为蔬菜分子育种的关键技术。SNP标记作为第3代DNA遗传标记,可以把复杂的性状作为单基因性状进行分析和选择,一旦找到紧密连锁的分子标记,就可以在育种工作中进行标记辅助选择。Kota等[16]对大麦7个基因型的180个EST位点进行SNP研究,检测到了72个SNP,这些SNP标记被用来研究大麦的亲缘关系。周永明等[17]用引物扩增低芥酸甘蓝型油菜和高芥酸甘蓝型油菜基因组DNA,将所得DNA片段进行序列比对,发现单核苷酸多态性并设计特异引物,经群体检验获得了与甘蓝型油菜低芥酸基因连锁的共显性SNP分子标记。SNP分型是SNP研究领域的重要课题,根据不同的研究需要已建立了不同的分型方法,其中等位基因特异PCR法(AS-PCR)通过对特异引物的巧妙设计,能够将不同的SNP基因型分辨开来,具有费用低,程序简单,易于操作等优点[18]。本研究试图建立适合于番茄I-2基因SNP分型的AS-PCR反应体系,为番茄抗枯萎病I-2基因的分子标记连锁作图打下基础。
1 材料与方法
1.1 材料
番茄抗枯萎病品种‘07878’、‘07898’、‘07916’,感病品种‘07875’、‘07920’、‘07932’。上述材料均由东北农业大学园艺学院番茄课题组提供。番茄枯萎病菌属生理小种2,由东北农业大学园艺系番茄课题组提供。
1.2 方法
1.2.1 引物设计
根据GenBank上提供的I-2 基因序列(AF118127.1),利用Primer 5.0软件设计特异扩增的PCR引物,共设计4对引物,筛选扩增性较好的引物对 S2:TACGCTCCAAATCAGAGGA,A2:TTCCGTCACCACTCTTATTCCA,由北京六合华大基因科技股份有限公司合成。该引物扩增番茄I-2基因1 142~2 466bp间的片段。
1.2.2 番茄基因组提取及PCR扩增
将所有番茄试验材料播种于温室内,待长出两片真叶时取幼嫩的叶片用CTAB法提取DNA。用0.8%的琼脂糖凝胶电泳检测,λDNA作为Marker,以检查DNA浓度;紫外分光光度计测定样品的纯度。
PCR扩增:PCR反应体积为25μL,其中包括dNTP(2.0mmol/L)2.0μL,10×PCR buffer 2.0μL,MgCl2(25mmol/L)1.3μL,上下游引物 (10μmol/L)各1.0μL,模板0.5μL,Pfu酶0.5μL,用ddH2O补足25μL。用德国Biometra T-Gradient Themoblock型PCR仪扩增,热循环程序为:94℃预变性5.0min、94℃变性30s、58℃复性30s、72℃延伸70s共30个循环,72℃延伸7.0min。PCR扩增产物用0.8%琼脂糖电泳检测。
1.2.3 差异条带的克隆、测序和比对分析
扩增产物经电泳检测后回收。回收的目的片段与TaKaRa公司的pMD18-T Vector在T4连接酶的作用下16℃连接过夜并转化E.coli DH5α。经蓝白斑筛选后挑取单菌落,在液体LB培养基摇菌培养过夜,碱裂解法制备质粒,经HindⅢ和PstⅠ酶切电泳鉴定为阳性克隆后送北京华大测序。用DNAMAN,DNAStar软件系统的Editseq、Seqman、MegAlign软件包分析已测序列,在I-2基因的1793、1963位获得基因组特异的差异。
1.2.4 等位基因特异引物的设计
为了在不同材料中检测目标SNP,采用等位基因特异 PCR 方法(allele-specific PCR,AS-PCR),将SNP置于引物3′端并在特异引物的3′端引入1~2个错配碱基,以增加等位基因特异性PCR的扩增效果,再利用Primer 5.0在序列的5′端设计公用的正义链引物。同时,还设计了与等位基因特异PCR引物的互补引物(表1),来验证等位基因特异PCR引物的可靠性。优化PCR扩增条件,用0.8%琼脂糖凝胶电泳检测该引物在不同番茄品种中的多态性。
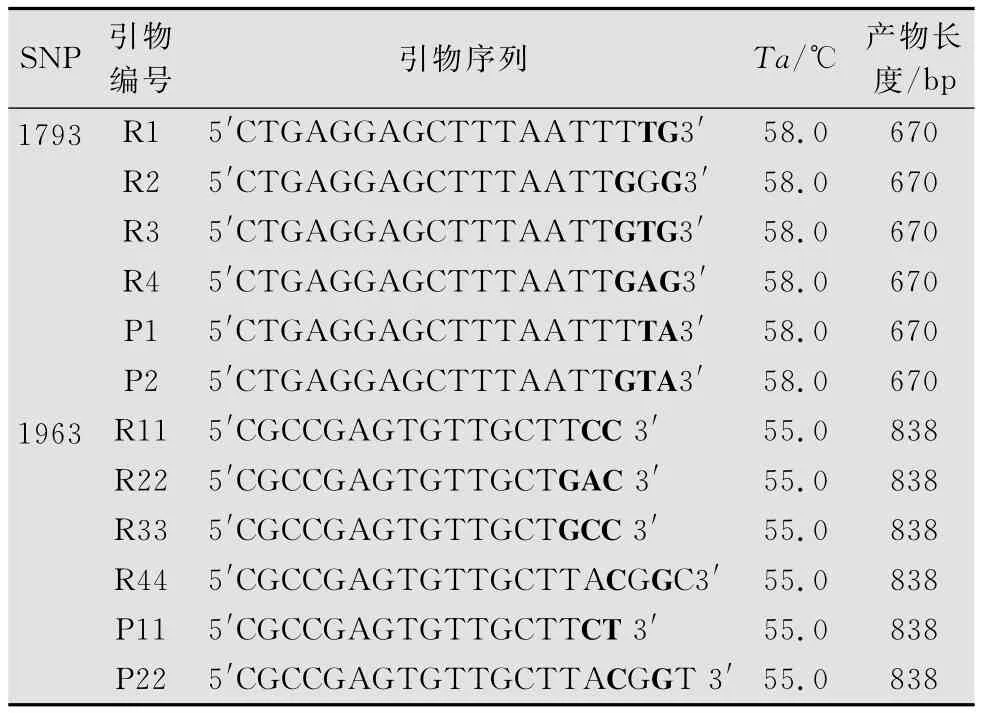
表1 基于1793和1963位特异性引物的设计1)
1.2.5 抗番茄枯萎病种质资源的筛选
在培养基上大量繁殖番茄枯萎病菌,采用浸根法接种52份种质资源,15d后调查,记录发病情况[19]。将群体分为抗病和感病两类,并与AS-PCR检测结果进行比较。
2 结果与分析
2.1 番茄抗枯萎病I-2基因的克隆
以S2和A2为引物,利用不同抗性番茄品种的基因组DNA为模板得到了稳定的特异扩增产物。扩增产物经0.8%的琼脂糖凝胶电泳分离鉴定(图1),大小约为1.3kb,与I-2 预期扩增一致,经3次重复,结果稳定一致。将I-2基因构建pMD18-T克隆载体并酶切鉴定插入片段的大小(图2)。从图1、2中可以看出,所要扩增的I-2基因片段与限制性酶切后的片段大小相符,表明所扩增的目的片段已连接到载体上。将菌液送到北京华大公司进行测序。

图1 S2、A2引物对不同番茄品种基因组DNA PCR扩增结果
2.2 I-2基因的单核苷酸多态性分析
通过对不同番茄品种的测序结果多重序列比对,序列相似性达96.64%。序列中有49个单核苷酸突变位点,两个插入/缺失位点。根据序列中1793位C/T及1963位G/A设计SNP特异引物。

图2 重组质粒pMD18-T/I-2基因的酶切鉴定
2.3 引物3′端不同位置碱基错配及不同碱基错配类型对PCR结果的影响
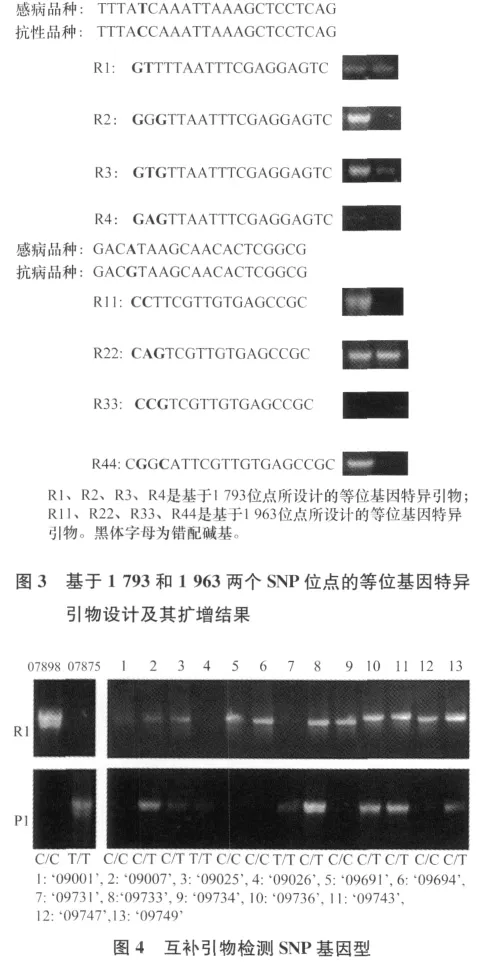
为了研究等位基因特异引物3′端不同位置碱基错配对AS-PCR的影响,在试验中分别在引物3′端第1、2、3位引入不同位置的碱基错配以及错配碱基的数目,研究其对PCR产物的影响。在SNP位点1 793位和1 963位处,引物R1和R11分别在供试材料中得到了有明显差异的扩增产物,而在引物3′端的第1、3位置设计错配碱基的引物R2和R22在供试材料中均能扩增出条带,说明引物3′端第1、2位碱基错配对抑制等位基因特异引物与模板的结合起重要作用。
为了研究不同碱基错配类型对AS-PCR的影响,在1793位设计引物R3和R4,引物R3为C/T错配,引物R4为C/A错配。从图3可以看出,R4产物较弱,因此,C/T错配强于C/A错配。在1 963位的检测中,引物R33的TA变成CG形成AT-CG型错配。由于T-G属于弱错配而A-C也为弱错配,并未扩增出条带,说明弱的错配碱基可能会削弱引物与模板的结合能力。结果与卫波等[20]通过对小麦抗旱相关基因SNP标记的研究认为在引物3′端第2位和第3位同时置入错配碱基,就可以有效抑制引物与模板的结合相似。在此基础上,设计引物R44引入A-G强错配并置于3′端第2位与SNP相隔一个碱基,获得了特异性条带。因此可以有效地阻止非特异性的扩增。
2.4 互补引物检测SNP基因型
针对I-2基因在1793位的SNP位点,用优化的AS-PCR体系对52份种质资源进行分型。利用特异性较好的引物R1设计互补引物P1,相互验证两对引物的正确性,也可以检测两种材料在SNP位点基因型是纯合基因型还是杂合基因型。凡是用引物R1获得特异性差异的基因型在该位点是纯合基因型C/C。凡是用引物P1获得特异性差异的基因型在该位点是纯合基因型T/T。同时在引物R1和P1中获得目的片段的为C/T杂合SNP基因型。结果如图4所示,株系1、5、6、9、12为纯合抗病基因型C/C,株系4、7为纯合感病基因型T/T,株系2、3、8、10、11、13为杂合抗病基因型C/T。
2.5 抗番茄种质资源的筛选
通过对52份种质资源进行苗期抗枯萎病生理小种2田间鉴定,调查出抗病品种40份,感病品种12份。实验室利用SNP标记引物获得抗病品种42份,感病品种10份。通过对番茄材料的分子和人工鉴定比较,吻合率较高,可用于苗期抗枯萎病的检测。
3 讨论
番茄枯萎病是土传性病害,本试验采用浸根法对番茄52份种质资源进行苗期抗枯萎病生理小种2田间鉴定,其中抗病品种40份,感病品种12份,实验室利用SNP标记引物获得抗病品种42份。由于植物病害症状的稳定性是相对的,有一个发生发展的过程,并存在一定的变异性,所以人工接种鉴定的方法存在一定的不准确性,导致检测的结果稍有不同,但吻合率较高,证明该标记可在苗期对番茄枯萎病的抗病资源进行筛选,且能够免去大量的田间测试工作,显著提高选择效率,有效避免人工接种产生的误差。通过SNP标记发掘优异的抗枯萎病番茄基因资源,对培育高产抗病番茄品种,促进番茄生产的发展具有重要理论意义和实际应用价值。
在等位基因特异引物设计方面,起初利用只在3′端第一位引入错配碱基来区分抗感品种,结果没有获得特异条带。因为在普通的PCR扩增中,引物与模板匹配的碱基只有一个差异容易造成错配,从而引起假阳性。在5′端第一位引入错配碱基也未能获得有明显差异的特异条带,因为番茄基因组对引物序列的选择性,这种对序列的“偏好”以引物3′端序列更显得关键一些[21]。
碱基错配根据不稳定性分为3类:强错配型(C/T和G/A)、中等错配型(C/A和 G/T)和弱错配型(A/A、C/C/、G/G和 T/T),在特异引物3′端错配碱基强弱搭配,或者中中搭配,获得理想扩增效果的可能性较大[22]。试验中选用C/T和C/A错配,C/T错配获得了较好的差异条带,这与预期结果一致;3′端第2和第3位设计AT-CG型错配由于T-G属于弱错配而A-C也为弱错配,并未扩增出条带,说明弱的错配碱基会削弱引物与模板的结合能力;引入A-G强错配并置于3′端第2位与SNP相隔一个碱基,获得了特异性条带,可以有效地阻止非特异性的扩增。为了研究不同位置碱基错配对特异扩增的影响,分别在第2和第3位引入强错配碱基,结果表明,第2位的错配效果强于第3位。卫波[20]等人研究也表明在不同位置加入错配碱基会产生不同的扩增效果。
SNP分型试验为SNP分子标记的开发利用提供技术保障,本研究通过对番茄抗枯萎病I-2基因的克隆与序列测定,利用等位基因特异PCR针对1 793位突变位点设计的特异引物及互补引物对番茄种质资源进行了有效的分型,验证了该标记在抗、感番茄品种间的多态性。分型设计简单、可靠,为番茄抗枯萎病的分子标记辅助育种奠定了基础。
[1] 程爱昀.大棚番茄枯萎病的诊断和防治新技术[J].中国瓜菜,2010,23(1):45-46.
[2] Wellman F L,Blaisdell D J.Differences in growth characters and pathogenicity of Fusariumwilt isolations tested on three tomato varieties[J].Technical Bulletin United States Department of Agriculture,1940,705:28.
[3] Gabe H L.Standardization of nomenclature for pathogenic races of Fusarium oxysporumf.sp.lycopersici[J].Transactions of the British Mycolological Society,1975,64:156-159.
[4] Conway W S,Mac Hardy W E.Distribution and growth of Fusarium oxysporumf.sp.lycopersici race l or race 2within tomato plants resistant or susceptible to wilt[J].Phytopathology,1978,8:938-942.
[5] Grattidge R,O′Brien R G.Occurrence of a third race of Fusarium wilt of tomatoes in Queensland[J].Plant Disease,1982,66:165-166.
[6] Beckman C H,Elgersma D M,Machardy W E.The localization of fusarial infection in the vascular tissue of single-dominant-gene resistant to tomatoes[J].Phytopathology,1972,62:1256-1260.
[7] Paddock E F.A tentative assignment of Fusarium-immunity locus linkage group 5in tomato[J].Genetics,1950,35:683-684.
[8] Sarfatti M,Abu-Abied M,Katan J,et al.RFLP mapping of I-1,a new locus in tomato conferring resistance against Fusari-um oxysporumf.sp.lycopersici race 1[J].TAG Theoretical Applied Genetics,1991,82,1:22-26.
[9] 李发玲,李景富,康立功,等.与番茄枯萎病抗病基因I-1连锁的 AFLP和SSR分子标记[J].植物保护,2011,37(1):37-40.
[10] Sarfatti M,Katan J,Fluhr R,et al.An RFLP marker in tomato linked to the Fusarium oxysporumresistance gene I-2[J].TAG Theoretical and Applied Genetics,1989,78:755-759.
[11] Simons G,Groenendik J,Wijbrandi J,et al.Dissection of the Fusarium I-2 gene cluster in tomato reveals six homologs and one active gene copy[J].Plant Cell,1998,10:1055-1068.
[12] 于拴仓,邹艳敏.番茄枯萎病抗性基因I-2的显性分子标记及其应用[J].分子植物育种,2007,5(6):806-810.
[13] Fukuta S,Kuroyanagi S,Oyabu T,et al.Development of DNA marker linked to I-2 gene for resistance to Fusarium oxyspourmf.sp.lycopersici race 2[J].Research Bulletin of the Aichi-Ken Agricultural Research Center,2009,40:41-46.
[14] Bournival B L,Scott J W,Vallejos C E.An isozyme marker for resistance to race 3of Fusarium oxysporumf.sp.lycopersici in tomato[J].TAG Theoretical and Applied Genetics,1989,78,4:489-494.
[15] Lim G T T,Wang G T,Hemming M N.High resolution genetic and physical mapping of the I-3 region of tomato chromosome 7reveals almost continuous microsynteny with grape chromosome 12but interspersed microsynteny with duplications on Arabidopsis chromosomes 1,2and 3[J].TAG Theoretical and Applied Genetics,2008,118;57-75.
[16] Kota R,Varshney R K,Thiel T,et al.Generation and comparison of EST-derived SSRs and SNPs in barley[J].Hereditas,2001,135;145-151.
[17] 周永明,淮东欣,杨庆勇.甘蓝型油菜低芥酸分子标记及其制备方法与应用:中国,CN101955930A[P].2011-01-26.
[18] 陈吉宝,景蕊莲,员海燕,等.等位基因特异PCR技术的研究与应用[J].植物遗传资源学报,2005,6(4):469-473.
[19] 雷娜,李景富,康立功,等.番茄黄萎病抗病基因Ve的AFLP和SSR分子标记[J].植物病理学报,2011,41(1):80-84.
[20] 卫波,景蕊莲,王成社,等.用等位基因特异PCR检测普通小麦的单核苷 酸 多 态 性 [J].中 国 农 业 科 学,2006,39(7):1313-1320.
[21] Ye S,Dhillon S,Ke X Y,et al.An efficient procedure for genotyping single nucleotide polymorphisms[J].Nucleic Acids Research,2001,29,17:e88.
[22] 李亚玲,李景富,康立功,等.番茄Mi-1基因的SNP分型[J].东北农业大学学报,2010,41(10):36-42.

