香石竹斑驳病毒云南分离物全基因组序列测定和侵染性克隆构建
王连春, 彭杰军, 郭维霞, 李晓鹏, 孔宝华, 陈海如
(云南农业大学植物保护学院,云南农业大学农业生物多样性与病虫害控制教育部重点实验室,昆明 650201)
香石竹(Dianthus caryophyllus Linn.)又名康乃馨(carnation),是一种深受人们喜爱的鲜切花。香石竹能受多种病毒侵染危害,其中影响最大的是香石竹斑驳病毒(Carnation mottle virus,CarMV),属于番茄丛矮病毒科(Tombusviridae)麝香石竹斑驳病毒属(Carmovirus)。CarMV是麝香石竹斑驳病毒属的典型成员,其全长约4003nt(GenBank:AF192772),可能有5个阅读框架(图1),分别为p28ku、p28ku通读产生的p88ku、p7ku、p9ku、p38ku;其中p88可能具有RNA依赖的RNA聚合酶功能,p7和p9可能都具有运动蛋白功能,而p38则执行外壳蛋白功能[1-2]。但是否存在 CarMVgp1两个TAG终止子通读框架还有待进一步证明。目前深入研究较多的是p7和p38两个蛋白,研究表明p7可能具有运动蛋白的功能,其C末端具有RNA结合结构域[3],蛋白定位表明在病毒侵染扩散时p7会在细胞壁附近富集[4],这也与运动蛋白可以辅助病毒通过胞间连丝运动的结果相符;而p38作为外壳蛋白是保护病毒的屏障[5],也是直接与外界接触的部分,因此p38蛋白也经常作为CarMV病毒检测的抗原[6-8]。由于外壳蛋白执行保护作用,为了适应不同环境其变异也会比较大,科研工作者通常将外壳蛋白作为病毒进化分类的重要依据,CarMV也不例外,Canizares等[9]根据CP氨基酸序列164和331两个位置氨基酸变化的相关性,把CarMV分为P164K331和A164N331两个主要组群。

图1 CarMV阅读框架分析
CarMV是一种重要的花卉病毒,对于它各个蛋白的功能及其相互关系的研究是防治CarMV的前提,但目前研究主要集中在病毒检测、遗传进化、运动蛋白和外壳蛋白的研究,对于其他阅读框架如p88、p28、p9等的功能研究较少,而且p88、p9、p7、p38四个蛋白的核苷酸序列都有不同程度的重叠,这种表达方式对于CarMV是否具有一定的生物学意义仅通过单独阅读框架的表达很难进行研究;再者CarMV的原始寄主是香石竹,其遗传背景不清楚无法直接进行病毒与寄主间互作研究,因此构建CarMV的全长侵染克隆是解决以上问题的快捷方法。本研究旨在构建一个农杆菌介导的能侵染烟草等模式植物的CarMV cDNA全长侵染性克隆,从而满足进一步研究CarMV病毒的需要。
1 材料与方法
1.1 材料
1.1.1 感病样品
13个具有典型病害症状(如植株矮化,畸形,生长衰弱,花朵变小或杂色,花苞开裂等)的香石竹样品来源于昆明市斗南花卉市场。
1.1.2 质粒与菌株
真核表达载体pCV-nGFP、大肠杆菌[Escherichia coli(Migula)Castellani et Chalmers]DH5α、农 杆 菌 [Agrobacerium tumefaciens (Smith Townsend)Conn]C58C1由浙江省农业科学院病毒学与生物技术研究所陈剑平院士惠赠。
1.1.3 酶及试剂
RNeasy Plant mini Kit、QIAquick Gel Purification Kit购自 QIAGEN公司;T4DNA Ligase、pGEM-T vector购自Promega公司;EX TaqTM、各种限制性内切酶、Ribonuclease H(RNase H)、Ribonuclease Inhibitor、AMV Reverse Transcriptase、DNA Ligation Kit ver.2、pMD19-T购自TaKaRa。
1.1.4 引物
根据登录号为NC_001265.1的上海分离物设计引物(表1),引物合成由上海生工生物工程有限公司完成。

表1 CarMV全长序列构建引物
利用BamHI(GGATCC)、KpnI(GGTACC)和SacI(GAGCTC)将病毒片段分为两段连入pCV-nGFP为载体。
1.2 方法
1.2.1 CarMV RT-PCR检测及全基因组序列克隆
参照Invitrogen公司的Trizol法提取植物总RNA,以提取的总RNA为模板,反转录后利用Car-MV-3和CarMV-4PCR扩增CarMV全长,回收目的片段连接到pMD19-T载体,蓝白斑筛选出阳性克隆,送生工测序。
1.2.2 农杆菌浸润
将构建好的侵染性克隆载体pCV-CarMV通过电击法导入农杆菌C58C1,再挑取单菌落接种于5mL LB液体培养基中,220r/min 28℃振荡培养24h。取500μL菌液转接于5mL LB液体培养基中,28℃220r/min振荡培养至A600=0.6。5 000r/min离心10min收集菌体用转染缓冲液(10mmol/L MES、10mmol/L MgCl2和150μmol/L乙酰丁香酮)悬浮,A600调至1.0,室温放置12h后通过5mL针筒浸润到6叶期本氏烟。pCV-CarMV农杆菌侵染时每次接种10株6叶期本氏烟,重复3次,同时以浸润空载体农杆菌为阴性对照。
1.2.3 CarMV侵染植物 RT-PCR检测
对浸润CarMV和对照烟草植株提取系统叶片总RNA,以OligdT为引物反转录CarMV的cDNA第1链,以CarMV-C-2f和CarMV-C-2r为引物进行RT-PCR扩增,PCR产物经1%琼脂糖电泳检测。
2 结果与分析
2.1 CarMV RT-PCR检测及全基因组序列测定
为确定所取病样是否含有CarMV,本试验将斗南花市获得的样品提取植物总RNA反转录,利用特异引物CarMV-1和CarMV-2进行RT-PCR扩增,结果显示所取样品中有13个样品能扩增出1 700bp左右的条带,由此表明此13个样品均含有CarMV(图2)。
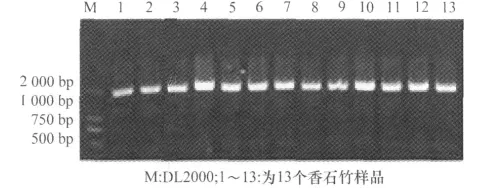
图2 斗南花市13个香石竹样品CarMV PCR检测
为获得CarMV云南分离物的全长序列,本试验以其中一个样品为模板,利用引物CarMV-3和CarMV-4进行PCR扩增,获得病毒全长序列连入pMD19-T,构建的重组质粒为T-CarMV送至生工测序。测序结果表明,CarMV云南分离物RNA全长共4 003bp(登录号 HQ660513.1)。软件DNAMAN分析云南分离物与上海分离物(登录号为NC_001265.1)的差异,结果表明,两者相似性达94.78%。对两者的氨基酸分析表明,p88(805~807位置的TAG通读)氨基酸序列相似性100%;而p9有两个氨基酸差异,分别为第11位E→G,第14位M→L;p7序列第3位A→V,第7位P→L,第23位R→K;p38变化较大有6处差异,分别为第67位S→P,第92位C→S,第284位I→F,第329位M→I,第341位K→Q,第342位V→W。序列比较结果显示,上海分离物与云南分离物之间没有显著差异。而根据Canizares等提供的分类标准显示,云南分离物和上海分离物第164位为P,第331位为K,它们同属于P164K331组群。
2.2 侵染性克隆构建
本试验以T-CarMV为模板将CarMV全长序列构建至真核表达载体以便于农杆菌瞬时转染植物。CarMV-YN全基因序列分析表明,该基因组序列无BamHI和SacI酶切位点、在2 958bp位置具有KpnI酶切位点,因此本试验利用这3个酶切位点将CarMV分为两段连入表达载体。
经序列分析发现,CarMV云南分离物先将引物CarMV-C-1f和CarMV-C-1r扩增获得的约3.0kb序列通过BamHI和KpnI酶切后连入pCV-nGFP载体构建成pCV-BK,经PCR扩增检测正确后(图3),继续将CarMV-C-2f和CarMV-C-2r扩增获得的约1.0kb片段通过KpnI和SacI连入pCV-BK形成最终重组载体pCV-CarMV,利用PCR检测片段2的连接情况(图4),为进一步确认构建载体的正确性,以CarMVC-1f和CarMV-C-2r为配对引物进行全长PCR扩增,结果显示在4.0kb位置有扩增条带(图5),测序结果也表明CarMV全长已经构建至双元表达载体,可以用于侵染性分析。


图5 CarMV云南分离物侵染性克隆全长PCR检测
2.3 侵染性分析
为验证构建的CarMV-YN全长侵染性克隆是否具有侵染性,本研究将pCV-CarMV转入农杆菌C58C1,浸润6叶期本氏烟,同时以pCV-nGFP浸润6叶期本氏烟为阴性对照。转染7d后浸润空载体和pCV-CarMV农杆菌的本氏烟上均未出现明显症状。CarMV-C-2f、CarMV-C-2r引物进行RT-PCR扩增能检测到一条1.0~1.1kb特异性条带(图6A),而对照没有相应条带。14d后观察发现,浸润有pCV-CarMV农杆菌的植株明显比对照植株矮小,并有轻微花叶(图6B)。上述试验结果表明,本试验构建的CarMV全长克隆具有侵染性。

图6 烟草系统叶片RT-PCR检测及接毒后烟草生长情况
3 讨论
本研究以香石竹CarMV云南分离物为研究材料,结果表明CarMV云南分离物全长4 003nt,与上海分离物同属于P164K331组群,而核苷酸、氨基酸序列表明云南分离物和上海分离物没有明显差异,这也与Canizares等[9]研究结果相符,CarMV没有明显的地域和时间差异。同时本试验以具有35S启动子的pCV-nGFP双元表达载体为基础,在35S启动子和NOS终止子之间插入CarMV的全长片段,利用农杆菌直接侵染烟草,结果表明,本研究构建的CarMV侵染性克隆具有侵染性。
植物病毒研究一直以来最难解决的是病毒的保存问题,植物病毒需要保存在寄主植物上才能保持侵染活性,而本试验构建的pCV-CarMV侵染性克隆以质粒的形式离体保存,从而减少保存过程中的繁琐工作;再者植物病毒复制速度快,通过不断的转接也可能导致病毒进化从而无法保证病毒序列的保守性,进而导致研究结果差异大,而农杆菌介导的侵染性克隆由于质粒可以自我复制从而能保证病毒序列的保守性;寄主专化性一直是植物病毒研究的瓶颈,由于寄主遗传背景不清楚,无法了解植物病毒侵染时植物发生变化的基因,但是本研究的侵染性克隆是以农杆菌介导,通过农杆菌直接将双元表达载体注入寄主细胞中再通过35S强启动子启动Car-MV cDNA序列转录产生病毒RNA序列,从而达到侵染的目的,因此也可以在已知遗传背景的植物如烟草、拟南芥等模式生物中表达。
本研究全序列测定表明,CarMV可能具有5个阅读框架,其中有p88是通过TAG通读形成,但是CarMV病毒中是否会发生两个TAG终止子的通读翻译出CarMVgp1蛋白(图1),CarMVgp1蛋白具有何种功能目前尚未研究;CarMV中p88、p9、p7、p38四个蛋白其阅读框架部分序列发生相互重叠,而这些重叠部分是否具有生物学功能也尚未可知,因此这些研究都可以通过对本试验构建的全长侵染性克隆的基因突变或缺失来完成。综上所述,本研究构建的CarMV侵染性克隆在烟草上具有侵染性,在CarMV基因功能、寄主互作等研究中具有一定的应用价值。
[1] Carrington J C,Morris T J.Complementary DNA cloning and analysis of Carnation mottle virus RNA[J].Virology,1984,139(1):22-31.
[2] Garcia-Castillo S,Sánchez-Pina M A,Pallás V.Spatio-temporal analysis of the RNAs,coat and movement(p7)proteins of Carnation mottle virus in Chenopodium quinoa plants[J].Journal of General Virology,2003,84:745-749.
[3] Harbison S A,Wilson T M,Davies J W.An encapsidated,subgenomic messenger RNA encodes the coat protein of carnation mottle virus[J].Bioscience Reports,1984,4(11):949-956.
[4] Kummert J.Synthesis and characterization of DNA complementary to carnation mottle virus RNA[J].Virology,1980,105(1):35-40.
[5] Safari M,Koohi Habibi M,Mosahebi G,et al.Carnation mottle virus,an important viral agent infecting carnation cut-flower crops in Mahallat of Iran[J].Communications in Agricultural and Applied Biological Sciences,2009,74(3):861-865.
[6] Vilar M,Esteve V,Pallas V,et al.Structural properties of Carnation mottle virus p7movement protein and its RNA-bind-ing domain[J].The Journal Biological Chemistry,2001,276(21):18122-18129.
[7] 孔宝华,李文君,常胜军,等.香石竹斑驳病毒(CarMV)云南分离物CP基因的克隆和序列分析[J].Acta Phytopathologica Sinica,2003,33(2):187-188.
[8] 李婷婷,方琦,丁铭,等.昆明麝香石竹斑驳病毒分离物的鉴定与提纯及高效价抗血清的制备[J].西南农业学报,2008,21(2):346-348.
[9] Canizares M C,Marcos J F,Pallas V.Molecular variability of twenty-one geographically distinct isolates of Carnation mottle virus(CarMV)and phylogenetic relationships within the Tombusviridae Family[J].Archives of Virology,2001,146(10):2039-2051.

