大豆疫霉拮抗菌B048固体发酵培养基的筛选和发酵条件的优化
王子迎, 周 涛
(合肥师范学院 生命科学系,安徽 合肥230601)
1 引言
大豆疫霉(Phytophthora sojae)侵染大豆引起的疫霉根腐病是大豆生产上的毁灭性病害[1],最早于1948年发生在美国,此后不断蔓延,现已广泛分布亚、非、欧、南北美洲的近二十个国家的大豆主要产区,每年给大豆生产带来的直接经济损失高达几十亿美元,成为大豆生产上最严重的病害[2,3]。该病菌于80年代后期首次在我国的东北地区发现,随后该病在我国北方的大豆主产区逐步扩展,目前已经成为黑龙江省大豆生产上的头号病害,每年造成巨大的经济损失[4]。90年代后期,在我国的局部大豆产区,也发现了大豆疫霉的传入,在条件适宜的年份,其造成的大豆产量损失高达50%以上[5-8]。
目前,大豆疫霉根腐病的防治方法主要是化学防治,其中使用最多的药剂是甲霜灵(Metalaxy,商品名Ridomil)。甲霜灵为内吸性杀菌剂,生物活性强,且效期持久[9]。但由于甲霜灵对病菌的作用位点单一,病原菌容易对其产生抗性突变,因此,开发新的替代防治方法在控制大豆疫霉根腐病上尤显重要[10]。在大豆疫霉根腐病的防治中,未见从土壤中筛选拮抗菌作为病害生防因子的报道。为可持续地控制大豆疫病,避免大豆疫病因单一的化学防治而过快地产生抗药性,生物防治已成为大豆疫病防治的重要研究领域。
为此本实验室从大豆疫霉生存的土壤中筛选具有高拮抗活性和易定殖的生物防治菌株,分离到一株拮抗效果好的细菌,命名为B048。为实现该生防菌株的产业化,本文对该菌株的固体发酵培养基的筛选和发酵条件进行了优化研究,以期为该菌株的工业生产并获得高产抗菌物质提供参考依据。
2 材料和方法
2.1 材料
2.1.1 菌种
大豆疫霉生防菌B048菌是由本实验室在试验过程中分离并保存的一株对大豆疫霉有很好拮抗作用的菌株。
2.1.2 培养基
斜面种子培养基:肉汤固体培养基(蛋白胨10.0g/L、氯化钠5.0g/L、葡萄糖5.0g/L、牛肉浸出粉3.0g/L,琼脂粉:20.0g/L)。摇床种子培养基:肉汤液体培养基(蛋白胨10.0g/L、氯化钠5.0 g/L、葡萄糖5.0g/L、牛肉浸出粉3.0g/L)。基础发酵培养基:麸皮固体100%,料水比1:0.75,250 mL锥形瓶中装料20g,自然pH。平板菌落计数培养基:肉汤固体培养基(蛋白胨10.0g/L、氯化钠5.0g/L、葡萄糖5.0g/L、牛肉浸出粉3.0g/L)。
2.2 方法
2.2.1 液体菌种的制备
无菌条件下向100mL的液体肉汤培养基中接种一环B048菌菌种,36℃,180r/min,培养26h,作为液体菌种。
2.2.2 固体发酵培养
液体菌种以5%的接种量接入基础发酵培养基中37℃修改后,称量,稀释,进行平板菌落计数测其在不同培养基中的生长状况。
2.2.3 固体发酵培养基的优化筛选
(1)碳源对菌株发酵的影响:分别在基础培养基中添加不同的碳源进行发酵试验:100%麸皮作为对照组,100%麸皮+2%葡萄糖,100%麸皮+2%蔗糖,100%麸皮+2%麦芽糖,90%麸皮+10%可溶性淀粉,90%麸皮+10%玉米面粉,以100%麸皮基础培养基为对照,根据发酵后活菌数确定其最佳碳源。
(2)氮源对发酵菌株的影响:在已确定最佳碳源的培养基中,分别添加不同的氮源,100%麸皮作为对照组,90%麸皮+10%豆粕,100%麸皮+5%尿素,100%麸皮+5%(NH4)2SO4,100%麸皮+5%NH4Cl,100%麸皮+5%蛋白胨,100%麸皮+5%NH4NO3,以对照组为对照,根据发酵的活菌数确定其最佳氮源。
(3)无机盐对发酵菌株的影响:在已确定最佳碳源,氮源的培养基里分别添加不同的无机盐,添加量均为1%。90%麸皮+10%豆粕为对照组,90%麸皮+10%豆粕+1%NaCl,90%麸皮+10%豆粕+1%Mg-SO4,90%麸皮+10%豆粕+1%CaCO3,90%麸皮+10%豆粕+1%KNO3,90%麸皮+10%豆粕+1%K2HPO3,根据发酵的活菌数确定其最佳无机盐。
(4)培养基正交试验:培养基筛选采用3因素3水平L9(33)正交试验,共设9个处理,每个处理重复3次,各参数的水平值根据单因子实验的结果。选择碳源,氮源,无机盐做正交实验,测得各试验的水平值,最后筛选出优化组合。
2.2.4 培养条件的筛选
(1)最佳培养时间的筛选:在已确定培养基配方的基础上,在250mL的锥形瓶里分别加入18g麸皮,4g豆粕,0.2g氯化钠,培养时间的梯度分别为:24h,38h,48h,60h,72h。每个处理重复3次。
(2)最适培养温度的筛选:在已确定培养基配方和最佳培养时间的基础上,在250mL的锥形瓶里分别加入18g麸皮,4g豆粕,0.2g氯化钠,培养时间为48h,培养温度分别设置为:24-26℃,31-33℃,35-38℃,39-41℃,43-45℃。每个处理重复3次。
(3)最佳初始含水量(初始含水量=水的体积/培养基的克数)的筛选:在已确定培养基配方,最佳培养时间和最适培养温度的基础上,在250mL的锥形瓶里分别加入18g麸皮,4g豆粕,0.2g氯化钠,培养时间为48h,温度设置为37℃,初始含水量分别设置为50%,60%,65%,70%,80%。每个处理重复3次。
(4)最佳接种量(初始接种量=液体种子液的体积/培养基的克数)的筛选:在已确定培养基配方,最佳培养时间,最适培养温度和最佳初始含水量的基础上,在250mL的锥形瓶里分别加入18g麸皮,4 g豆粕,0.2g氯化钠,培养时间为48h,温度设置为37℃,初始含水量设置为65%后,接种量的梯度分别设置为:1%,5%,10%,15%,20%,25%。每个处理重复3次。
3 结果与分析
3.1 碳源对发酵的影响
选择5种碳源进行B048菌的发酵试验,结果见图1,与对照组菌数5.56×109cfu/g相比,添加葡萄糖、蔗糖和可溶性淀粉的培养基中菌数略有下降,添加麦芽糖的培养基中菌落数变化不大,其中菌数最高的是90%麸皮+10%玉米面粉,其菌数可达19.6×109cfu/g,但添加玉米面粉的固体培养基通气情况较差,不利于生产上的大规模培养,且成本会增加,因此,综合成本因素及发酵效果,麸皮可以满足B048菌对碳源生长的需要。
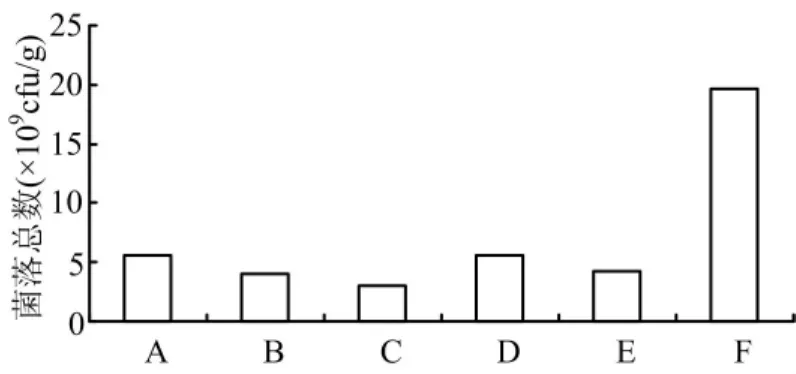
图1 不同碳源对菌数的影响
3.2 氮源对菌株发酵的影响
选择6种氮源进行B048菌的发酵试验,结果见图2,与对照组菌数5.56×109cfu/g相比,添加尿素,(NH4)2SO4,蛋白胨的培养基中细菌数略有下降,添加NH4Cl对细菌数影响不大,而加入豆粕,NH4NO3,的培养基中细菌数显著增加,活菌数可分别达到达18.8×109cfu/g和15.4×109cfu/g,且豆粕为豆油加工的下脚料,成本低,故以豆粕为B048菌发酵的氮源。

图2 不同氮源对菌数的影响
3.3 无机盐对菌株发酵的影响
由图3可以看出,90%麸皮+10%豆粕+1%NaCl的固体培养基对B048菌的生长最为有利,活菌数可达2.0×1010cfu/g,添加 MgSO4、CaCO3、KNO3、K2HPO3的培养基抑制B048菌的生长,而添加1%MgSO4的抑制作用最强,菌数仅为1.8×109cfu/g。因此选择NaCl为最佳无机盐。

图3 不同无机盐对菌数的影响
3.4 培养基配方的正交实验
3.4.1 正交试验设计
培养基筛选采用3因素3水平L9(33)正交试验,共设9个处理,每个处理重复3次,各参数的水平值根据单因子实验的结果。选择碳源,氮源,无机盐做正交实验,在250mL的锥形瓶里试验,具体水平值设置见表1。
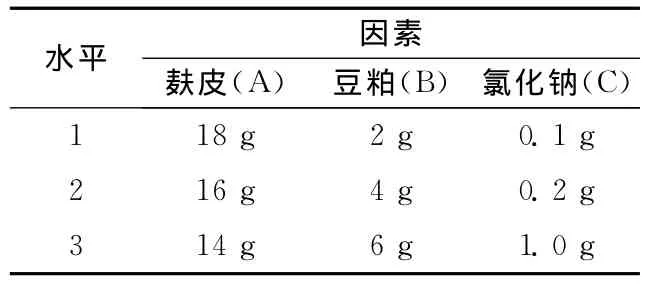
表1 正交试验因素水平表
3.4.2 正交实验结果及极差分析
由表2的结果分析可知:麸皮是影响大豆疫霉生防菌B048菌生长最重要的因素,麸皮浓度的变化对菌数的影响最大,在250mL的锥形瓶里最适的麸皮装瓶量为18g,氯化钠对大豆疫霉生防菌B048菌生长的影响仅次于麸皮,在250mL的锥形瓶里最适的麸皮装瓶量为0.2g,豆粕对大豆疫霉生防菌B048菌生长的影响最小,在250mL的锥形瓶里最适的豆粕装瓶量4g。通过正交试验的优化组合,得到大豆疫霉生防菌B048菌的最佳培养基配方为:麸皮为72g/L,豆粕为16g/L,氯化钠为0.8 g/L。
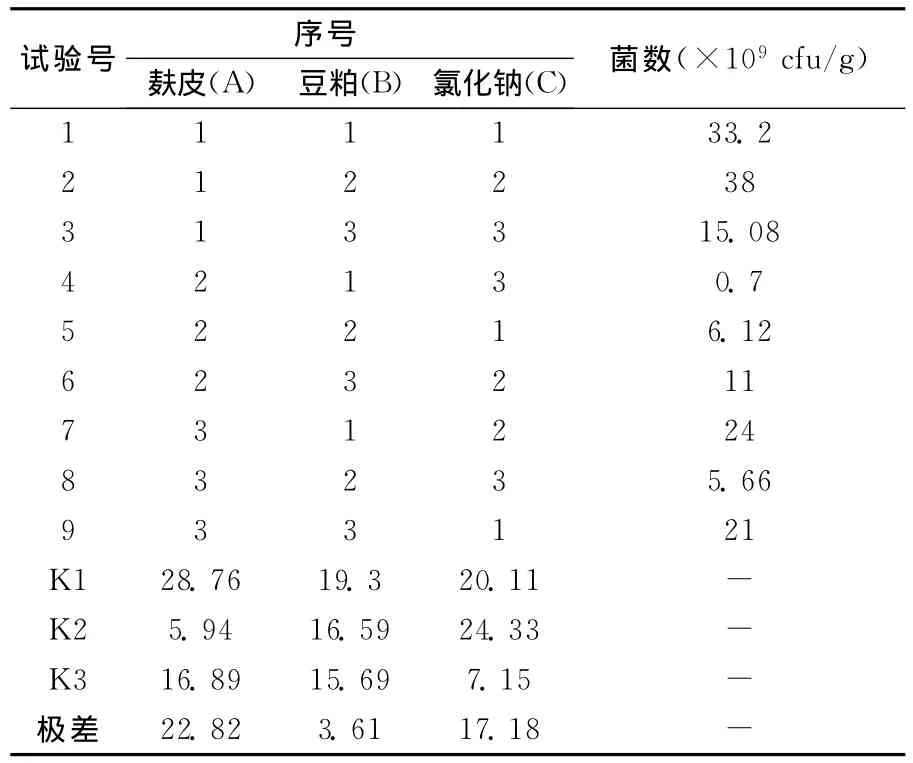
表2 正交试验结果和极差分析
3.5 最佳培养时间的确定
由图4可以看出在24-38h内菌落数变化不大,到48h时活菌数达到最大值,之后活菌数开始下降因此最佳培养时间应该设置为48h。
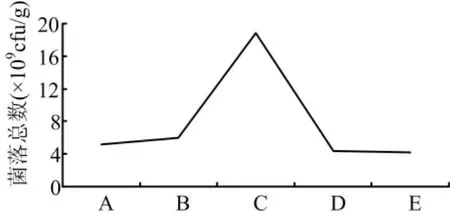
图4 不同培养时间对菌落数的影响
3.6 最适培养温度的筛选
培养温度对细菌的生长至关重要,温度过高过低都不利于细菌的生长,由图5可以看出大豆疫霉生防菌B048菌在35-37℃是生长的最好。故大豆疫霉生防菌B048菌的最适生长温度应该在37℃左右。

图5 不同培养温度下菌落生长状况
3.7 最佳初始含水量的筛选
固体发酵过程中,培养基中水分是重要的因素之一,适宜的初始含水量,有助于菌体吸收培养基中的营养物质和氧的传递,从而促进生长繁殖。含水量过高过低都不利于细菌的生长,由图6可以看出在含水量为65%时大豆疫霉生防菌B048菌生长的最好。
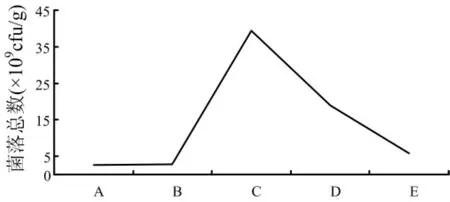
图6 不同的初始含水量对细菌生长的影响
3.8 最佳接种量的确定
接种量是与培养基的利用率直接相关的量。接种量太大菌种吸收不到足够多的营养,菌数不高又造成浪费;接种量太小,对营养利用不充分且细菌发酵周期延长,增加染菌机率。由图7可以看出接种量在20%时,大豆疫霉生防菌B048菌的生长状况最好。
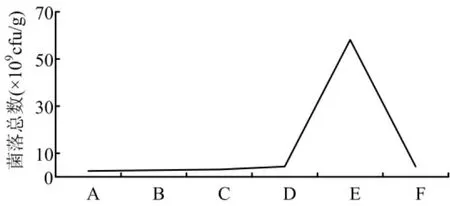
图7 不同的接种量对细菌生长的影响
4 讨论
在用生物防治控制大豆疫霉根腐病方面,从土壤中筛选拮抗菌作为病害生防因子的方法,是非常有潜力的,自然环境是个巨大的微生物菌种库,而土壤则是微生物生活的大本营,是寻找和发现有重要应用潜力的拮抗菌种的主要来源。况福元等[11]从土壤中分离筛选获得2株解淀粉芽抱杆菌(Bacillus amyloliquefaciens)对菜心炭疽病菌希金斯炭疽菌(Colletotrichum higginsianum)具有强烈抑制作用;麦明晓等[12]从土壤中筛选出一株对香蕉的尖孢镰刀菌具有较强抑制作用的师岗链霉菌(Streptomyces morookaense);本实验室从大豆疫霉生存的土壤中筛选具有高拮抗活性和易定殖的生物防治菌株,分离到的一株拮抗效果相对最好细菌,命名为B048菌株。
通过单因子实验和正交实验,初步得到了在实验室条件下的B048菌的固体发酵的培养基配方:麸皮为72g/L,豆粕为16g/L,氯化钠为0.8g/L,筛选后的培养基可使菌落数提高6-7倍,其活菌数可达3.8×1010cfu/g。最适的培养条件为培养时间为48h,培养温度为37℃,初始水量为65%,最佳接种量为20%时为该菌株的最佳培养条件。以期为该菌株的工业生产并获得高产抗菌物质提供参考依据。
本试验只是在实验室条件下对发酵培养基的组成及其培养条件进行了优化,而拮抗菌制剂的生防作用的发挥与制备工艺、使用方法和菌剂使用时温度、湿度、pH值等环境因素密切相关,所以,在拮抗菌制剂商业化过程中,一方面要继续加大对拮抗菌活性物质发酵工艺、提取与纯化方法等的研究,另一方面加大拮抗菌制剂发挥最佳作用条件的研究,今后尚需在发酵罐中和田间实验里进行验证,在实际生产中对发酵条件的控制方面也尚需进一步研究[13];其次,本实验中对最佳碳源、氮源、无机盐离子和正交实验法优化培养基配比研究,仅仅以固体发酵培养基中的活菌数含量作为指标,并没有其他的与之相对应的筛选模型作为依据,例如,对峙法、牛津杯法、离体植物组织平皿法、活体植株筛选法等,因此,可能会对实验结果造成一定的误差,在以后的实验中,可以设计类似的实验方案[13],如测定大豆疫霉拮抗细菌B048对大豆疫霉的抑菌圈大小,来进一步验证实验的准确性和完整性;最后,在今后的研究中,可以对该拮抗菌株B048的活性物质进行研究,利用活性物质分离纯化技术,确定其活性物质的组成、性质和合成途径,也可以进一步研究基因遗传工程等手段,提高拮抗菌的活性及抑菌谱,这些可能为提高发酵培养基中活性成分含量的关键条件。
[1]Tyler BM.Phytophthora sojae:root rot pathogen of soybean and model oomycete[J].Molecular Plant Pathology,2007,8(1):1-8.
[2]Schmitthenner AF.Problem and processing in control of Phytophthora root rot of soybean[J].Plant Disease,1985,(69):362-368.
[3]Wrather JA,Stienstra WC,Koenning SR.Soybean disease loss estimates for the United States from 1996to 1998[J].Canadian Journal of Plant Pathology,2001,3:122-131.
[4]沈崇尧,苏颜纯.中国大豆疫霉根腐病的发现及初步研究[J].植物病理学报,1991,21(4):298.
[5]周肇慧,苏颜纯.大豆疫病的检疫研究一病原菌的分离鉴定[J].植物检疫,1995,(5):257-261.
[6]李宝英,马淑梅.大豆疫霉病研究初报[J].大豆科学,1996,15(2):164-165.
[7]马书君.黑龙江省大豆疫霉根腐病发生发生情况调查[J].大豆科学,1997,16(1):88-89.
[8]王晓鸣,Schmitthenner AF,马书君.黑龙江省大豆疫霉根腐病调查与病原分离[J].植物保护,1998,(3):9-11.
[9]Xiaoli Liu,Mingsheng Dong,Xiaohong Chen.Antimicrobial activity of an endophytic Xylaria sp.YX-28and identification of its antimicrobial compound 7-amino-4-methylcoumarin[J].Applied Microbiology &Biotechnology,2008,78:241-247.
[10]Latijnhouwers M,de Wit PJ,Govers F.Oomycetes and fungi:similar weaponry to attack plants[J].Trends in Microbiology,2003,11(10):462-469.
[11]况福元,吴小丽,吕风青.菜心炭疽病菌拮抗细菌的筛选及鉴定[J].微生物学通报,2009,(9):1350-1355.
[12]麦明晓,黄惠琴,叶建军.香蕉枯萎病拮抗放线菌Da08006的筛选与鉴定[J].生物技术通报,2009,(S1):169-171.
[13]汪莞,赵平生,周涛,王子迎.大豆疫霉拮抗细菌B048液体发酵培养基的筛选与发酵条件的优化[J].合肥师范学院学报,2011,29(3):79-82.

