姜黄素衍生物的合成及其抗肿瘤活性
魏 冬, 姜 波, 薛 璇, 汪佳凤, 周双生
(现代中药安徽省工程技术中心,安徽中医学院药学院,安徽 合肥 230031)
姜黄素(Curcumin)是从姜黄属中药姜黄、郁金、莪术等块茎中提取出来的一种天然产物,为二酮类化合物。姜黄具有破血行气、通经止痛等功效,一直作为药食两用的药材;此外,还用于治疗胸肋刺痛、闭经风湿肩臂疼痛及咽喉肿痛等。
多年研究表明,姜黄素具有广泛的药理作用,如抗氧化、抗凝、抗人类免疫缺陷病毒、抗菌、抗肿瘤、抗突变等[1]。近期研究还显示,姜黄素的抑瘤作用机制主要与诱导肿瘤细胞凋亡有关,它是通过调控抑癌基因、癌基因及其蛋白的表达、诱导细胞周期停滞[2]及调控细胞凋亡信号等途径实现,除此之外,姜黄素还可能通过抗氧化、免疫调节、影响激素水平等机制达到抗肿瘤的目的[3],因其低毒、低分子量、抗肿瘤作用广泛,曾被认为是理想的抗癌化学治疗药物之一。然而姜黄素在体内的溶解性小、体内吸收少、代谢过快,生物利用度低,极大地限制了它的应用。刘剑敏等人[4]将姜黄素结构修饰,使酚羟基改造成了N—马来酰—氨基酸一姜黄素单酯及乙酰姜黄素等衍生物,改善了脂溶性并增强了姜黄素在体内的活性。Ohtsu H等[5]将姜黄素的酚羟基甲基化得到的衍生物具有强烈的抗雄激素活性,能够用于前列腺癌的临床治疗,其效果要优于临床上使用的羟基氟他胺,而姜黄素本身没有这种活性。为了更好的探索姜黄素类化合物的抗肿瘤活性,本文制备了两种新型姜黄素衍生物。并评价了它们与生物大分子对接能力及其抗肿瘤活性。目标化合物合成路线如Scheme 1:
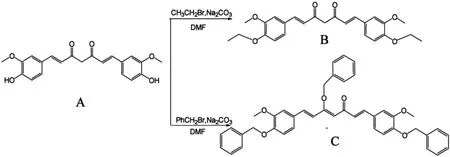
Scheme 1:目标化合物的合成路线
1 实验部分
1.1 试剂与主要仪器
姜黄素,溴乙烷,苄基氯,购至国药基团化学试剂有限公司,均为分析纯。人乳腺癌细胞MCF-7(中科院上海细胞生物学研究所细胞库)。培养基:RPMI-1640培养粉(美国GIBCO公司),用三蒸水配制,添加10%小牛血清,无菌过滤,4℃备用。MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,又称为噻唑蓝,美国sigma公司);TriPure试剂盒。
WRS-1B数字熔点仪(上海精密科学仪器有限公司);Nicolet Avatar 370DTGS 型红外光谱仪(美国);Bruker 400MHz超导核磁共振仪(德国);TSQ Quantum Access MAX三重四极杆液质联用仪(美国)。
1.2 姜黄素衍生物的合成
(1)二乙基姜黄素的合成(B)
将1g姜黄素(A)溶解在20ml N,N-二甲基甲酰胺中,随后投入1.2g碳酸钠固体,80℃下回流反应15min后加入5ml溴乙烷,随后继续反应3h(TLC跟踪),反应完成后加入100ml水溶解钠盐,用乙酸乙酯萃取混合液三次,合并有机层,用1mol/L氢氧化钠溶液洗涤有机层数次,再水洗数次后加入无水硫酸镁,蒸干有机层可得固体。此固体用硅胶柱分离,V(石油醚):V(乙酸乙酯)=8:1为洗脱剂,收集产物,得橙黄色固体0.43g,产率为37.3%,m.p:141-142℃;IR (KBr)υ :2927(CH3),1627(C=O),1513(C=C),1588,1468,1419(Ar),1261 (=CH),804,711(CH);1H-NMR(CDCl3,400MHz)δ:1.47 (t,6H,J=8Hz,CH3),3.93(s,6H,-OCH3),4.12(q,4H,J=8Hz,CH2),5.81(s,2H,CH2),6.51 (d,2H,J=16Hz,=CH),7.08-7.13(m,6H,Ar-H),7.62(d,2H,J=16Hz,=CH-Ar);MS(ESI)m/z:424。
(2)三苄基姜黄素的合成(C)
化合物C的合成方法与B类似,用苄基氯替代了溴乙烷。得到的固体用硅胶柱分离,V(石油醚):V(乙酸乙酯)=10:1为洗脱剂,收集产物。得淡黄色固体0.47g,产率为33.2%,m.p:157-159℃;IR(KBr):2931(CH3),1634(CO),1521(C=C),1596,1501,1435(Ar),1269(=CH),953,856,812(CH);1H-NMR(CDCl3,400MHz)δ:3.96(s,6H,CH3),3.85(s,4H,-OCH2),5.16 (s,1H,CH2),6.53 (d,2H,J=16Hz,=CH),6.79-7.40(m,15H,Ar'-H),7.35(m,6H,Ar-H),7.67 (d,2H,J=16Hz,=CHAr);MS(ESI)m/z:628。
1.3 分子对接
分子对接[5,6]是药物发现研究中的关键步骤,也是最直观了解生物大分子与药物小分子相互作用的手段。人类乙二醛酶是癌症细胞主要排毒通道中重要的功能性蛋白,是公认的有效抑制癌症的作用靶点之一。我们运用 MOE(Molecular Operating Environment)软件[7]模拟了目标化合物分子与人类乙二醛酶中1Q1N蛋白[8]的对接情况,并计算出它们各自的结合作用能力。
1.4 抗肿瘤活性
将MCF-7细胞接种于75ml细胞培养瓶中,加入含10%小牛血清的RPMI 1640培养液,与37℃、5%CO2及饱和湿度的培养箱中培养,3天传代1次。取对数生长期细胞消化、以4.0×104/孔的密度接种于96孔板,培养24h后,分别加入含药物的培养液100μl继续培养24h。按药物浓度2.5,5.0,10.0,20.0,40.0,80.0μmol/L分为6组,每组设6个复孔。对照组以培养液取代,也设6个复孔。在时间结束前4h,每孔加MTT 20μl,培养技术后,吸弃上清液,每孔加入DMSO 150μl,振动10min,用酶标仪570nm处测定每孔D值。计算药物对细胞增殖的抑制率如下:

2 结果与讨论
2.1 姜黄素衍生物的结构确认
2.1.1 乙基姜黄素(B)的结构
由核磁氢谱中数据可知,7.62ppm处的双重峰位于连接苯环双键H的化学位移,7.08-7.13ppm区间出现的多重峰属于苯环的H的化学位移,6.51 ppm处的双峰为非连苯环的双键H的化学位移,4.70ppm附近的单峰峰属于连在两个羰基间的亚甲基H的化学位移,在4.12ppm处出现的四重峰属于氧乙基中亚甲基H的化学位移,3.93ppm出现的单峰归属于甲氧基的H的化学位移。同时根据红外光谱的数据1627cm-1处有一强共轭羰基吸收峰,1513cm-1是碳碳双键吸收峰,1588,1468,1419cm-1处则为苯环骨架吸收峰。质谱中明显存在目标化合物m/z的分子离子峰,表明该物质分子在常温下较稳定。综合上述数据可知,该化合物即为实验要合成的目标化合物B。
2.1.2 苄基姜黄素(C)的结构
根据核磁氢谱中数据可知,7.67ppm处的双重峰位于连接苯环双键 H的化学位移,7.40~7.35 ppm区间出现的多重峰属于姜黄素苯环的H的化学位移,7.19-6.79ppm区间出现的多重峰则属于苄基苯环的H的化学位移,6.53ppm处的双峰为非连苯环的双键H的化学位移,5.16ppm处的单峰峰属于连在两个羰基间的亚甲基H的化学位移,在4.22ppm处出现的四重峰属于乙酸乙基中末端亚甲基H的化学位移,3.87ppm处的单峰归属于连接双酮氧上苄基的乙基中H的化学位移,由于此处的氢峰的位置化学位移较低,如果苄基取代在双酮之间碳上的活泼氢,此时苄基上的乙基的化学位移应该较高,故推测苄基是接在双酮氧上,而不是在其亚甲基位置,此外3.36ppm处的单峰归属于甲氧基中的甲基H的化学位移。同时根据红外光谱的数据1634cm-1处有一强共轭羰基吸收峰,1521cm-1是 碳 碳 双 键 吸 收 峰,1596,1501,1435 cm-1处则为苯环骨架吸收峰。质谱中明显存在目标化合物m/z的分子离子峰,表明该物质分子在常温下较稳定。综合上述数据可知,该化合物即为实验要合成的目标化合物C。
2.2 生物活性实验
以姜黄素为阳性对照,采用经典的MTT法对化合物B和C进行了体外抗肿瘤活性测试,细胞株选用人乳腺癌细胞MCF-7,实验结果见表1和图1。

图1 不同浓度的姜黄素及其衍生物对MCF-7细胞的抑制率(24h)
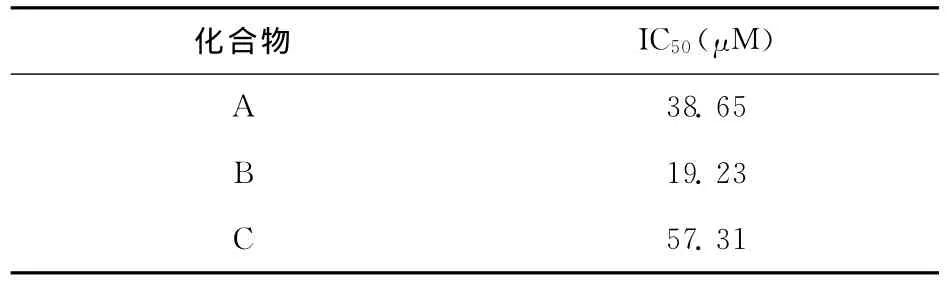
表1 不同化合物对MCF-7的IC50(24h)
从表1中数据可以看出,化合物B和C具有良好的抗肿瘤活性,其中化合物B,即二乙基姜黄素,对MCF-7的IC50值为19.23μM,优于姜黄素(A)本身(IC50为38.65μM),这可能是由于姜黄素上氢被乙基取代带后,增加了其脂溶性,使其生物利用度增加,从而使其活性增强,这与文献报道一致[4,5];而化合物C,即三苄基姜黄素,其活性不及姜黄素,这可能是由于姜黄素分子中引入多苄基后,分子空间位阻增大,它与受体结合能力减弱,使其活性降低(IC50为57.31μM)。
一般情况下,受体与药物分子之间作用力越强,其本身能量降的越低,形成的分子越稳定,其生物活性越强。为了进一步佐证目标化合物的生物活性,我们应用了MOE评价了药物与靶点分子对接,即以目标物分子与乙二醛酶1Q1N蛋白分子发生对接结合作用,实验情况见图2~图4。

图2 姜黄素(A)与1Q1N蛋白空间结合图及能量表(Kcal/mol)

图3 二乙基姜黄素(B)与1Q1N蛋白空间结合图及能量表(Kcal/mol)

图4 苄基姜黄素(C)与1Q1N蛋白空间结合图及能量表(Kcal/mol)
其实验结果与数据显示,化合物与靶点蛋白结合能降低值大小顺序为:B(二乙基姜黄素,-41.94 KJ/mol)、A(姜黄素,-38.51KJ/mol)、C(三苄基姜黄素,-32.78KJ/mol),明上述化合物与受体作用效果:B物最强,C物最弱,这与上述 MTT法体外测试抗肿瘤活性结果相一致。
[1]赵心宇,孟秀香,贾莉等.姜黄素抗肿瘤机制[J].实用药物与临床,2006,9(1):51-52.
[2]Park MJ,Kim EH,Park IC,et al.Curcumin inhibit,cell cycle progression of immortalized human umbilreal vein endothelial(ECV304)cells by up-regulation cyclin-dependent kinase inhibitor,p21WAF1/CIP1,p27KIP1and p53[J].Int J.Oncol,2002,21(2):379-383.
[3]许东晖,王胜,金晶等.姜黄素的药理作用研究进展[J].中草药,2005,11(36):1737-1740.
[4]刘剑敏,姜风超.抗肿瘤前药一姜黄素衍生物的设计合成及初步活性测试[J].中国药师,2005,8(7):543-545.
[5]Ohtsu H,Xiao ZhiYan,Ishida J,et a1.Antitumor agents 217 curcumin analogues as novel androgen receptor antagonists with potential as antiprostate cancer agents[J].J Med Chem,2002,45(23):5037-5042.
[6]周家驹,王亭.药物设计中的分子模型化方法[M].北京:科学出版社,2001:56-64.
[7]杨华峥.农药分子设计[M].北京:科学出版社,2003:145-167.
[8]乔园园,郭盛.分子模拟软件MOE及其在药物中的应用示例[J].计算机与应用化学,2005,22(2):157-160.
[9]Minggui Yuan,Minxian Luo,Yao Song,et al.Identification of curcunmin derivatives as human glyxalase I inhibitors:A combination of biological evaluation molecular docking,3D-QASR and molecular dynamics simulation studies[J],Bioorganci&Medicinal Chemistry,2011,19:1189-1196.

