过氧化物漂白对蔗渣木聚糖提取的影响*
周玉恒,覃香香,蔡爱华,陈海珊,沈育伊,张厚瑞
(广西植物功能物质研究与利用重点实验室,广西植物研究所,广西桂林,541006)
过氧化物漂白对蔗渣木聚糖提取的影响*
周玉恒,覃香香,蔡爱华,陈海珊,沈育伊,张厚瑞
(广西植物功能物质研究与利用重点实验室,广西植物研究所,广西桂林,541006)
比较了直接浸提和预处理后再浸提对蔗渣木聚糖提取率和产物的影响。蔗渣经过碱性过氧化氢或过氧乙酸的漂白预处理,有利于促进木聚糖的溶出和提高提取率,尤其是碱性过氧化氢的促进作用更显著,可以使木聚糖提取率达到21.5%(对干料),精制后产物纯度和白度分别达到85%和83%,但对于木聚糖纯度的提高并不是很显著。不同提取方式所得到的木聚糖在糖基组成和红外光谱图均有很高的相似度。
蔗渣,木聚糖,过氧化物,漂白,提取
木聚糖是自然界第二大天然多糖,是构成植物细胞壁的主要成分之一,在禾本类植物和桦木、杨木等阔叶树中含量更为丰富,占植物干重的20%~35%以上。木聚糖也称为戊聚糖,其结构单元以木糖为主,木糖通过糖苷键连接成聚糖的主链,在主链的不同位置上还连接有葡萄糖醛酸、阿拉伯糖、甘露糖、半乳糖等侧链基团。近年来,发现木聚糖具有不同的生理活性,例如从玉米芯提取的多支链木聚糖具有促进有丝分裂、刺激免疫调节的作用[1];从山毛榉分离得到的木聚糖具有抗肿瘤的活性[2-3];米糠来源的半纤维素可以起到降低血清胆固醇、改善肠道功能和抑制大肠癌发生的生理功能[4];将木聚糖硫酸酯化可以合成抗病毒、抗凝血功能药物[5-10],进行乙酰酯化可以提高疏水性,制造可降解塑料薄膜。
然而由于木聚糖结构的不均一性,不同植物或者的植物不同部位所得到的木聚糖在主链长度、支链种类和分支程度上均存在差别,而且木聚糖在植物细胞壁中并不以游离态存在,和细胞壁其余的成分如纤维素和木质素通过共价键连接,分离提取的方法也会影响杂质的残留程度和目标物质本身的结构。要想得到高纯度的木聚糖,木质素是必须要去除的一个重要成分,它的存在不仅降低木聚糖纯度,而且影响产品的色泽和商品价值。一些过氧化物对木质素有特殊的作用,而且分解产物主要为水和CO2或O2等,在织物、纸浆漂白上的应用已得到重视,本文研究了过氧乙酸和碱性过氧化氢漂白处理对蔗渣木聚糖提取的影响。
1 材料和方法
1.1 材料和试剂
甘蔗渣:取自广西桂林市永福县顺兴糖厂,5~10 cm长纤维状,含水量40%;木糖标准品:本实验室自制,纯度99.9%;葡萄糖标准品:本实验室自制,纯度99.9%;阿拉伯糖标准品:本实验室自制,纯度99.9%;其他试剂均为国产分析纯试剂。
1.2 仪器设备
50L立式灭菌锅(YXQ-LS-SII型),上海博讯实业有限公司医疗设备厂;高效液相色谱仪,购自日本岛津制作所,控制器 CBM-20A,在线脱气器 DGU-20A5,泵LC-20AT,RID-10A示差检测器,SPD-M20A二极管阵列检测器,手动进样器7255!;Thermo傅立叶红外线光谱仪,压片机 HY-12型,为天津天光光学仪器有限公司出产;白度测量仪(WSB-VI型),杭州大吉光电仪器有限公司。
1.3 试验方法
1.3.1 蔗渣木聚糖提取
直接提取:取甘蔗渣10 g,加入100 mL提取液,提取液含150 mg/L NaOH,室温浸提24 h。
过氧乙酸预处理—提取:取10 g甘蔗渣,加入100 mL预处理液,预处理液含4%的过氧乙酸,1%的焦磷酸钠,60℃预处理24 h,预处理结束后自来水洗至中性,再加入提取液提取,提取液与料比为10∶1,提取液含150 g/L NaOH,室温浸提24h。
碱性过氧化氢预处理—提取:取10 g甘蔗渣,加入100 mL预处理液,预处理液含2%的过氧化氢,1%的硅酸钠,60℃预处理24 h,预处理结束后自来水洗至中性,再加入提取液提取,提取液与料比为10∶1,提取液含150 g/L NaOH,室温浸提24 h。
1.3.2 木聚糖的精制
取50 mL提取液,稀释5倍,树脂脱盐至pH 12,减压浓缩至25 mL,加入10倍体积的体积分数95%乙醇溶液沉淀,沉淀物真空干燥,得到蔗渣木聚糖粉末。
1.4 分析方法
1.4.1 提取液糖组分的测定(HPLC法)
取木聚糖提取液10 mL,用H2SO4中和至中性,再加入H2SO4,并用清水定容至25 mL,使H2SO4的终浓度18 g/L,121℃下水解90 min,水解结束后补足蒸发的水分,过滤除去溶液中的不溶物,取0.5 mL滤液,加入9.5 mL去离子水,混合后再加入树脂脱盐脱色,电导降至5 μs/cm以下,微孔滤膜过滤后高效液相色谱测定糖组分,以加入同等量树脂的木糖标准液作为对照,计算水解液木糖浓度,换算回木聚糖的浓度,并计算提取得率。

1.4.2 精制木聚糖糖组分的测定(HPLC法)
取烘至绝干的木聚糖粉末0.5g,加入25 mL 18 g/L H2SO4,121℃下水解90 min,水解液结束后稀释20倍,树脂脱盐后高效液相色谱测定木糖的浓度,计算粉末中木聚糖的纯度。

1.4.3 水解液非糖组分测定(HPLC法)
取水解液2 mL,逐渐加入甲醇6 mL,待沉淀后取上清,高效液相色谱C18柱测定,二极管阵列检测器检测波长吸收峰。
1.4.4 木聚糖粉末红外光谱的测定
木聚糖粉末70℃烘干24 h,取2 mg样品,与200 mg的溴化钾混合,在玛瑙研钵中充分研磨,在压片机上压片,压力为20 kg/cm2,将压好的样片在红外光谱仪上测得谱图。
1.4.5高效液相色谱(HPLC)测定条件
糖组分测定:Transgenomic Ca2+柱,柱温85℃,流动相超纯水,进样量20 μL,流速0.5 mL/min,LCsolution色谱工作站。
非糖组分测定:Insertsil ODS-SP分离柱,柱温30℃,流动相为0.2%V(磷酸)∶V(甲醇为)=3∶1溶液,流速0.8 mL/min,LCsolution色谱工作站。
2 结果与讨论
2.1 提取方式对木聚糖得率的影响
图1表明,经过预处理以后的蔗渣木聚糖提取得率比没有经过预处理的有明显提高,其中碱性过氧化氢预处理的作用更加显著,提取率达到了21.5%,接近了木聚糖在蔗渣中的自然含量25%。提取液糖基组成分析(图2)也可以看出,碱性过氧化氢预处理使提取液水解物木糖和阿拉伯糖峰显著增高,并且检测出了前二者没有的葡萄糖,阿拉伯糖分布于木聚糖的侧链上,是大分子间连接的桥梁之一[11],阿拉伯糖的显著增多说明了分子链间断裂点增多,促进了木聚糖的分离和提取。葡萄糖主要来源于纤维素的分解,可见,碱性过氧化氢作用强度更大,纤维素已受到一定程度碎裂,融入了提取液中。
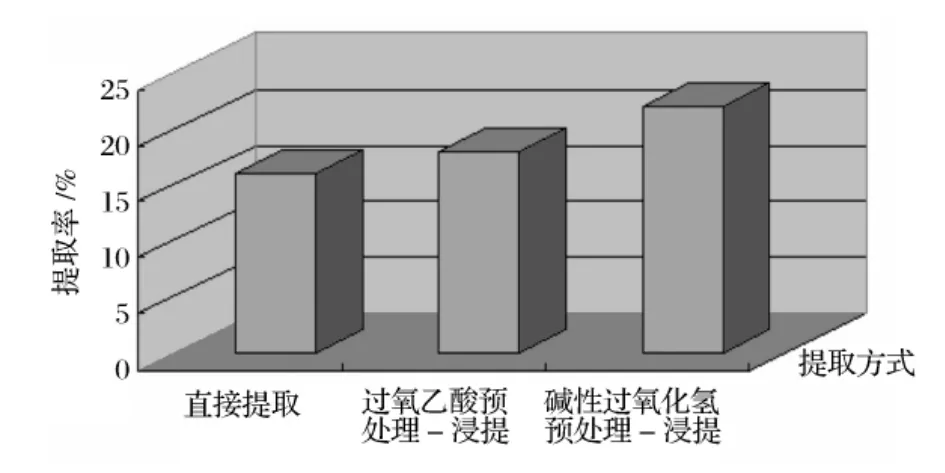
图1 不同的提取方式对提取得率的影响

图2 木聚糖提取液糖基组成HPLC比较图
2.2 提取液非糖成分分析
提取液中的非糖物质主要来源于木质素或者木聚糖支链上一些非糖基团的脱落,从检测的色谱图3中可以看出,在3种提取方式中,均有明显的乙酸峰(190~210 nm),文献报道[12]乙酰基通常分布在半纤维素侧链上,在碱液的作用下很容易脱落形成乙酸或者乙酸盐。碱性过氧化氢预处理的提取液还检测到前二者没有的阿魏酸的存在(300 nm),阿魏酸一般连接在侧链的阿拉伯糖基上,通过阿魏酸再和木质素连接,或者通过双阿魏酸基团和另外一条木聚糖链相连,从而将两条木糖链紧密连接[11],阿魏酸的存在再次证明了碱性过氧化氢使分子间联系更易被打断,从而有利于木聚糖链的释放或者木聚糖的提纯。

图3 木聚糖提取液非糖组分HPLC检测图比较
2.3 精制后木聚糖纯度和白度的变化
纯度和白度是衡量木聚糖商品价值的2个重要指标,从表1中可以看出,3种提取的方式得到的产品在色泽上相差很大,只有碱性过氧化氢预处理后可以得到雪白的粉末产品,在外观上更符合人们的视觉要求。过氧化氢主要是通过形成具有氧化性的HOO-阴离子对木质素分子中的共轭基团进行攻击,OH-的存在可以加速HOO-阴离子的形成,使得在碱性条件下表现出明显的漂白作用。文献报道[13]过氧乙酸对木素的作用比单纯的过氧化氢更专一,氧化作用更强,本实验并没有表现相对应的结果,可能与传统过氧乙酸的制备方式有关,传统A、B液混合的主要制备产物是乙酸、水和过氧化氢的混合物,在酸性条件下,过氧化氢活化度低,形成的HOO-阴离子少,漂白作用遭到削弱。另外,表1纯度的结果表明,3种提取方式得到的产品在纯度上的差异并没有白度那样的显著,显然直接用过氧化氢对原料进行处理,更多的作用在于对有色基团的消色作用,对木质素的去除还是有一定限度的。

表1 提取方式对精制木聚糖纯度和外观的影响
2.4 精制后蔗渣木聚糖糖基的组成
从图4可以看出,3种提取方式得到的精制产物在糖基组成上具有很高的相似度,糖基组成几乎一致,木糖占据总糖的89%,没有葡萄糖的存在,说明提取和精制过程使纤维素和半纤维素彻底分离,存在的主要杂质为与木聚糖具有紧密结合结构的木质素类物。

图4 精制木聚糖糖基组成HPLC图比较图
红外光谱图(图 5)分析表明[14-15],3 种粉末具有相似的结构特征,其中3420.8 cm-1较宽吸收峰为链间(O—H)氢键的伸缩振动峰,2917 cm-1吸收峰为饱和 C—H键伸缩振动引起,1647.0 cm-1和1386.2 cm-1处是—COO—伸缩振动,表明有糖醛酸的存在,1328 cm-1,1250 cm-1表明有木质素的存在,1166 cm-1弱的吸收峰表明有阿拉伯糖侧链,1043.9 cm-1是 C—O、C—C、或者糖苷键 C—O—C的伸缩振动引起,897 cm-1处是木糖单元之间的β-糖苷键的吸收峰,3420.8、2917、1043.9 cm、897 cm-1是典型的半纤维素特征吸收光谱,在1740 cm-1或1710 cm-1处无吸收峰表明半纤维素的乙酰基在碱提取后已全部脱落。
产物的发色基团主要源于不饱和的羰基,大部分存在于木质素分子中,这些发色基团主要存在于1200~1500 cm-1之间,从红外光谱图可以看出,在此区域内经过预处理后的吸收强度上有所减弱。

图5 精制木聚糖FT-IR-光谱比较图
3 结论
蔗渣经过漂白预处理,不仅可以提高木聚糖的提取得率,也可以提高产物的白度和纯度,从而得到更高品质的产品,碱性过氧化氢漂白作用优于过氧乙酸预处理,但改善纯度的作用并不显著,存在于产物中的主要杂质为木质素类物质。
[1]Ebringerove A,Hromadkova Z,Hribalova V.Structure and mitogenic activity of corn cob heteroxylans[J].Int J Biol Macromol,1995,17(6):327-331.
[2]Herath H M T B,Kumar N S,Wimalasiri K M S.Stuctural studies of an arabinoxylan isolated from litsea glutinosa(Lauraceae)[J].Carbohydrate Research,1990,198(2):343-351.
[3]Wimalasiri K M S,Kumar N S.A water-soluble polysaccharide from the leaves of Litsea glutinosa(Lauraceae)[J].Carbohydrate Polymers,1995,26(1):19-23.
[4]吴莺,姚惠源.米糠半纤维素降胆固醇机理的研究[J].粮食与油脂,2001(1):33-35.
[5]Dace R,Mcbride E,Brooks K.Comparison of the anticoagulant action of sulphated and phosphorylated polysacchatides[J].Thrombosis Research,1997,87(1):113-121.
[6]Lewis D,Coleman M,Marbley E.Anticoagulant properties semisynthetic polysaccharide sulfates[J].Thrombosis Research,1991,64(4):413-425.
[7]Chaidedgumjom A,Toyoda H,Woo E R,et al.Effect of(1→3)-and(1→4)-linages of fully sulfated plyusaccharides on their anticoagulant activity[J].Carbohydrate Research,2002,337:925-933.
[8]韩亮,许正宏,陶文沂.玉米芯木聚糖硫酸酯化条件的研究[J].纤维素科学与技术,2005,13(2):26-32.
[9]许泓瑜,韩亮,许正宏.玉米芯木聚糖硫酸酯抗凝血活性及其机制的研究[J].天然产物研究与开发,2006,18:545-548.
[10]许泓瑜,韩亮,许正宏.玉米芯木聚糖硫酸酯抗凝血及抗血小板聚集的活性研究[J].纤维素科学与技术,2008,16(3):28-34.
[11]Sun R C,Fang J M,Rowlands P,et al.Physicochemical and Thermal Characterization of Wheat Straw Hemicelluloses and Cellulose[J].J Agric Food Chem,1998,46:2804-2809.
[12]Shigeki Yoshida,Tetsuo Ono,Noriki Matsuo,et al.Structure of hardwood xylan and specificity of Streptomycesβxylanase toward the xylan[J].Biosci Biotech Biochem,1994,58:2068-2070.
[13]Geroge X,Pan,Liam Spencer,Gordon Leary .A comparative study on reactions of hydrogen peroxide and peracetic acid with lignin chromopheres[J].Holztorschung,2000,54(2):144-152.
[14]Geng Z C,Sun R C,Sun S F,et al.Comparative study of hemicelluloses released during two-stage treatments with acidic organosolv and alkaline peroxide from caligonum monogloliacum and Tamarx spp[J].Polymer Degradation and Stability,2003 ,80:315-323.
[15]Sun R C,Jeremy Tomkinson.Characterization of hemicelluloses isolated with tetraacetylethylenediamine activated peroxide from ultrasound irradiated and alkali pretreated wheat straw[J].European Polymer Journal,2003,39:751-759.
ABSTRACTThe effect of peroxide bleaching on xylan extraction,including the extracted amount from the solid residue,purity and whiteness was studied.The results suggested that the method with pretreatment using alkali peroxide or peracetic acid is more efficient than that of direct extraction.The best results were obtained with alkali-hydrogen peroxide pretreatment following by alkaline extraction.A final brightness of 83%,purity of 87%,and yields of 22%was obtained.Study also showed that alkali-hydrogen peroxide increased the broken points in polymers and facilitated xylan releasing.No significant difference in sugar composition was observed by FT-IR spectra detecting.Alkali hydrogen peroxide pretreatment did not show obvious increase in the purity of product.The basic component and IR spectra from different treatment were very similar.
Key wordssugarcane bagasse,xylan,peroxide,extraction
Effect of Peroxide Bleaching Pretreatments on Xylan Extraction of Sugarcane Bagasse
Zhou Yu-heng ,Qin Xiang-xiang,Cai Ai-hua,Chen Hai-shan,Shen Yu-yi,Zhang Hou-rui
(Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization,Guangxi Institute of Botany,Chinese Academy of Sciences,Guilin 541006,China)
硕士,助理研究员。
*广西青年基金(桂科青0991074)和广西自然科学基金(2010GXNSFA013060)资助
2012-02-17,改回日期:2012-05-09

