离子交换法纯化氨基葡萄糖*
梁芳,刘龙,李江华,2,华兆哲,2,堵国成,2,陈坚,3
1(江南大学糖化学与生物技术教育部重点实验室,江苏无锡,214122)
2(江南大学生物工程学院,江苏 无锡,214122)
离子交换法纯化氨基葡萄糖*
梁芳1,刘龙1,李江华1,2,华兆哲1,2,堵国成1,2,陈坚1,3
1(江南大学糖化学与生物技术教育部重点实验室,江苏无锡,214122)
2(江南大学生物工程学院,江苏 无锡,214122)
以重组大肠杆菌的发酵液为原料,用离子交换法分离提取发酵液中的氨基葡萄糖。研究了阳离子交换树脂001×8吸附氨基葡萄糖的影响因素和动力学性质。确定最优工艺条件为:缓冲液pH=2.2,温度30℃,洗脱液0.7 mol/L的硫酸铵溶液。层析柱Ф1 cm×10 cm,填料6 mL,进样量192 mL,进样流速3.19 BV/h(即每小时流过样品的体积为填充树脂床容积的3.19倍),洗脱流速3.8 BV/h,在此工艺条件下,吸附率达到95%,洗脱率达到98.35%。
氨基葡萄糖,离子交换,分离,洗脱
氨基葡萄糖(glucosamine,2-deoxy-D-glucose,GlcN)是葡萄糖的一个羟基被氨基取代的化合物,是一种重要的功能单糖。氨基葡萄糖及其衍生物广泛应用于医药、食品、化妆品等领域,尤其是因为氨基葡萄糖硫酸盐有缓解关节炎患者的疼痛作用而越来越受到人们的重视。
本研究采用离子交换法从发酵液中提取氨基葡萄糖,发酵液来自本研究室构建的重组大肠杆菌(E.coli-glms-gna1)发酵48 h的发酵液。选择苯乙烯系强酸性阳离子交换树脂001×8纯化氨基葡萄糖的主要依据是氨基葡萄糖是葡萄糖的一个羟基被氨基取代的化合物,苯乙烯系强酸性阳离子交换树脂携带可移动的活性基团,当该树脂侵泡在含有氨基葡萄糖的发酵液中时,氨基葡萄糖扩散到离子交换树脂的表面,然后进入树脂内部,与树脂的活性基团相交换,被交换出来的活性基团逐渐扩散到发酵液中,完成树脂对氨基葡萄糖的吸附过程。氨基葡萄糖被树脂吸附后,高浓度的盐溶液通过竞争作用把树脂上吸附的氨基葡萄糖置换下来,洗脱液再经过结晶、浓缩可以得到氨基葡萄糖纯品。离子交换法从发酵液中提取纯化氨基葡萄糖要比传统化学方法大大降低生产成本且产品纯度较高。
1 材料与方法
1.1 原料与试剂
发酵液:来自本研究室构建的重组大肠杆菌(E.coli-glms-gna1)的发酵液。
E.coli-glms-gna1:本实验室保藏,将来自大肠杆菌E.coli基因组的氨基葡萄糖合成氨基葡萄糖乙酰化酶基因(gna1)通过pET-28(a)在E.coli ATCC 25947(DE3)中进行了克隆和表达而获得。
发酵培养基配方:(1)蛋白胨12 g/L、酵母粉24 g/L、MnCl2·4H2O 15 mg/L;(2)缓冲液 KH2PO42.31 g/L、K2HPO412.54 g/L;(3)葡萄糖 100 g/L;④乳糖10 g/L。
发酵条件:3 L发酵罐,培养温度30℃,搅拌转速400 r/min,1.5 vvm,培养周期24 h。
001×7,001×8,001×10和 ZGSPC106ca四种型号的树脂均购买于浙江争光实业股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
5804R高速冷冻离心机(EPPENDORF);UV2450紫外分光光度计(SHIMADZU);核酸蛋白纯化系统:HD-A电脑采集器,CHL-ZD定时数显恒流泵,HD-3紫外检测仪,BS-100A自动部份收集器(上海青浦沪西仪器厂);电子天平(梅特勒-托利多仪器(上海)有限公司);HYG-IIa回转式恒温调控摇瓶柜(上海欣蕊自动化设备有限公司)。
1.3 方法
1.3.1 树脂的预处理
称取一定质量的树脂于三角瓶中,用去离子水浸泡12 h后,反复洗涤树脂,直至出水清晰、无异味、无细碎树脂为止;再用约2倍树脂体积的4%的HCl溶液浸泡树脂4 h,倾出酸液,用去离子水洗至出水呈中性;然后用约2倍树脂体积的4%左右的NaOH溶液浸泡树脂4 h左右,倾出碱液,用去离子水洗至出水呈中性;再用约2倍树脂体积的4%的HCl溶液浸泡树脂4 h,用去离子水洗至出水呈中性。预处理好的树脂贮存备用。
1.3.2 发酵液预处理
用离心机离心后去除菌体,收集上清液。由于发酵液中除了氨基葡萄糖之外,还有相当多的N-乙酰氨基葡萄糖,为了使N-乙酰氨基葡萄糖脱去乙酰基,在发酵液中加入0.1 mol/L的HCl,100℃水浴3 h。氨基葡萄糖的转换完成后将发酵液冷却,由于发酵液中还含有色素,按照100∶4(质量比)加入硅藻土充分吸附后过滤。预处理好的氨基葡萄糖放于4℃冰箱保存待用。
1.3.3 树脂的选择
取预处理好的001×7,001×8,001×10和 ZGSPC106ca四种型号的树脂各2 g于100 mL三角瓶中,各加入10 mL处理好的发酵液,封好后放于37℃,180 r/min摇床上,振荡6 h后从摇床上取下,测上清液中的氨基葡萄糖含量,对比各个型号树脂的吸附率,选择一种较为合适的树脂。
1.3.4 树脂静态交换容量和吸附率的测定

式中,Qe为树脂交换容量,mg/mL树脂;C0为发酵液中氨基葡萄糖初始浓度,g/L;Ce为吸附平衡时氨基葡萄糖浓度,g/L;V为发酵液初始体积,mL;VR为湿树脂体积,mL;E为树脂吸附率。
1.3.5 最适缓冲液的确定
选用苯乙烯系强酸性阳离子树脂001×8吸附氨基葡萄糖,静态试验确定树脂吸附氨基葡萄糖的缓冲液的最适pH。
1.3.5.1 缓冲液倾出法
配制pH值从2到8共12个梯度的缓冲液,取预处理好的树脂2 g于15 mL离心管中,用缓冲液充分平衡后倾去缓冲液,加入预处理好的发酵液4 mL。放在37℃,160 r/min的摇床上充分振摇约12 h。取出静置30 min。测定上清液中氨糖的含量。
1.3.5.2 缓冲液未倾出法
配制pH值从2.2到8共7个梯度,取预处理好的树脂1 g于15 mL离心管中,加入10 mL缓冲液平衡树脂后加入预处理好的发酵液2 mL。放在37℃,160 r/min的摇床上充分振摇约16 h。取出静置30 min。测定上清液中氨糖的含量。
1.3.6 吸附饱和曲线的确定
把用最适缓冲液平衡后的树脂2 g加入100 mL的三角瓶中,加入35 mL的发酵液,放在180 r/min的摇床上,间隔取样,测其中的氨糖浓度。
1.3.7 氨糖浓度和吸附温度的影响
1.3.7.1 氨糖浓度
配制10,20,30 g/L和40 g/L的氨基葡萄糖溶液,取预处理好的001×8树脂1 g于100 mL三角瓶中,各加入不同浓度的氨基葡萄糖溶液50 mL,封好后放于200 r/min,37℃摇床,振摇11 h后取下,比较每个三角瓶中树脂的吸附率,确定树脂吸附的最佳氨基葡萄糖浓度。
1.3.7.2 温度
取1 g树脂于100 mL三角瓶中,加入30 mL发酵液,分别在(1)28℃,200 r/min;(2)30℃,200 r/min;(3)37℃,200 r/min的摇床上振摇4 h后取下,比较不同温度下的吸附率,选择合适的吸附温度。
1.3.8 洗脱液的选择
方法:分别配置 0.3、0.5、0.7、1.0、1.5、2.0 mol/L的硫酸铵溶液。吸附饱和的树脂,用蒸馏水充分洗涤后,取1 g加入100 mL三角瓶中,再加入25 mL洗脱液。放于37℃,180 r/min摇床上振摇24 h后取下,静置约13 h,测洗脱液中的氨糖含量,计算解析率。
1.3.9 动态吸附实验的穿透曲线
树脂柱型号为1 cm×10 cm,装预处理好的001×8树脂6 g,水洗流速6.37 BV/h,水洗平衡后,用缓冲液平衡树脂,流速3.19 BV/h,树脂平衡后进样,流速为3.19 BV/h,间隔取样并检测,作树脂在此条件下的吸附穿透曲线并利用沈金玉等建立的分析吸附穿透曲线的穿透函数法分析本研究离子交换过程的穿透曲线。求出吸附过程中的一些参数。该模型假设:(1)离子交换柱横截面上浓度分布相等;(2)离子交换柱中所有交换区等长;(3)料液流动速度大于固相浓度波动速度;(4)料液以平推流形式运动而且没有纵向液体扩散现象。
1.3.10 优化进样流速和洗脱流速
1.3.10.1 优化进样流速
固定树脂柱型号为1 cm×10 cm,装预处理好的001×8树脂6 g,水洗流速6.37 BV/h,水洗平衡后,用缓冲液平衡树脂,缓冲液流速3.19 BV/h,进样流速3.19 BV/h,树脂平衡后进样,其中:进样量10 mL,洗脱流速1.60 BV/h,进样流速分别控制1.60 BV/h,3.19 BV/h和4.79 BV/h。比较不同进样流速下的吸附效果,确定最佳进样流速。
1.3.10.2 优化洗脱流速
固定树脂柱型号为1 cm×10 cm,装预处理好的001×8树脂6 g,水洗流速6.37 BV/h,水洗平衡后,用缓冲液平衡树脂,流速3.19 BV/h,树脂平衡后进样,其中,进样量为10 mL,进样流速3.19 BV/h,洗脱流速分别为 1.60 BV/h ,3.19 BV/h,4.79 BV/h,6.37 BV/h,7.66 BV/h,比较不同洗脱流速下的洗脱效果,确定最佳洗脱流速。
2 结果与讨论
2.1 树脂的筛选
从图1中可以看出,所选几种树脂的吸附效果相近,而相同条件下,苯乙烯系强酸性阳离子树脂001×8的吸附率最高,可以达到86.56% ,所以,选择该树脂吸附纯化氨基葡萄糖。苯乙烯系强酸性阳离子树脂001×8是在交联度为8%的苯乙烯-二乙烯苯共聚体上带有磺酸基(—SO3H)的阳离子交换树脂,有良好的交换容量和物理稳定性。
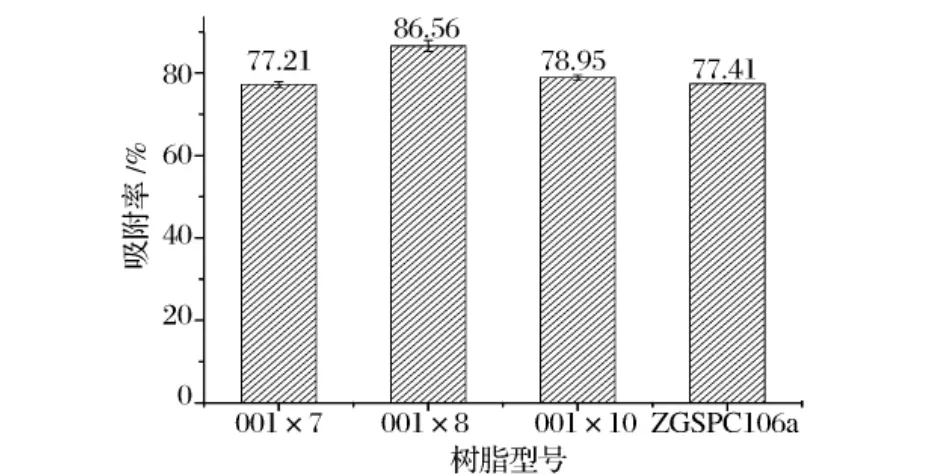
图1 树脂筛选结果图
2.2 缓冲液的优化
2.2.1 缓冲液未倾出法

图2 缓冲液未倾出法中不同pH值的缓冲液对吸附量和吸附率的影响
2.2.2 缓冲液倾出法
从图1和图2中可以看出,利用缓冲液倾出法和缓冲液未倾出法效果相同:吸附率随缓冲液pH的变化而变化。pH值越低,吸附率越高,以pH=2.2的磷酸氢二钠-柠檬酸作为缓冲液时,树脂对氨基葡萄糖的吸附效果最好,吸附率可以达到80%以上。
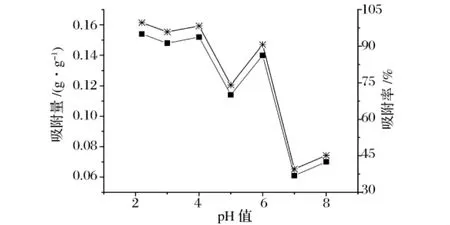
图3 缓冲液倾出法中不同pH值的缓冲液对吸附量和吸附率的影响
2.3 吸附饱和曲线的确定
从图4可以看出,在第8 h树脂对氨糖的吸附基本达到吸附平衡。离子交换基团在发酵溶液中解离后,能吸引发酵液中氨基葡萄糖的氨基,在8 h后,树脂对氨基葡萄糖的吸附率达到43%,且随着时间的增加,吸附率不再增加,说明8 h已经达到吸附平衡,再增加氨基葡萄糖的量树脂也不会有吸附行为。

图4001×8树脂的吸附饱和曲线
2.4 氨基葡萄糖浓度和吸附温度的优化
2.4.1 氨基葡萄糖浓度的优化
从图5中可以看出,氨基葡萄糖浓度对吸附率的影响不大,当氨基葡萄糖浓度从10 g/L增加到40 g/L时,吸附率随浓度增加有所提高,但提高幅度不是太大,考虑到节省成本和提高效率,可以取原发酵液直接进样。
2.4.2 吸附温度的优化
分析图6,可以看出:001×8树脂对氨基葡萄糖的吸附属吸热反应,温度从28℃升高到37℃,吸附率逐渐提高。但温度高于30℃时,吸附率的提高并不太明显,为了节约成本,选择30℃为树脂吸附氨基葡萄糖的最佳温度。

图5 氨基葡萄糖浓度对吸附率的影响
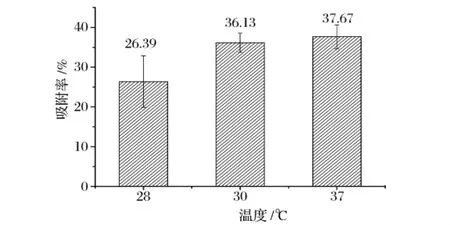
图6 温度对吸附率的影响
2.5 洗脱液的优化
实验中比较了 NaOH,NaCl,(NH4)2SO4和氨水的洗脱效果,结果发现(NH4)2SO4的洗脱效果最好。以下是对洗脱液(NH4)2SO4溶液浓度的优化结果。
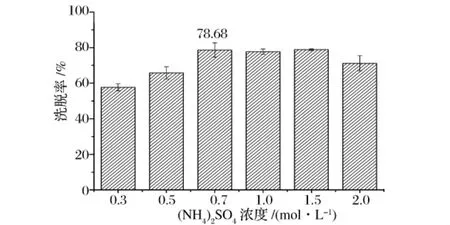
图7(NH4)2SO4溶液浓度对洗脱率的影响
从图7可以看出:(NH4)2SO4溶液的浓度从0.3 mol/L增加到0.7 mol/L,吸附率随着(NH4)2SO4浓度的增加而增加,当(NH4)2SO4浓度超过0.7 mol/L时,吸附率有所下降。即当硫酸铵溶液浓度为0.7 mol/L时,解析率最大,可达到80%以上,故选择0.7 mol/L的(NH4)2SO4溶液为洗脱液。
2.6 动态吸附实验的穿透曲线
发酵液持续的流过离子交换柱,刚开始流出液中的氨基葡萄糖浓度为零,随着时间的增加,流出液中氨基葡萄糖的浓度逐渐上升,交换区不断下移,当c=0.05 c0时(c为流出液中氨基葡萄糖的浓度,c0为原发酵液中氨基葡萄糖的浓度),说明交换区已经移到离子交换柱的底部,对应的时间θ0为穿透时间,当c=0.95 c0时,柱内的全部树脂已经达到饱和交换量,树脂不再吸附氨基葡萄糖,以c/c0对时间t作图,得到该条件下的穿透曲线(图8)。
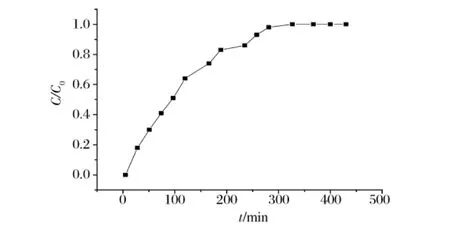
图8 动态吸附过程的穿透曲线
从图8中可以看出,该条件下的穿透时间θ0=9 min,192 min达到饱和,应停止进样,最大进样量为192 mL。
利用穿透函数法分析离子交换过程的穿透曲线。

图9 穿透函数曲线
将穿透曲线用 Lg[1/(1-c/c0)]对(θ-θ0)在双对数坐标上作图,得到一条直线,说明穿透曲线符合穿透函数模型。依据该模型,可以求出树脂吸附氨基葡萄糖的一些参数,在初始发酵液中氨基葡萄糖浓度c0=41.998 g/L,进样表观流速 U=1 mL/min,离子交换柱高度H=10 cm,柱子所装填料等于6 g时,穿透函数曲线斜率β=0.014,穿透时间θ0=9 min,c/c0=0.632 时,传质系数 Kf= β/θm=0.007 h-1,传质单元高度Ht=6.714 m,交换区高度hz=9.302 cm,这些参数可以为实验放大提供理论依据。
2.7 进样流速和洗脱流速的优化
2.7.1 进样流速的优化
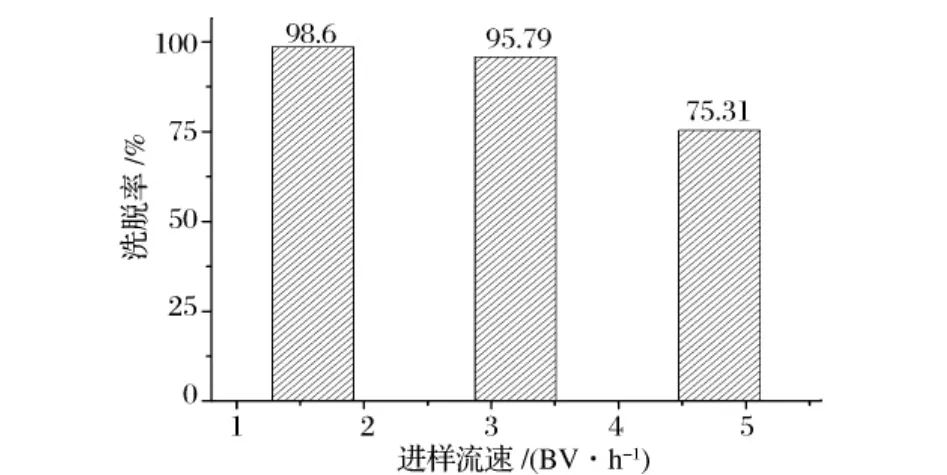
图10 进样流速对洗脱率的影响
从图10看出,进样速度为1.6BV/h时,填料能够更充分地吸附氨基葡萄糖,吸附率达到98.6%,随着进样流速的增加,吸附率下降,当进样流速为4.79时,吸附率只有75.31%,由于进样速度太小,会影响生产效率。从生产效率和洗脱率考虑,3.19 BV/h为最佳进样速度,这时洗脱率可以达到95%以上。
2.7.2 洗脱流速的优化
用0.7 mol/L的(NH4)2SO4溶液洗脱吸附了氨基葡萄糖的树脂,洗脱流速过快,树脂会因为不能被充分的洗涤导致洗脱率下降,洗脱速度过慢,会加长生产周期,并且可能发生二次吸附。从图11看出:当洗脱流速为3.8 BV/h时,洗脱率最高,可以达到98.35%,选择3.8 BV/h为洗脱流速。

图11 洗脱流速对洗脱率的影响
3 结论
对氨基葡萄糖的下游提取工艺,包括发酵液的预处理以及树脂对氨基葡萄糖的静态吸附和动态吸附进行了研究。由于初始发酵液中含有较多的色素和一部分乙酰氨基葡萄糖,所以,要尽量的除去色素并将乙酰氨基葡萄糖水解为氨基葡萄糖。本研究以重组大肠杆菌的发酵液为原料,用离子交换法分离提取发酵液中的氨基葡萄糖。研究了阳离子交换树脂001×8吸附氨基葡萄糖的影响因素和动力学性质。为氨基葡萄糖下游提取放大提供理论依据。
[1]Rebecca A,Chmielowski.Scale-up of upstream and downstream operations for the production of glucosamine using microbial fermentation [J].Biotechnology Journal,2007,2(8):996-1006.
[2]Khor E,Lim LY.Implantable applications of chitin and chitosan.Biomaterials[J].Biomaterials,2003,24(13):2339-2349.
[3]Weiyu F,Bohlmann JA,Trinkle JR,et al.Glucosamine and method of making glucosamine from microbial biomass[P].US:H002218,2008-03-06.
[4]朱松,王洪新,陈尚卫,等.离子交换吸附分离茶氨酸的研究[J].食品科学,2007,28(9):148-153.
[5]谢红梅,祖丕贵,吴平东.聚乙烯吡啶树脂吸附有机酸和醇的特性[J].高校化学工程学报,1992,6(4):329-344.
[6]梁勇,温碧珍.钩藤中总乍物碱的提取分离研究[J].中国热带医学,2006,6(1):135-136.
[7]姜舜尧.益母草药材中水苏碱成分的高效液相色谱法分析[J].药物分析杂志,21(4):243-247.
[8]沈金玉,汪秦宇,丛进阳.谷氨酸离子交换过程动态传统曲线的分析[J].清华大学学报,1996,36(6):44-49.
[9]李仁炳,丁社光.硅藻土吸附Cu2+吸附平衡等温式及穿透曲线的测定[J].重庆工商大学学报,2008,25(3):286-287.
ABSTRACTThe fermented broth of restructured E.coli as raw materials was used to extract glucosamine by ion exchange method.The effects of extraction conditions on glucosamine extraction were studied,and cation exchange resin 001 x 8 was selected.The affecting factors and dynamics properties of absorption of glucosamine by this resin were investigated.The optical conditions were:pH 2.2,temperature 30 ℃,elution with 0.7 mol/L of ammonium sulfate solution;Chromatography column Ф1cm x 10 cm,sample amount 192 mL,injection velocity 3.19 BV/h,elution velocity 3.8 BV/h .Under those conditions,adsorption rate reached to 95%and the elution rate was up to 98.35%.
Key wordsglucosamine,ion exchange,separation,elution
Study on Purification of Glucosamine by Ion Exchange
Liang Fang1,Liu Long1,Li Jiang-hua1,2,Hua Zhao-zhe1,2,Du Guo-cheng1,2,Chen Jian1,3
1(The Key Laboratory of Carbohydrate Chemistry and Biotechnology,Ministry of Education,
Jiangnan University,Wuxi 214122,China)
2(School of Biotechnology,Jiangnan University,Wuxi 214122,China)
硕士研究生(刘龙副教授为通讯作者,E-mail:longliu@jiangnan.edu.cn)。
*国家自然科学基金重点项目(No.20836003),国家重点基础研究发展计划(973项目)(No.2010CB535014)
2012-04-10,改回日期:2012-04-25

