降解黄曲霉毒素微生物筛选中降解与吸附结合作用的区分*
李超波,李文明,杨文华,杨小龙,曹郁生
(食品科学与技术国家重点实验室,南昌大学中德联合研究院,江西南昌,330047)
降解黄曲霉毒素微生物筛选中降解与吸附结合作用的区分*
李超波,李文明,杨文华,杨小龙,曹郁生
(食品科学与技术国家重点实验室,南昌大学中德联合研究院,江西南昌,330047)
黄曲霉毒素的污染不仅带来巨大的经济损失,而且严重危害人和动物的健康,因而生物降解真菌毒素一直引人关注。但在研究黄曲霉毒素微生物降解时,首先必须要有可靠的方法来判定毒素是被降解还是可逆的吸附结合。该文在黄曲霉毒素B1(AFB1)降解菌株筛选中,对区分降解与吸附结合作用的方法进行了研究,建立了可靠的分析方法,通过比较不同pH的影响,细胞灭活对AFB1去除的影响,分析菌株细胞水洗脱、有机溶剂萃取后AFB1的变化等方法,有效地排除了生物吸附结合以及pH的干扰,区分了降解作用和可逆的吸附作用,这些方法简单实用。据此,从动物粪便中成功筛选到了2株能高效降解AFB1的菌株F4、F7。
黄曲霉毒素B1,微生物降解,吸附结合,区分
黄曲霉毒素(aflatoxin)是黄曲霉等真菌产生的具有强毒、致癌的次级代谢产物[1],其中以 B1的毒性最强,因而世界卫生组织把黄曲霉毒素B1(Aflatoxin B1,AFB1)定为 ΙA 类致癌物质[2]。黄曲霉毒素母体的基本结构为二呋喃环和香豆素,其中AFB1是二氢呋喃氧杂萘邻酮的衍生物,含有1个双呋喃环和1个氧杂萘邻酮(香豆素)。前者与毒性和致癌性有关,后者增强前者的毒性和致癌性。
AFB1清除去毒的方法主要包括化学法、物理法和生物法。但是化学法、物理法会对食品的质量和营养有不同程度的影响,甚至引起污染。因此利用生物学方法,尤其微生物降解真菌毒素受到密切关注。
微生物对真菌毒素有2种作用方式,一是降解转化,二是吸附结合。前者是将毒素分解转化生成新的产物,后者则是一个可逆的过程。因而区分降解作用和吸附结合是研究微生物降解毒素的一个重要的基础工作。已经发现有多种微生物对AFB1有结合吸附能力,其中对酵母、乳酸菌的研究较多[3-7]。酵母和乳酸菌可以在细胞壁和特殊的结合位点上结合不同的分子,如大分子物质、金属离子等[6,8]。研究证实,这些微生物主要是通过细胞壁吸附毒素,死亡细胞仍具有结合能力。有研究指出,酵母细胞壁的甘露聚糖在对AFB1的吸附中起着重要作用。和酵母不同,乳酸菌对 AFB1的结合能力有高度的种特异性[9],主要与细胞壁上的肽聚糖组分有关。这种结合是可逆的,反复洗脱或加入有机溶剂都能使毒素游离出来。
目前对微生物吸附结合AFB1的研究较多,而降解方面的报道很少[10-12]。AFB1的生物降解,是指AFB1分子的毒性基团被微生物产生的次级代谢产物或者酶分解破坏,同时产生低毒或者无毒的降解产物的过程,毒素生物降解是一种化学反应的过程,完全不同于吸附结合作用[13]。1966年Ciegler等报道了Flavobacterium aurantiacum B-184具有降解AFB1的作用[12]。但后来有人认为并非真正的降解,而是微生物将氯仿溶性的AFB1转化为水溶性的毒素[14]。Hormisch等[15]从煤田附近污染的土壤样品中分离到1株能够降解AFB1的分枝杆菌,进一步试验证明其对AFB1的降解是生物酶解作用。国内有人研究了枯草杆菌、乳酸菌、醋酸菌、面包酵母、酿酒酵母、米曲霉等对AFB1的降解作用,认为枯草杆菌、乳酸菌和醋酸菌的作用最强[16],但因没有排除细胞结合的作用,是否对毒素有降解作用尚不能肯定。另外,外界pH的变化尤其碱性环境也会引起AFB1的降解。因而在筛选降解AFB1的微生物或者确定毒素是否降解时,必须利用可靠的方法来排除吸附结合或者酸碱度变化引起的假阳性结果,而不能单纯根据试验样品中毒素量的变化做出判断。
本研究在AFB1降解菌株筛选中,采用了几种可行的方法排除微生物的吸附作用以及pH的干扰,有效区分了降解作用和吸附作用,并应用于目标菌株的筛选,得到了较好的结果。
1 材料和方法
1.1 主要仪器与试剂
Agilent 1200高效液相色谱仪(美国,Agilent公司),3K18型Sigma高速冷冻离心机(德国,Sigma公司),PB-10型精密pH计(Sartorius公司)。
AFB1标准品(以色列,Fermentek公司),Milli-Q超纯水,甲醇、乙腈(色谱纯,天津永大化学试剂),PVDF 滤膜(0.45 μm 孔径)。
1.2 菌株和培养基
菌株:从动物粪便样品中分离出2株具有去除AFB1能力的革兰氏阴性菌株,编号为F4和F7。
培养基:种子培养基为营养肉汤(pH7.0);发酵培养基(g/L):3 g牛肉膏,10 g蛋白胨,8.5 g NaCl,1 g葡萄糖,1 g KH2PO4,pH 6.5,121 ℃灭菌 20 min;菌种保存,营养琼脂斜面传代。
1.3 AFB1的检测与分析
对Teniola等[17]所描述的方法稍加修改:培养结束后,反应混合液用等体积的二氯甲烷萃取3次,除去二氯甲烷层室温下氮气缓和挥干,用0.5 mL流动相溶解残余物(浓缩1倍),过膜处理,混匀进样。进样量20 μL。色谱条件如下:
色谱柱:CAPCELL PAK UG120 RP-C18柱(250×4.6 mm,5 μm);流动相:V(水)∶V(乙腈)∶V(甲醇)=6∶3∶1;柱温:30 ℃;流速:1 mL/min;紫外检测波长:362 nm。
AFB1的去除率计算:

1.4 AFB1降解与吸附结合作用的区分
1.4.1 菌液对AFB1的去除
取斜面保藏菌种F4、F7分别接种于5 mL种子培养基中,37℃,150 r/min振荡培养24 h,再以5%的接种量转接于100 mL发酵培养基中,37℃,150 r/min振荡培养48 h,分别取975 μL菌体发酵液与25 μL AFB1标准品(100 μg/mL)置于灭菌的1.5 mL离心管中,使其毒素终浓度为2.5 μg/mL,以无菌的发酵培养基加AFB1作为空白对照,37℃,150 r/min暗处振荡培养72 h,3次平行。反应结束后,通过离心(6000 r/min,室温,10 min)去除菌体,取其上清液测样。
1.4.2 细胞和上清液及热处理对AFB1的去除作用
试验分为4组:(1)细胞悬液。将培养好的F4与F7菌液离心(6000 r/min,4℃,10 min)得到菌体细胞,用PBS溶液(10 mmol/L,pH 7.0)充分洗涤2次,然后重悬于PBS(10 mmol/L,pH7.0)中,使溶液中的细胞数分别为1×109CFU/mL和5×109CFU/mL。(2)上清液。(3)细胞悬液和上清液热处理组。取细胞悬液和上清液分别置于100℃水浴中,10 min,进行热处理。
分别取 25 μL AFB1标准品(100 μg/mL)添加到975 μL上述处理的4种液体中,使其毒素终浓度为2.5 μg/mL,以 PBS(10 mmol/L,pH 7.0)代替细胞悬液及上清液作为对照,37℃,150 r/min暗处振荡培养72h,3次平行。反应结束后,菌体细胞通过离心去除(6000 r/min,室温,10 min)。
1.4.3 毒素洗脱萃取试验
以PBS液和含2.5 μg/mL AFB1的PBS作为对照,将与毒素作用后的细胞分散于1.0 mL PBS(10 mmol/L,pH 7.0)中,37 ℃保温 10 min,离心,重复处理3次,用HPLC分析每次被洗脱下来的AFB1。同时以二氯甲烷萃取后的含2.5 μg/mL AFB1的PBS作为对照,将与毒素作用后的细胞用1.0 mL二氯甲烷萃取3次,除去二氯甲烷层室温下氮气缓和挥干,用0.5 mL流动相溶解残余物(浓缩1倍),过膜处理,利用HPLC检测萃取到的AFB1。根据结果计算洗脱率,分析其降解和吸附结合作用。
1.5 pH值的影响和排除
pH变化对黄曲霉毒素降解有着很大影响,而所用的2株菌在培养中会引起pH值上升,为了控制培养过程中pH变化的影响,对发酵培养基进行了改良,使之在培养过程中能维持pH的稳定,以排除干扰。以空白 PB缓冲液(50 mmol/L,pH 7.0)以及Tris-HCl缓冲液(50 mmol/L,pH 依次为 7.5,8.0,8.5,9.0)与AFB1作用作为对照(作用条件与1.4.1相同)。
1.6 数据分析
本研究采用SPSS18.0统计软件进行分析。试验结果数据用均数±标准差(±s)表示,不同组之间的差异性采用one-way ANOVA方法进行比较,P<0.05表示差异显著具有统计学意义。
2 结果和讨论
对分离的具有降解AFB1活性的2株细菌F4和F7进行了考察,以确定其对毒素是否有真正的降解作用。
2.1 AFB1降解与吸附结合作用的区分
2.1.1 细菌培养液中AFB1的去除
F4和F7菌株48 h的培养液中添加2.5 μg/mL AFB1,37 ℃,150 r/min 振荡培养 72 h,取样检测分析,结果表明,两株菌对AFB1的去除率分别达到90.03%和84.56%,见表1。可见2菌具有良好高效的去毒活性。接着做进一步的试验,以排除吸附结合或者环境条件的作用。

表1 菌株F4与F7对AFB1的去除效果
2.1.2 细胞和上清液及热处理对AFB1的去除作用
由图1可以看出,上清液对AFB1去除率很低,分别只有10.75%和6.92%。与上清液相比,菌细胞更能有效地去除AFB1,分别为82.84%和79.07%,接近于细菌培养液。F4与F7的细胞或上清液在100℃处理10 min后会几乎失去去毒活性。
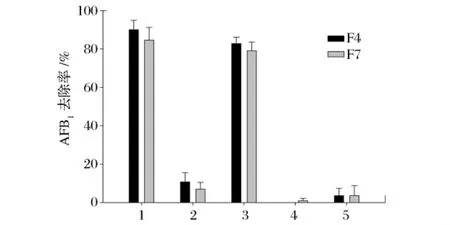
图1 菌株F4、F7对AFB1的去除作用
从菌细胞与上清液对AFB1去除效果可以看出,F4与F7去毒主要是细胞的作用,而上清液作用甚微,一种原因可能是AFB1被胞内活性物质降解,另一个原因是毒素被细胞吸附结合。上清液对毒素也有少量的去除作用,这可能是培养过程中有少量细胞死亡自溶,胞内的活性物质逸出引起AFB1的去除。
热处理可导致细胞去毒活性几乎消失,这可能是胞内活性物质酶的失活引起的。为了排除吸附结合作用,采用水洗脱和溶剂萃取方法做进一步分析。
2.1.3 毒素洗脱萃取
对实验中与AFB1反应的F4和F7细胞进行洗脱试验,PBS重复洗脱3次,取样用HPLC分析,均未检测到AFB1。由图2可以看出,用有机溶剂二氯甲烷对活细胞进行萃取,分析发现分别只有3.17%和3.91%的AFB1被洗脱下来,而对照组中可萃取到80.60%的AFB1。
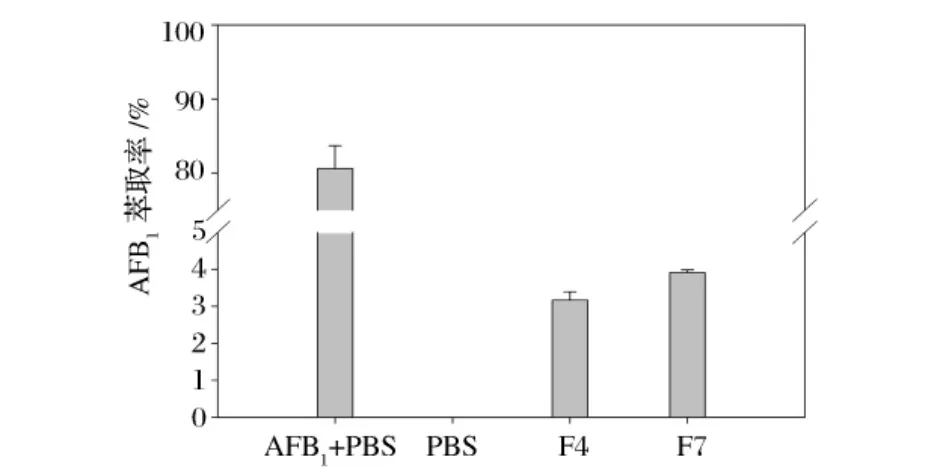
图2 二氯甲烷对去毒细胞上AFB1的萃取率
Peltonen等[6]提出乳酸菌吸附结合去除 AFB1,与细胞壁形成微弱的非共价结合及疏水作用相关,是一个可逆的过程,经过反复水洗或者有机溶剂萃取,毒素可以重新释放出来。Haskard等[7]发现,吸附结合AFB1的鼠李糖乳杆菌(L.rhamnosus LC-705),反复水洗,可以释放出38%的毒素;而用三氯甲烷萃取,可以释放出 98%的 AFB1。Lillehoj等[18]对具有生物降解AFB1活性的橙色黄杆菌NRRL B-184的活细胞用水反复洗脱以及三氯甲烷萃取,均未检测到有AFB1。发现对反应后的F4、F7活细胞,经反复水洗或者二氯甲烷萃取,都几乎检测不到AFB1,因而可以排除细胞的吸附结合作用,而是一个毒素被降解的反应过程。这与前人报道的结论相符。
2.2 pH的影响和排除
由于碱性环境中黄曲霉毒素会被分解,因而在考察降解活性时必须注意pH变化对毒素的影响。从图3可以看出,pH 7.0时AFB1几乎无损失;pH 8.5时有30.43%的AFB1被分解;pH 9.0时有58.96%的AFB1被分解,pH更高时可能导致更多的AFB1分解。这可能是在碱性环境下,AFB1的内酯键易受亲核试剂,尤其是OH-的攻击,从而引起内酯环的打开造成化学降解。因而必须注意反应液中pH的变化,否则会影响结果判定的准确性。
实验中发现,分离到的活性菌株F4和F7在培养后会明显引起培养液pH上升,24 h后达到8.1(见图4),如不加以控制,就会影响结果的准确性。因此对培养基通过添加0.1%的KH2PO4进行改良,初始pH值调为6.5,从图4还可以看出,改良之后F4、F7菌株在培养中的pH得到了有效控制,一般维持在了7.0左右,从而有效地排除了pH的干扰。

图3 pH对AFB1化学降解的影响
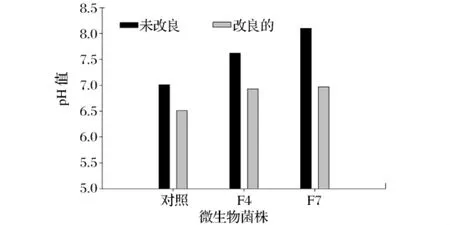
图4 发酵培养基改良前后培养物pH值的变化对比
在以上试验中,首先区分了菌细胞、上清液的去毒活性,证实菌细胞展现了主要活性。然后通过热处理,以了解加热灭活后去毒活性的变化,发现灭活细胞失去了活性。进而再利用洗涤萃取方法作进一步证实,通过这些排除了细胞的吸附结合作用,确定了F4和F7菌株是真正有降解活性的细菌。细菌对AFB1的吸附结合主要是与细胞壁或者细胞壁主要成分如多糖、肽聚糖等物质对AFB1的作用相关,而生物降解去毒是指通过酶促降解或转化AFB1形成无毒或者低毒产物的过程[19],是一种化学反应过程,完全不同于吸附结合作用。EL-Nezami等[20]指出,有吸附结合AFB1能力的鼠李糖乳杆菌,其热处理死细胞具有与活细胞同样的吸附能力。而F4和F7菌细胞热灭活后,基本没有去毒作用,从而排除了细胞吸附结合AFB1的可能性。这提示是细胞产生的酶或其他代谢产物对AFB1的降解作用。在此基础上,对该菌株的降解活性,相关的酶或其他活性物质,以及代谢产物正在做更深入的研究。
3 结论
本文在AFB1降解菌株筛选中,对区分降解作用与吸附结合的方法进行了研究。通过比较不同pH的影响,细胞灭活对AFB1去除的影响,分析菌株细胞水洗脱、有机溶剂萃取后AFB1的变化等方法,有效地排除了生物吸附结合以及pH的干扰,区分了降解作用和可逆的吸附作用。将这些方法应用于目标菌株的筛选,从样品中成功筛选到了2株具有高效降解AFB1活性的菌株F4和F7。
[1]Eaton D L,Gallagher E P.Mechanisms of aflatoxin carcinogenesis[J].Annu Rev Pharmacol,Toxicol,1994,34:135-172.
[2]Gratz S,Wu Q K,El-Nezami H,et al.Lactobacillus rhamnosus Strain GG Reduces Aflatoxin B1Transport,Metabolism,and Toxicity in Caco-2 Cells[J].Appl Environ Microbiol,2007,73(12):3958-64.
[3]Celyk K,Denly M,Savas T.Reduction of toxic effects of aflatoxin by using baker yeast(Saccharomyces cerevisiae)in growing broiler chicken diets[J].Revista Brasileira de Zootecnia,2003,32(3):615-619.
[4]Shettyb P H,Jespersen L.Saccharomyces cerevisiae and lactic acid bacteria as potential mycotoxin decontaminating agents[J].Trends in Food Science and Technology,2006,17(2):48-55.
[5]Shetty P H,Hald B,Jespersen L.Surface binding of aflatoxin B1by Saccharomyces cerevisiae strains with potential decontaminating abilities in indigenous fermented foods[J].International Journal of Food Microbiology,2007,113(1):41-46.
[6]Peltonen K,El-Nezami H,Haskard C,et al.Aflatoxin B1Binding by Dairy Strains of Lactic Acid Bacteria and Bifidobacteria[J].J Dairy Sci,2001,84(10):2152-2156.
[7]Haskard C A,El-Nezami H S,et al.Surface Binding of Aflatoxin B1by Lactic Acid Bacteria[J].Appl Environ Microbiol,2001,67(7):3086-3091.
[8]Brady D,Stoll A D,Strake L,Dunkan J R.Chemical and enzymatic extraction of heavy metal binding polymera from isolated cell walls of Saccharomyces cerevisiae[J].Biotechnology and Bioengineering,1994,44(3):297-302.
[9]Turbic A,Ahokas J T,Haskard C A.Selective in vitro binding of dietary mutagens,individually or in combination,by lactic acid bacteria[J].Food Additives and Contaminants,2002,19(2):144-152.
[10]李志刚,杨宝兰,姚景会,等.乳酸菌对AFB1吸附作用的研究[J].中国食品卫生杂志,2003,15(3):212-215.
[11]Ciegler A,Lillehoj E B,Peterson R E,et al.Microbial Detoxification of Aflatoxin[J].Appl.Microbiol,1966,14(6):934-939.
[12]Engler K H,Coker R D,Evans I H.Uptake of aflatoxin B1and T-2 toxin by two mycotoxin bioassay microorganisms:Kluyveromyces marxianus and Bacillus megaterium[J].Arch Microbiol,2000,174(6):381-385.
[13]计成,赵丽红.黄曲霉毒素生物降解及前景展望[J].动物营养学报,2010,22(2):241-245.
[15]Hormisch D,Brost I,Kohring G W,et al.Mycobacterium fluoranthenivorans sp.nov.,afluoranthene and aflatoxin B1degrading bacterium from contaminated soil of a former coal gas plant[J].Systematic and Applied Microbiology,2004,27(6):653-660.
[16]朱新贵,林捷.几种食品微生物降解黄曲霉毒素的作用的研究[J].食品科学,2001,22(10):65-68.
[17]Teniola O D,Addo P A ,Brost I M,et al.Degradation of aflatoxin B1by cell-free extracts of Rhodococcus erythropolis and Mycobacterium fluoranthenivorans sp.nov.DSM44556T[J].International Journal of Food Microbiology,2005,105(2):111-117.
[18]Lillehoj E B,Ciegler A,Hall H H.Aflatoxin B1uptake by Flavobacterium aurantiacum and resulting toxic effects[J].J Bacteriology,1967,93(1):464-471.
[19]Bhatnagar D,Lillehoj E B,Bennett J W.Biological detoxification of mycotoxins.In:Smith,J E,Henderson,R S,eds.Mycotoxins and Animal Foods[M].Boston:CRC Press,1991:816-826.
[20]El-Nezami H S,Kankaanpaa P E,Salminen S et al.A-bility of dairy strains of lactic acid bacteria to bind food carcinogens,aflatoxin B1[J].Food Chem Toxicol,1998,36(4):321-326.
ABSTRACTAflatoxin contamination not only leads to serious economic losses,but also is detrimental to human and animal health.Much attention has been paid to mycotoxins biodegradation in recent years.For investigation of microbial detoxification,however,a reliable method is needed to decide whether the toxin is degraded or reversibly bound.In this paper,several methods were tested to differentiate the degrading AFB1from adsorbing during the screening of aflatoxin B1-degrading microbes.Through comparing the AFB1detoxification differences between living cells and dead cells,analyzing the residual AFB1from microbial cells by aqueous washing and organic solvent extracting,and maintaining a stable pH of medium,we have effectively excluded the biological adsorbing and binding and pH interferences,and distinguished the degradation from the reversible adsorbing.It has been demonstrated that F4 and F7 strains have high AFB1degradation activity.
Key wordsaflatoxin B1,biodegradation,adsorb and bind,distinguish
Distinguishing Degradation from Binding of AFB1in Screening of Aflatoxin-degrading Microorganisms
Li Chao-bo,Li Wen-ming,Yang Wen-hua,Yang Xiao-long,Cao Yu-sheng
(State Key Laboratory of Food Science and Technology,Sino-German Joint Research Institute,Nanchang University,Nanchang 330047,China)
硕士研究生(曹郁生教授为通讯作者,E-mail:yyssccc@hotmail.com)。
*国家自然科学基金项目(31060022)
2011-12-28,改回日期:2012-03-21

