PI3K和MAPK信号通路通过FOXO1转录因子诱导A549细胞周期的阻滞和凋亡的研究
张洪开,徐韬钧,具英花,于爱鸣
(中国医科大学基础医学院生物化学与分子生物学教研室,沈阳110001)
非小细胞肺癌 (non-small cell lung carcinoma,NSCLC)的发病率约占肺癌的80%~85%,其发生是多个原癌基因和抑癌基因参与的多基因、多步骤的过程,NSCLC的发生、发展受到细胞内磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/Akt和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/ERK 等多条信号传递通路的调节[1,2]。肿瘤的发生与细胞周期失控及细胞凋亡机制异常密切相关,FOXO1作为1个抑癌基因,其蛋白可通过磷酸化水平的修饰对其下游多种靶基因进行表达调控,对细胞周期的阻滞、细胞凋亡发挥关键作用。在多种肿瘤中,PI3K/AKT和MAPK/ERK通路异常激活,导致FOXO1蛋白的转录活性受到抑制[3]。文献报道,MAPK通路和PI3K通路是传递细胞增殖信号的2个重要通路,2者之间存在一定程度的相互作用,而FOXO1蛋白正处于这2种信号途径的共同交汇点,参与细胞增殖与凋亡调节[2]。本研究拟探讨人NSCLC中PI3K/AKT和MAPK/ERK信号通路对细胞周期及细胞凋亡的影响。
1 材料与方法
1.1 材料
肺癌A549细胞系购自中国科学院细胞库,DMEM培养基购自美国Gibco公司,PI3K抑制剂LY294002和有丝分裂原活化蛋白激酶的激酶(mitogen-activated protein kinase kinase,MEK) 抑制剂UO126购自 Cell Signaling公司,FOXO1抗体、p-FOXO1(s256) 抗体、Bim 抗体、p27kip抗体购自Bioworld公司,兔抗人GAPDH抗体购自ABmart公司;HRP标记的山羊抗兔IgG抗体购自Santa Cruz公司,PI购自Sigma公司,Annexin-FITC凋亡检测试剂盒购自南京凯基公司。
1.2 方法
1.2.1 细胞培养及分组:将细胞接种于6孔板,于37℃、饱和湿度、5%CO2培养箱中,用含10%胎牛血清的DMEM培养基培养24 h后(细胞融合度约60%),血清饥饿 24 h,分别加入 25 μmol/L LY294002(LY294002 组)、10 μmol/L UO126(UO126组)、25 μmol/L LY294002+10 μmol/L UO126(联合用药组),由于本实验所用抑制剂的溶剂为DMSO,因此选择等体积的DMSO为对照组,作用24 h后收集细胞。
1.2.2 Western blot:冰上裂解 30 min,超声破碎,4℃,12 000 r/min离心10 min,取上清。取等量蛋白经SDS-PAGE电泳后,转移至PVDF膜,5%脱脂奶粉封闭2 h,加入一抗过夜,洗涤,加入HRP标记的二抗,室温孵育2 h,ECL显影并扫描测灰度值。GAPDH为内参进行标准对照。
1.2.3 流式细胞术(flow cytometry,FCM)检测细胞周期:收集细胞,PBS吹打成单细胞悬液,70%乙醇溶液冰上固定2 h,PBS洗涤2次,加入PI染液(50 μg/mL PI,1 mg/mL RNase),室温下避光孵育 30 min,FCM仪检测。
1.2.4 Annexin-FITC细胞凋亡检测:收集细胞,PBS洗 2 次(1 000 r/min,离心 5 min),加入 500 μL Binding Buffer悬浮细胞,加入 5 μL Annexin V-FITC混匀后,再加入5 μL PI混匀,室温下避光反应15 min,FCM仪检测。1.3 统计学分析
2 结果
2.1 FOXO1及其靶蛋白表达的变化
Western blot结果显示:与对照组相比,LY294002及UO126分别处理A549细胞24 h均可引起细胞中的p-FOXO1蛋白表达水平下降,Bim和p27kip表达水平升高,且联合用药组p-FOXO1进一步下降,Bim和p27kip表达相应增加,差异有统计学意义(P<0.05)。2种药物单独及联合作用前后总的FOXO1表达水平无明显变化,差异无统计学意义(P>0.05),见图 1。
2.2 LY294002和UO126单独及联合作用对A549细胞进程的影响

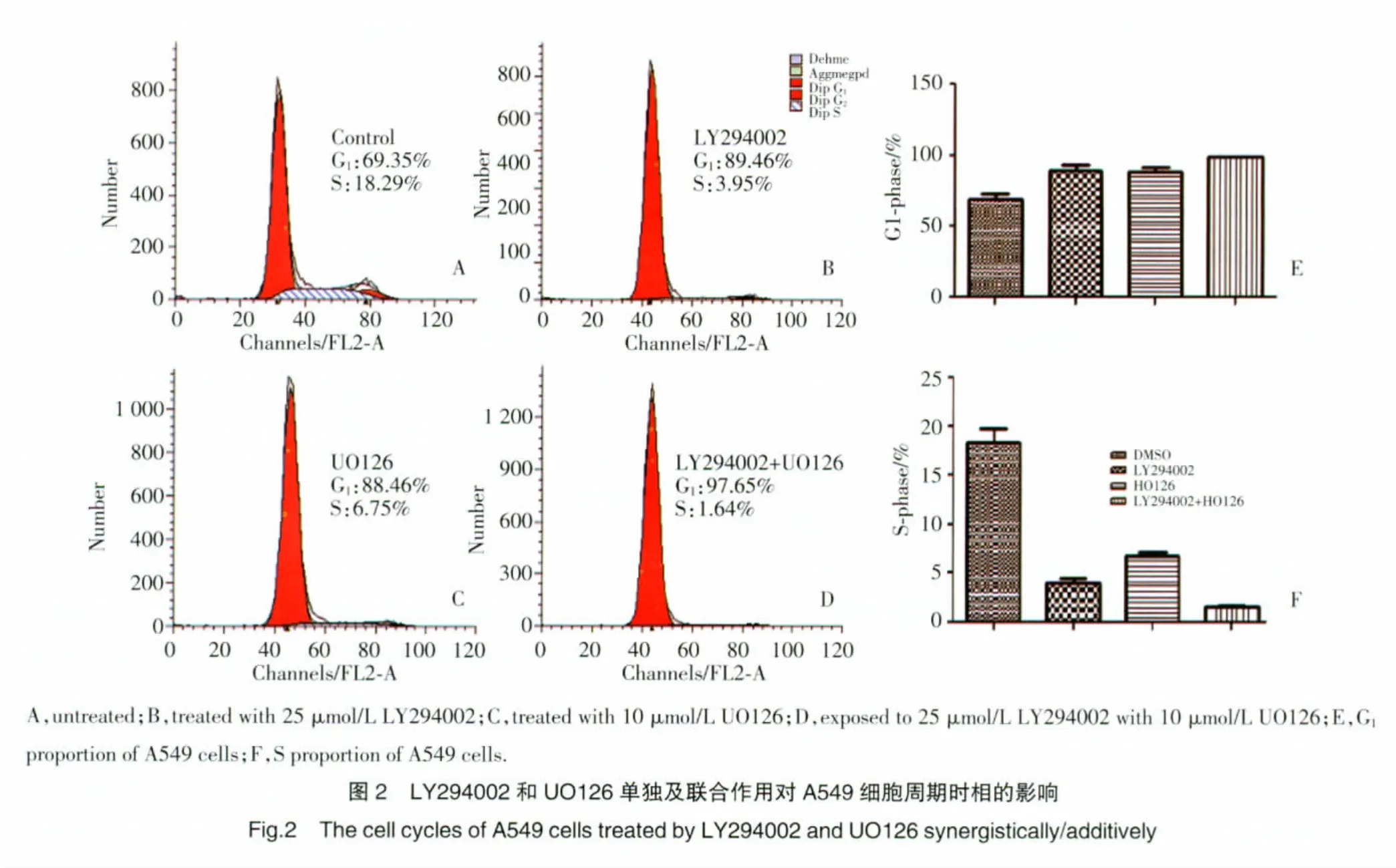
FCM结果显示:用25 μmol/L LY294002和10 μmol/L UO126作用A549细胞24 h后,细胞周期进程均被阻滞于G1期,且2种药物联合作用时,细胞周期被阻滞在G1期的数量较单独用药时增多(对照组:69.35%±2.37%;LY294002 组:89.46%±2.15%;UO126组:88.46%±1.78%;联合用药组:97.65%±0.37%),而S期(对照组:18.09%±0.84%;LY294002组:3.95%±0.24%;UO126组:6.75%±0.25%;联合用药组:1.64%±0.19%)明显减少,与对照组相比,差异均有统计学意义(P<0.05),见图2。
2.3 LY294002和UO126单独及联合用药对A549细胞凋亡的影响
25 μmol/L LY294002 和 10 μmol/L UO126 作用A549细胞24 h后,细胞凋亡率增加(LY294002组:6.83%±1.79%;UO126组:5.92%±1.64%),较对照组(1.80%±0.41%)差异有统计学意义(P<0.01)。与单独用药组相比,联合用药组细胞凋亡率(14.10%±2.07%)明显升高,差异有统计学意义(P<0.01)。见图3。
3 讨论
PI3K/Akt和MAPK/ERK信号传导通路是细胞内2条重要的促增殖和抗凋亡通路,其异常激活可通过影响下游细胞周期调节蛋白和凋亡相关蛋白等效应分子的活性,导致细胞周期的失控和细胞凋亡异常,对肿瘤的发生、发展、侵袭和转移具有重要作用[4~6]。
研究发现,PI3K/Akt和MAPK/ERK信号传导通路均可调节FOXO1转录因子的活性。在这2条信号通路异常激活的作用下,FOXO1蛋白分子中的保守性位点发生磷酸化并从胞核输出,与14-3-3蛋白在胞质内结合,从而封闭了自身的核定位序列并定位于胞质中,远离了其自身的靶基因,从而抑制了FOXO1因子对靶基因的转录调控[7],并通过调节下游细胞周期及凋亡相关信号分子FasL、Bim、p27kip、cyclinE、cyclinB等,影响细胞周期的进程和凋亡事件[8~11]。人NSCLC中PI3K/AkT和MAPK/ERK信号通路通过FOXO1转录因子共同对细胞周期及凋亡的调节机制的研究尚未见报道。我们的前期实验结果表明:分别阻断这2条通路可使FOXO1蛋白的磷酸化水平降低,并使其从胞质向胞核转位,从而影响FOXO1的转录活性,进一步调控细胞的增殖。

本研究应用PI3K/AkT和MAPK/ERK信号通路特异性抑制剂单独及联合处理人NSCLC A549细胞,Western blot结果显示,选用抑制剂LY294002和UO126分别和同时作用A549细胞24 h后,与对照组相比,FOXO1总的蛋白水平没有显著的变化,但磷酸化水平降低,我们推测PI3K/Akt信号转导通路和MAPK/ERK信号转导通路并非调节FOXO1总的蛋白水平,而是通过改变FOXO1因子的磷酸化状态影响其转录活性,进一步调控细胞的增殖。FOXO1因子的磷酸化水平降低的同时,其靶基因p27kip和Bim的蛋白表达水平均表现出升高的趋势,进一步证实PI3K/Akt和MAPK/ERK信号通路特异性抑制剂均能够增强FOXO1因子的转录活性。实验数据表明,在A549细胞中,PI3K/Akt和MAPK/ERK信号通路可以通过增高FOXO1蛋白磷酸化水平,改变FOXO1蛋白的亚细胞定位,进而抑制FOXO1因子的转录活性,加速细胞周期进程,促进细胞存活,诱导细胞增殖。有文献提出:这2条信号通路对FOXO1有着相同的磷酸化调节位点,如胰岛素可以通过激活Akt和MAPK通路使FOXO1的S253位点磷酸化[12]。对于PI3K/Akt和MAPK/ERK信号通路共同对该位点的调节具体机制尚有待进一步研究。本研究中,细胞周期检测结果显示:分别加入LY294002和UO126组都可以抑制细胞的增殖,引起G1/S期的阻滞,且2种药物共同作用时,对细胞G1期的阻滞效果更加明显。FCM分析显示:与对照组相比,LY294002和UO126都可干预A549细胞增殖,诱导细胞的凋亡率呈现较小程度的增加,但2种抑制剂联合作用组细胞凋亡率明显高于单药实验组。表明分别阻断PI3K/Akt和MAPK/ERK信号传导通路后,都可以通过调控FOXO1转录因子的活性,引起A549细胞周期的阻滞,诱导细胞的凋亡,且2条信号通路同时阻断后效果更加明显。
综上所述,阻断PI3K/Akt和MAPK/ERK信号传导通路可通过调控FOXO1转录因子的活性,促进NSCLC细胞的增殖、抑制细胞的凋亡,且这2条通路具有一定的协调作用。
[1]Addario GD,Früh M,Reck M,et al.Metastatic non-small-cell lung cancer:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2010,21(5):116-119.
[2]RoySK,SrivastavaRK,ShankarS.InhibitionofPI3K/AKTand MAPK/ERK pathways causes activation of FOXO transcription factor,leadingtocellcyclearrestandapoptosisinpancreaticcancer[J].J Mol Signal,2010,5:10.
[3]Shankar S,Chen Q,Srivastava RK,et al.Inhibition of PI3K/Akt and MEK/ERK pathways act synergistically to enhance antiangiogenic effects of EGCG through activation of FOXO transcription factor[J].J Mol Signal,2008,3:7.
[4]周振琪,王恬,石放雄.FOXO转录因子调控哺乳动物的细胞周期和凋亡[J].细胞生物学杂志,2007,29(2):187-190.
[5]Chen PN,Hsieh YS,Chiang CL,et al.Silibinin inhibits invasion of oral cancer cells by suppressing the MAPK pathway[J].J Dent Res,2006,85(3):220-225.
[6]Hill K,Welti S,Yu J,et al.Specific requirement for the p85-p110 alpha phosphatidylinositol 3-kinase during epidermal growth factorstimulated actin nucleation in breast cancer cells[J].J Biol Chem,2000,275(6):3741-3744.
[7]Obsilova V,Vecer J,Herman P,et al.14-3-3 Protein interacts with nuclear localization sequence of forkhead transcription factor FoxO4[J].Biochemistry,2005,44(34):11608-11617.
[8]Ramjaun AR,Tomlinson S,Eddaoudi A,et al.Upregulation of two BH3-only proteins,Bmf and Bim,duing TGF beta-induced apotosis[J].Oncogene,2007,26(7):970-981.
[9]Kuiperij HB,Van der Horst A,Raaijmakers J.Activation of Foxo transcription factors contributes contributes to the antiproliferative effect of cAMP[J].Oncogene,2005,24(12):2087-2095.
[10]Weidinger C,Krause K,Klajje A,et al.Forkhead box-O transcription factor:critical conductors of cancer′s fate [J].Endocr Relat Cancer,2008,15(4):917-929.
[11]Gilley J,Coffer PJ,Ham J,et al.FOXO transcription factors directly activate bimgene expression and promote apoptosis in sympathetic neurons[J].Cell Biol,2003,l62(4):613-622.
[12]Naimi M,Gautier N,Chaussade C,et al.Nuclear Foxol controls and integrates key signaling pathways in hepatocytes[J].Endocrinology,2007,148(5):2424-2434.

