非诺贝特联合替米沙坦对高脂饲养大鼠胰岛素抵抗的影响
赵卫华,王占胜,尹玉,胡健
(中国医科大学附属第一医院心血管内科,沈阳110001)
代谢综合征由一簇相互作用的危险因子组成,而胰岛素抵抗(insulin resistance,IR)是代谢综合征的中心环节[1]。研究表明,替米沙坦可改善肥胖高血压患者及糖尿病患者IR[2],非诺贝特可以改善糖尿病患者IR[3]。本研究旨在观察非诺贝特和替米沙坦及其联合应用对IR大鼠IR和糖脂代谢的影响,为两种药物的合理应用提供理论依据。
1 材料与方法
1.1 实验动物及分组
本实验采用了 Storlien 等[4,5]的方法,以自配高脂饲料喂养普通Wistar大鼠建立IR模型。健康雄性Wistar大鼠60只(购于中国医科大学实验动物中心),体质量140~200 g。适应性喂养1周后随机分为普通饮食组(NC组)12只和高脂饮食组(HF0)48只。NC组给予普通标准大鼠饲料(由中国医科大学实验动物中心提供),其热量组成为:碳水化合物63.4%,脂肪16.2%,蛋白质20.4%。高脂组给予自行配制的高脂饲料,其热量组成为:碳水化合物20%,脂肪59%,蛋白质21%。大鼠分笼饲养,自由光照,自由摄取食物和水,每周称1次。6周后再将高脂组大鼠随机分为4组:非诺贝特组(F),替米沙坦组(T),非诺贝特与替米沙坦联合组(F+T)和高脂对照组(HF),每组12只,高脂饮食喂养同时分别给予非诺贝特30 mg/(kg·d)、替米沙坦4 mg/(kg·d)、非诺贝特30 mg/(kg·d)联合替米沙坦4 mg/(kg·d)、蒸馏水灌胃4周。NC组继续普通饮食并蒸馏水灌胃4周。微粒化非诺贝特200 mg/粒,法国利博福尼公司产品;替米沙坦80 mg/片,勃林格殷格翰公司产品。
1.2 高胰岛素正常葡萄糖钳夹技术评价IR大鼠模型
药物干预结束时全部大鼠禁食12 h以进行下一步实验。从每组大鼠中随机选取4只做葡萄糖钳夹实验:10%水合氯醛300 mg/kg腹腔注射麻醉大鼠。仰卧位固定大鼠,灯照以保持大鼠体温,行颈部正中切口分离右颈静脉和左颈动脉,分别插入2枚Y型静脉留置针并缝合固定。颈静脉通路用于输注胰岛素和葡萄糖,颈动脉通路用于取血标本检测葡萄糖浓度,颈动脉导管则接一装有肝素生理盐水的注射器进行抗凝。葡萄糖和胰岛素输注速率由微电脑数字显示式注射器泵控制。手术完毕后先静止30 min,再抽取动脉血0.5 mL测定基础血糖和血清胰岛素水平,然后以恒定速度4 mU/(kg·min)输注胰岛素,每5 min采血1次,用自动血糖仪测定葡萄糖浓度,当血糖低于基础血糖时开始输注10%葡萄糖溶液。葡萄糖输注速率从5 mg/(kg·min)开始,根据血糖调整葡萄糖输注速率,使血糖保持在基础血糖水平±0.5 mmol/L范围。当连续3次血糖均在上述范围时即达到了稳定状态。记录后1 h 13次葡萄糖输注速率,取其平均值即为葡萄糖输注率(GIR)。
1.3 大鼠血压测定
每组大鼠再各随机取出4只进行有创性颈动脉血压测定:10%水合氯醛腹腔麻醉大鼠并仰卧位固定,颈正中切口分离出右侧颈动脉,插入事先充满肝素溶液的静脉留置针,尾端通过三通连接于血压测定仪。稳定10 min后记录血压,持续时间为30 s。
1.4 生化指标测定
自动血糖检测仪测定各组大鼠的鼠尾血糖值(FPG)。麻醉处死大鼠,取下腔静脉血液,立即在4℃恒温下2 500 r/min离心10 min分离血清,分装于1.0 mL EP管中-40℃保存,用于测量血脂、血清空腹胰岛素(FINS)、血清游离脂肪酸(FFA)。采用日立全自动生化仪(7600-110)检测血清脂质,包括甘油三酯(TG),总胆固醇(TC),高密度脂蛋白胆固醇(HDL-C),低密度脂蛋白胆固醇(LDL-C)。FINS测定采用胰岛素放射免疫分析药盒(北京原子高科股份有限公司),FFA测定采用游离脂肪酸试剂盒(南京建成生物工程研究所)。
1.5 大鼠内脏标本的留取
大鼠处死后立即取出大鼠附睾脂肪、肾周围脂肪组织,滤纸吸干后称质量,将标本于液氮中速冻后,置于-80℃冰箱中保存待用。
1.6 统计学分析
2 结果
2.1 各组大鼠体质量和血清学指标变化
HF 组的体质量(BW)、FINS、FPG、FFA、TG、TC、LDL-C 水平显著高于 NC 组(P<0.01),GIR、HDL-C显著低于NC组(P<0.01)。与HF组比较,F组的BW、FINS、TG 显著降低(P<0.01),FFA 降低(P<0.05),GIR、HDL-C显著升高(P<0.01);T组的 BW、FINS、FPG、TG 显著降低(P<0.01),FFA、LDL-C 降低(P<0.05),GIR、HDL-C 显著升高(P<0.01);F+T组的 BW 减轻、FINS、FFA、TG 显著降低(P<0.01),FPG、TC、LDL-C 降低(P<0.05),GIR、HDL-C 显著升高(P<0.01)。结果见表1。
2.2 各组大鼠血压和心率变化
表1 5组大鼠体质量和血清学指标比较(±s)T a b.1 C o m p a r i s o n o f B W a n d s e r o l o g i c a l i n d e x e s i n 5 g r o u p s(±s)
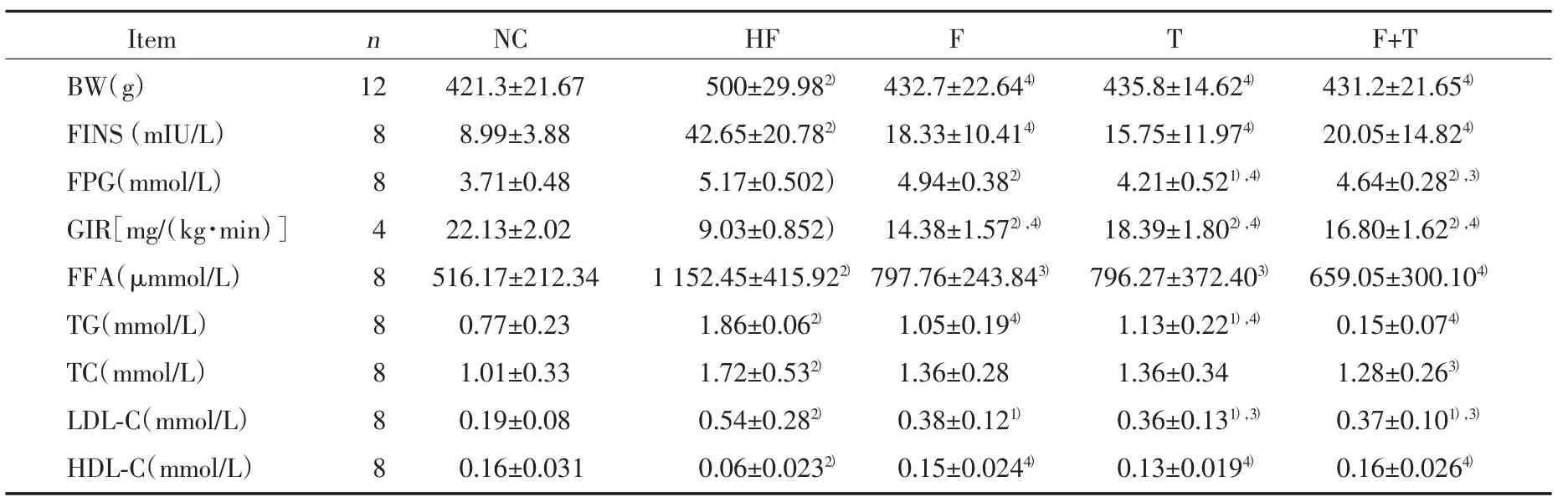
表1 5组大鼠体质量和血清学指标比较(±s)T a b.1 C o m p a r i s o n o f B W a n d s e r o l o g i c a l i n d e x e s i n 5 g r o u p s(±s)
C o m p a r e d w i t h g r o u p N C,1)P < 0.0 5,2)P < 0.0 1;c o m p a r e d w i t h g r o u p H F,3)P < 0.0 5,4)P < 0.0 1.
Item n NC HF F T F+T BW(g) 12 421.3±21.67 500±29.982) 432.7±22.644) 435.8±14.624) 431.2±21.654)FINS(mIU/L) 8 8.99±3.88 42.65±20.782) 18.33±10.414) 15.75±11.974) 20.05±14.824)FPG(mmol/L) 8 3.71±0.48 5.17±0.502) 4.94±0.382) 4.21±0.521),4) 4.64±0.282),3)GIR[mg/(kg·min)]422.13±2.029.03±0.852)14.38±1.572),4)18.39±1.802),4)16.80±1.622),4)FFA(μmmol/L) 8 516.17±212.34 1 152.45±415.922) 797.76±243.843) 796.27±372.403) 659.05±300.104)TG(mmol/L) 8 0.77±0.23 1.86±0.062) 1.05±0.194) 1.13±0.221),4) 0.15±0.074)TC(mmol/L) 8 1.01±0.33 1.72±0.532) 1.36±0.28 1.36±0.34 1.28±0.263)LDL-C(mmol/L) 8 0.19±0.08 0.54±0.282) 0.38±0.121) 0.36±0.131),3) 0.37±0.101),3)HDL-C(mmol/L) 8 0.16±0.031 0.06±0.0232) 0.15±0.0244) 0.13±0.0194) 0.16±0.0264)
HF组大鼠的血压水平明显高于NC组(P<0.01)。T组和F+T组血压与HF组比较明显降低(P<0.01);F组血压有所降低,但与HF组比较无统计学差异(P>0.05)。各组之间平均心率无统计学差异。结果见表2。
2.3 各组大鼠附睾脂肪、肾周围脂肪的质量变化
HF组大鼠的附睾和肾周脂肪质量均明显高于NC组(P<0.01)。药物干预后3组大鼠的附睾和肾周脂肪质量与HF组比较显著下降(P<0.01)。结果见表3。
表2 5组大鼠收缩压、舒张压和心率的比较(±s)Tab.2 Comparison of SBP,DBP and HR in 5 groups(±s)
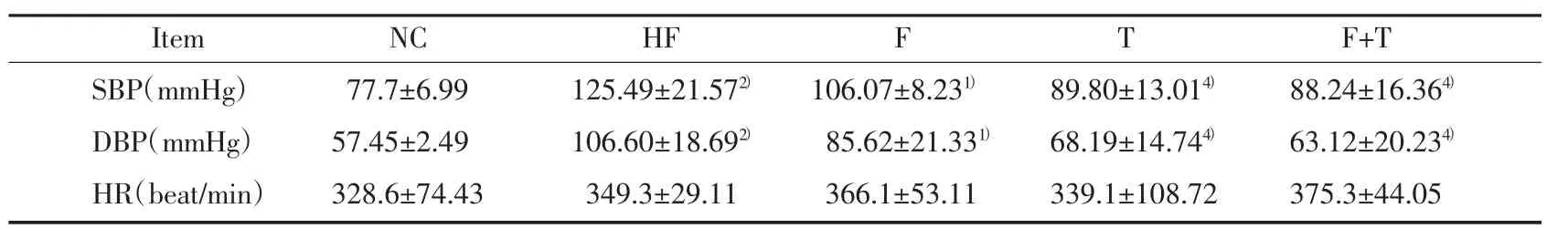
表2 5组大鼠收缩压、舒张压和心率的比较(±s)Tab.2 Comparison of SBP,DBP and HR in 5 groups(±s)
Compared with group NC,1)P < 0.05,2)P < 0.01;compared with group HF,3)P < 0.05,4)P < 0.01.
Item NC HF F T F+T SBP(mmHg) 77.7±6.99 125.49±21.572) 106.07±8.231) 89.80±13.014) 88.24±16.364)DBP(mmHg) 57.45±2.49 106.60±18.692) 85.62±21.331) 68.19±14.744) 63.12±20.234)HR(beat/min) 328.6±74.43 349.3±29.11 366.1±53.11 339.1±108.72 375.3±44.05
表3 5组大鼠附睾脂肪与肾周围脂肪质量比较(±s)Tab.3 Comparison of the weight of epididymal fat and perirenal fat in 5 groups(±s)
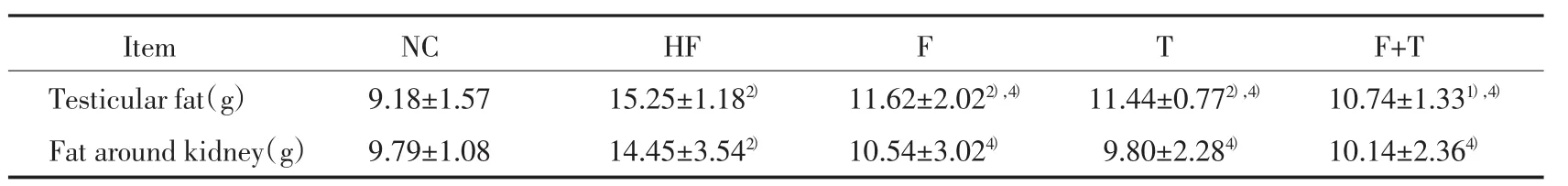
表3 5组大鼠附睾脂肪与肾周围脂肪质量比较(±s)Tab.3 Comparison of the weight of epididymal fat and perirenal fat in 5 groups(±s)
Compared with group NC,1)P < 0.05,2)P < 0.01;compared with Group HF,3)P < 0.05,4)P < 0.01.
Item NC HF F T F+T Testicular fat(g)9.18±1.5715.25±1.182)11.62±2.022),4)11.44±0.772),4)10.74±1.331),4)Fat around kidney(g) 9.79±1.08 14.45±3.542) 10.54±3.024) 9.80±2.284) 10.14±2.364)
3 讨论
代谢综合征是糖耐量减低、高血压、血脂代谢障碍、高胰岛素血症、IR和肥胖等一系列心血管危险因素集中表现的一种临床综合征,基本的病理特征是IR。高脂肪摄入是引发肥胖的主要因素,给予实验大鼠高脂饮食能够建立起模拟人类代谢综合征的模型。本研究表明,高脂饮食使Wistar大鼠体质量增加的程度明显快于普通饮食喂养的大鼠。在喂养的第4周末,2组间体质量即出现了统计学差异[(277.5±14.18)g vs(292.2±13.77)g,P<0.01],这种差异持续到实验的全过程。实验结束时采用高胰岛素-正常葡萄糖钳夹技术对模型进行检测发现,HF组大鼠GIR明显降低;通过测定颈动脉血压发现HF组大鼠血压明显增高;血清学指标FPG、FINS、FFA、TG、TC、LDL-C水平明显增高而HDL-C水平下降,提示高脂饮食喂养大鼠已经具备IR代谢综合征的特征,成为稳定可靠的IR动物模型。关于成模时间,不同的实验因选用的动物品系和高脂饲料的不同而有所差异,但一般普通Wistar或SD大鼠在3~6周后即可出现基本的IR特征。本研究显示,高脂饮食喂养的大鼠第10周时出现了明显的IR特征,但此时空腹血糖在HF组明显高于NC组,显然血糖正常而血清胰岛素浓度开始增高出现的时间在10周之前。
过氧化物酶体增殖物激活受体(PPARs)是配体激活的核转录因子,在调节糖、脂肪等能量代谢发挥着重要的作用。非诺贝特是PPARα的激动剂,直接通过增加基因转录而增加脂蛋白脂肪酶(LPL)活性,降低血液循环中的TG水平,间接通过降低载脂蛋白C-Ⅲ来增加LPL活性,上调载脂蛋白A-I和A-Ⅱ来增加血循环中的HDL-C水平。非诺贝特除了降脂作用外,还能够改善 IR[6,7],在不影响热量摄入的情况下,防止高脂饲料喂养引起的IR动物模型体质量增加[8]。本研究观察到,非诺贝特处理后高脂饮食大鼠血清 FINS、TG、FFA 水平降低,GIR、HDL-C显著升高,同时大鼠体质量增长明显减缓,内脏脂肪减少,胰岛素敏感性增加,IR得到改善,与Ferreira等[9]的研究结果相似。
替米沙坦是血管紧张素Ⅱ1型受体(AT1R)阻断剂(ARBs),是选择性PPARγ激动剂。基础研究表明,替米沙坦在大鼠中通过减弱炎性反应来对抗IR[10]。本研究中替米沙坦降低了IR大鼠PFG、FINS、FFA、TG 水平,升高 GIR、HDL-C,改善 IR,支持Vitale等[11]的研究结论。替米沙坦在改善IR的同时还能减轻体质量,减少内脏脂肪,这一点与噻唑烷二酮类(TZDs)不同。TZDs是完全的PPARγ激动剂,在改善IR同时能明显增加体质量。其原因可能是激活PPARγ后两者调控的靶基因不同所致。
非诺贝特和替米沙坦联合应用是将PPARα与PPARγ激动剂共同干预大鼠的IR状态。Bhalodia等[12]对大鼠的肾脏缺血再灌注损伤的研究中,非诺贝特和替米沙坦联合应用可协同增强PPAR的激活。本研究观察到联合应用可以明显降低大鼠体质量、FPG、FINS、FFA、TG、TC,显著提高 GIR、HDL-C。PPARα激动剂可加速胆固醇向HDL-C转运,PPARγ激动剂可促进巨噬泡沫细胞中胆固醇的溢出,随即由HDL-C运输至肝脏处理[13],从而降低循环中的胆固醇浓度。本研究中单独应用非诺贝特和替米沙坦时对TC虽然有所降低,但与HF组比较无统计学差异,联合应用后却明显降低了胆固醇水平,显示出两种药物降低胆固醇的叠加作用。单独应用非诺贝特和替米沙坦均显著提高GIR,联合用药后GIR改善程度较单独应用替米沙坦增高而较单独应用非诺贝特降低,但3组间无统计学差异。非诺贝特可降低血压,替米沙坦亦降低血压,两药联合应用后血压明显降低。总之,本研究表明,联合应用非诺贝特和替米沙坦能够明显减轻机体脂质代谢紊乱,促进游离脂肪酸的吸收和分解,降低血浆甘油三酯及总胆固醇水平,降低血压,并且不增加体质量,能够更好地改善IR,为临床合理联合用药提供了理论依据。
[1]Lefebvre P,Chinetti G,Fruchart JC,et al.Sorting out the roles of PPAR alpha in energy metabolism and vascular homeostasis[J].J Clinical Inves,2006,116(3):571-580.
[2]Huang GZ,Tang YH,Wang BY,et al.Effects of telmisartan on insulin resistance and visceral fat distribution in Chinese hypertensive patients with obesity[J].Saudi Med J,2011,32(10):1017-1021.
[3]Adeghate E,Adem A,Hasan MY,et al.Medicinal Chemistry and Actions of Dual and Pan PPAR Modulators[J].Open Medi Chem J,2011,5(Suppl 2):93-98.
[4]Storlien LH,James DE,Burleigh KM,et al.Fat feeding causes widespread in vivo insulin resistance,decreased energy expenditure,and obesity in rats[J].American J Physi,1986,251(5 Pt 1):E576-E583.
[5]程海波,司晓晨,尚文斌,等.高脂饲料和高果糖餐分别诱导胰岛素抵抗大鼠模型的胰岛素敏感性[J].中国临床康复,2006,10(7):121-123.
[6]Frick MH,Elo O,Haapa K,et al.Helsinki Heart Study:primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia.Safety of treatment,changes in risk factors,and incidence of coronary heart disease[J].New Eng J Med,1987,317(20):1237-1245.
[7]Nagai Y,Nishio Y,Nakamura T,et al.Amelioration of high fructoseinduced metabolic derangements by activation of PPARalpha[J].Am J Physi,2002,282(5):E1180-E1190.
[8]Guerre-Millo M,Gervois P,Raspe E,et al.Peroxisome proliferatoractivated receptor alpha activators improve insulin sensitivity and reduce adiposity[J].J Biolo Chem,2000,275(22):16638-16642.
[9]Ferreira AV,Parreira GG,Green A,et al.Effects of fenofibrate on lipidmetabolisminadipose tissue of rats[J].Meta Clini Exper,2006,55(6):731-735.
[10]Xu X,Yin X,Feng W,et al.Telmisartan protects against insulin resistance by attenuating inflammatory response in rats[J].JHuazhong Uni Scie Techn Med Sci,2011,31(3):317-323.
[11]Vitale C,Mercuro G,Castiglioni C,et al.Metabolic effect of telmisartan and losartan in hypertensive patients with metabolic syndrome[J].Cardiovas Diabet,2005,5(4):6.
[12]Bhalodia Y,Sheth N,Vaghasiya J,et al.Role of fenofibrate alone and in combination with telmisartan on renal ischemia/reperfusion injury[J].Ren Fail,2010,32(9):1088-1094.
[13]Berger JP,Akiyama TE,Meinke PT.PPARs:therapeutic targets for metabolic disease[J].Tren Pharma Sci,2005,26(5):244-251.

