Bevacizumab抑制人肝癌细胞及其移植瘤的生长
万骋,崔斐,张苗,罗荣城*
(1.南京大学医学院附属鼓楼医院肾内科,江苏南京210008;2.南方医科大学南方医院肿瘤中心,广东广州510515)
Bevacizumab抑制人肝癌细胞及其移植瘤的生长
万骋1,崔斐2,张苗1,罗荣城2*
(1.南京大学医学院附属鼓楼医院肾内科,江苏南京210008;2.南方医科大学南方医院肿瘤中心,广东广州510515)
目的探讨Bevacizumab对肝癌细胞株HepG2及荷肝癌裸鼠移植瘤生长的影响。方法不同浓度Bevacizumab处理HepG2细胞48 h后,MTT法检测Bevacizumab对细胞增殖的抑制作用,设不加药物的HepG2细胞为对照组。建立荷肝癌细胞株HepG2裸鼠皮下移植瘤模型,随机分为Bevacizumab组和空白对照组,观察用药前后肿瘤大小,计算抑瘤率;应用免疫组化计算肿瘤微血管密度。结果Bevacizumab可抑制HepG2细胞增殖;与空白对照组比较,Bevacizumab可延缓移植瘤的生长,MVD值明显降低(P=0.000)。结论Bevacizumab可直接抑制肝癌细胞株HepG2的增殖;Bevacizumab主要通过抑制新生血管的形成而抑制移植瘤的生长。
Bevacizumab;肝细胞癌;HepG2细胞株;裸鼠
肝癌是世界上常见的恶性肿瘤之一,血管内皮生长因子(VEGF)在肝癌发生、发展过程中占有十分重要的地位。Bevacizumab是针对VEGF重组人源化单克隆抗体,已经成为包括肝癌在内的多种恶性肿瘤的重要治疗方法。目前实验表明Bevacizumab主要通过抑制内皮细胞增殖,从而抑制肿瘤血管生成而发挥作用的。而Bevacizumab对肿瘤细胞本身的作用不很清楚,且国内尚无有关Bevacizumab治疗肝癌的实验动物方面的研究。故我们通过研究Bevacizumab对肝癌细胞株和其荷裸鼠移植瘤生长的影响来探讨Bevacizumab在肝细胞癌治疗中的应用前景。
1 材料与方法
1.1 细胞株及实验动物人肝癌细胞株HepG2购自中国医学科学院上海细胞生物学研究所。BALB/C裸鼠20只,5周龄左右,体重约20 g,购自南方医科大学实验动物中心,并于SPF条件下饲养。
1.2 主要药物和试剂Bevacizumab(商品名:Avastin)购自美国Roche公司,MTT为美国Sigma公司产品;兔抗人CD34及PV二步法免疫组化试剂盒、DAB显色试剂盒为广州华拓生物公司产品。
1.3 MTT法测定细胞增殖情况将HepG2细胞株接种于96孔培养板中,达到5×103个/孔,培养24h后换用含Bevacizumab的无血清培养基,使Bevacizumab的浓度分别为0.1μg/ml、1μg/ml、10μg/ml、20 μg/ml,每个浓度设8个复孔,继续培养48 h后用MTT法检测细胞增殖情况。重复该实验3次。计算抑制率= (1-用药组OD值/对照组OD值)×100%,并绘制效应曲线,以浓度为横坐标,抑制率为纵坐标。
1.4 建立荷HepG2细胞株的裸鼠移植瘤模型及分组用药将单细胞悬液,选两只裸鼠的移植瘤作为瘤源,将以对数生长期HepG2细胞制成的单细胞悬液注入其皮下,待肿瘤长至1.5 cm3时处死裸鼠,取出瘤体,分别种入裸鼠背部靠近腋窝处皮肤。接种后每隔4 d测量肿瘤的直径,当直径至0.5 cm左右时即可用于实验。实验分为两组:A组(空白对照组)予无菌生理盐水,0.2 ml/只;B组(Bevacizumab组)注射Bevacizumab,5 mg·kg-1·只-1。两组均为腹腔注射,2次/周×4周。从接种后第19天起,每周测移植瘤的长径(a)和短径(b),计算瘤体积(V=ab2/2)。计算抑瘤率(%)=(1-A组平均瘤体积/B组平均瘤体积)×100%。
1.5 检测移植瘤微血管密度(MVD)根据PowerVision™二步法对移植瘤进行免疫组化染色,按Weidner微血管计数方法计数其微血管量。在100倍镜下选取微血管密度最高的区域,然后在400倍镜下选取3个高倍视野,计数微血管量,每个视野计数3次,取其平均值作为MVD值。
1.6 统计学处理统计软件采用SPSS11.5,实验结果以均数±标准差()表示。采用单因素方差分析(LSD法)分析Bevacizumab对HepG2细胞增殖的影响及两组微血管密度(MVD)的比较。对照组与治疗组间移植瘤体积比较采用重复测量数据的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 Bevacizumab抑制HepG2细胞的增殖不同浓度Bevacizumab均可抑制HepG2细胞的增殖。Bevacizumab浓度为0.1 μg/ml、1 μg/ml、10 μg/ml、20 μg/ml组的HepG2细胞增殖抑制率分别为(8.76± 1.15)%、(26.83±1.20)%、(31.87±1.30)%、(28.20± 1.28)%,其中Bevacizumab浓度为1 μg/ml、10 μg/ml、20 μg/ml的三组与对照组相比差异均有统计学意义(P值分别为0.001,0.000,0.001),见图1。
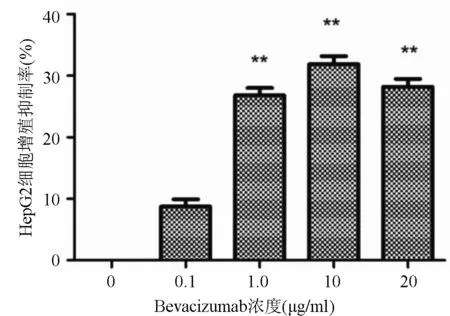
图1 Bevacizumab抑制HepG2细胞增殖情况
2.2 Bevacizumab抑制人肝癌HepG2裸鼠移植瘤生长的情况绘制移植瘤的生长曲线,见图2。第28天,空白对照组和Bevacizumab组的肿瘤体积分别为(1.26±0.34)cm3、(0.72±0.36)cm3。Bevacizumab组的抑瘤率为40.35%。Bevacizumab组治疗后体积与对照组相比增长较缓慢,且有显著统计学意义(P值为0.002)。因此,Bevacizumab可延缓荷人肝癌HepG2裸鼠移植瘤的生长。
2.3 Bevacizumab减少人肝癌HepG2裸鼠移植瘤的微血管密度结果显示,空白对照组的移植瘤组织中可见丰富的新生血管生成,而经Bevacizumab治疗后的移植瘤组织中新生血管形成显著减少。Bevacizumab组的MVD减少,其与空白对照组的MVD分别为29.40 2.07,18.40 2.07,二者比较差异有统计学意义(P值均为0.000)。
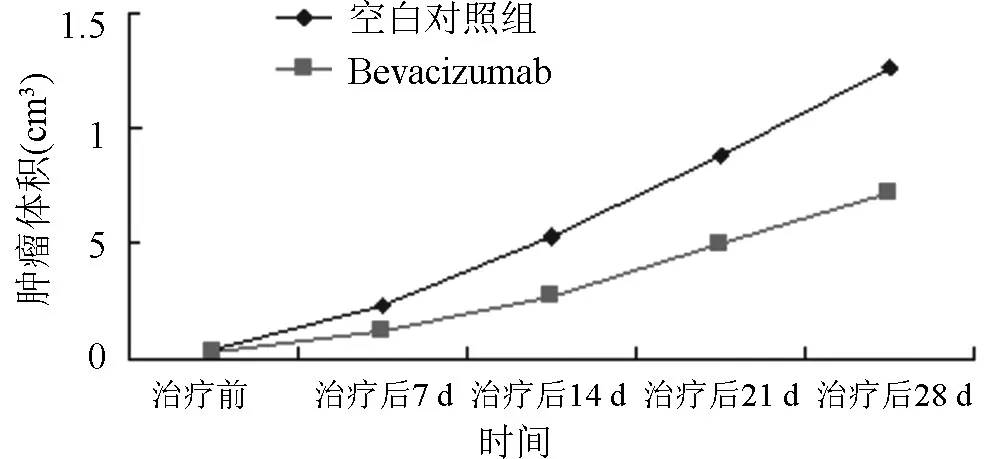
图2 Bevacizumab对荷人肝癌细胞HepG2裸鼠移植瘤生长的影响
3 讨论
肝细胞癌是全世界重大的治疗难题,超过70%的患者确诊时已无手术治疗的指征。而传统的化疗因存在耐药性对大多数患者无效。而生物靶向药物Bevacizumab(Avastin,rhuMAb-VEGF)已被多项Ⅱ期临床试验证明其对进展期的肝癌有一定的治疗疗效[1-2]。目前,Bevacizumab已知的治疗作用主要是通过抑制肿瘤血管的生长而发挥的,但是,有关Bevacizumab是否可直接抑制肿瘤细胞增殖方面的研究很少。近年来多项研究发现肿瘤细胞表面也存在VEGF受体(VEGFR)的表达,且有自分泌作用。因此,抗VEGF治疗也可能通过阻断VEGF与肿瘤细胞表面的VEGFR结合来抑制肿瘤细胞的自分泌途径,从而抑制其生长。Calvani等[3]最近针对Bevacizumab对结肠癌细胞是否有直接作用的研究结果显示,VEGF/KDR/HIF-1-alpha自分泌途径不同程度的促进了缺氧的结肠癌细胞的生存,而Bevacizumab可通过阻断该自分泌途径,从而抑制结肠癌细胞的增殖。而本研究前期试验已表明[4],肝癌细胞株也可能存在VEGF的自分泌机制,而且Bevacizumab作用于肝癌细胞株后,VEGF及其受体KDRm-RNA表达受抑。且目前该实验显示Bevacizumab对肝癌细胞株HepG2的直接抑制增殖作用,除其中最低浓度1 μg/ml外不同浓度的Bevacizumab组的抑制作用与对照组相比差异有统计学差异(P值分别为0.001,0.000,0.001)。综上所述,Bevacizumab可能通过阻断由KDR介导的VEGF自分泌途径而发挥直接抑制肝癌细胞增殖的作用。
目前研究表明,在包括肝癌、结直肠癌、胃癌、卵巢癌、膀胱癌、乳腺癌等多种恶性肿瘤中均发现VEGF呈高表达[5],且VEGF与肿瘤的血管生成和转移密切相关[6],抗VEGF和抗血管生成治疗也可为恶性肿瘤包括肝癌的治疗展现美好的前景。Mabuchi等[7]研究表明贝伐单抗可通过抑制肿瘤血管生成而明显抑制荷卵巢癌细胞裸鼠移植瘤的生长。微血管密度(Microvessel density,MVD)是反映肿瘤血管生成的重要指标。Finn等[8]研究表明贝伐单抗可明显减少荷肝癌细胞移植瘤的MVD,延长老鼠的疾病进展时间。本研究中,Bevacizumab也可抑制人肝癌细胞HepG2裸鼠移植瘤的生长(P值分别为0.002),抑瘤率为40.35%。Bevacizumab组MVD明显减小,与对照组相比差异有统计学意义(P=0.000),该结果证实了Bevacizumab可通过抑制肿瘤新生血管的形成而发挥作用。
综上所述,本研究表明Bevacizumab可直接抑制肝癌细胞的增殖,也可通过抑制肿瘤新生血管的形成来抑制荷肝癌细胞裸鼠移植瘤的生长。这为Bevacizumab治疗肝细胞癌提供了新的理论依据,也为抗肿瘤血管生成的靶向治疗奠定了实验基础。
[1]Sun W,Sohal D,Haller DG,et al.Phase 2 trial of bevacizumab, capecitabine,and oxaliplatin in treatment of advanced hepatocellular carcinoma[J].Cancer,2011,117(14):3187-3192.
[2]Abby B.Siegel,Emil I.Cohen,Allyson Ocean,et al.Phase II trial evaluating the clinical and biologic effects of bevacizumab in unresectable hepatocellular carcinoma[J].Journal of Clinical Oncology, 2008,26(18):2992-2998.
[3]Calvani M,Trisciuoglio D,Bergamaschi C,et al.Differential involvement of vascular endothelial growth factor in the survival of hypoxic colon cancer cells[J].Cancer Res,2008,68(1):285-291.
[4]万骋,崔斐,陈斌,等.抗肿瘤血管生成药bevacizumab对VEGF促人肝癌细胞株HepG2增殖的阻断作用[J].第二军医大学学报,2008,29(9):1060-1064.
[5]Poon RT,Fan ST,Wong J.Clinical implications of circulating angiogenic factors in cancer patients[J].J Clin Oncol,2001,19: 1207-1225.
[6]Yao DF,Wu XH,Zhu Y,et al.Quantitative analysis of vascular endothelial growth factor,microvascular density and their clinicopathologic features in human hepatocellular carcinoma[J].Hepatobiliary Pancreat Dis Int,2005,4:220-226.
[7]Mabuchi S,Kawase C,Altomare DA,et al.Vascular endothelial growth factor is a promising therapeutic target for the treatment of clear cell carcinoma of the Ovary[J].molecular cancer therapeutics,2010,9(8):2411-2422.
[8]Finn RS,Bentley G,Britten CD,et al.Targeting vascular endothelial growth factor with the monoclonal antibody bevacizumab inhibits human hepatocellular carcinoma cells growing in an orthotopic mouse model[J].Liver International,2009,29(2):143-318.
Bevacizumab inhibit the growth of hepatocellular carcinoma cells and hepatoma carcinoma xenografts in nude mice.
WAN Cheng1,CUI Fei2,ZHANG Miao1,LUO Rong-cheng2.1.Department of Nephrology,Drum Tower HospitalAffiliated to Medical School of Nanjing University,Nanjing 210008,Jiangsu,CHINA;2.Cancer Center,Nanfang Hospital of Southern Medical University,Guangzhou,510515,Guangdong,CHINA
ObjectiveTo evaluate the effect of Bevacizumab on the growth of human hepatocellular carcinoma(HCC)HepG2 cells and HCC Xenografts in nude mice.MethodsAfter treatment with different dose of Bevacizumab for 48 h,the proliferation of HepG2 cells was analyzed by MTT assay.The control group was not treated with Bevacizumab.The HepG2 HCC Xenograft models were constructed and divided into two groups:the Bevacizumab group and the control group.Tumor dimensions were recorded and the microvessel density(MVD)was measured by immunohistochemistry.ResultsBevacizumab may inhibit the proliferation of HepG2 cells directly.Compared with the control group,the transplanted tumors in the Bevacizumab group grew slower,and MVD in the bevacizumab group decreased significantly(P=0.000).ConclusionBevacizumab could inhibit the proliferation of HepG2 cells and the growth of HCC xenograft mainly through reducing angiogenesis.
Bevacizumab;Hepatocellular carcinoma;HepG2 cell line;Nude Mice
R735.7
A
1003—6350(2012)08—018—03
10.3969/j.issn.1003-6350.2012.08.008
2011-12-12)
万骋(1983—),女,江西省乐平市人,住院医师,硕士。
*通讯作者:罗荣城,教授,主任医师,博士生导师,E-mail:lrc@nfhoc.com

