非小细胞肺癌放疗联合体外高频热疗80例疗效观察
谌龙 孙娟 马春峰 孙朝军 郑岩红 王华
非小细胞肺癌放疗联合体外高频热疗80例疗效观察
谌龙 孙娟 马春峰 孙朝军 郑岩红 王华
目的探讨非小细胞肺癌单纯放疗和体外高频热疗配合放射治疗的疗效。方法80例初治非小细胞肺癌患者随机分成两组,单纯放疗组和放疗联合体外高频热疗组(简称热放组)各40例。放疗组:2GY/F,5F/W,总剂量60GY;热放组:放射方法同放疗组,只是在放疗前或后1h内给予瘤床区体外高频热疗60min,每周2次。观察指标为胸疼、咳嗽症状改善、近期急性反应、无瘤生存率和总生存率。结果热放组临床症状缓解明显好于单放组,差别有统计学意义,P<0.05;总生存率和无瘤生存率均高于单纯放疗组,但差别无统计学意义,P>0.05;热放疗组的急性反应较轻,放射性肺炎的发生率与单纯放疗组比较,差别无统计学意义,P>0.05。结论放疗联合体外高频热疗治疗非小细胞肺癌,患者耐受性好,可使患者获得较好的临床症状缓解,提高了患者的生活质量,减轻了急性反应,能明显提高1~5年无瘤生存率和总生存率。
肺部肿瘤;放射治疗;体外高频热疗
非小细胞肺癌(NSCLC)占肺癌总数的75% ~80%,多数发现即为晚期,失去了手术时机。治疗上以放化疗为主,5年生存率一般为13%% ~18%,尽管近年来放疗技术取得了较大的发展,但是非小细胞肺癌的远期生存率没有明显提高。因此放疗与热疗的结合成为近年来非小细胞肺癌非手术治疗研究的重点,研究显示体外高频热疗对各种深部肿瘤进行加温配合放射治疗可提高放射敏感性[1-5]。热疗不仅可以直接杀伤肿瘤细胞,并可以使放疗效果提高,是继手术、放疗、化疗之后较安全有效的方法,能明显提高生活质量,延长生存期。本科于2003年1月至2006年1月对80例初治非小细胞肺癌患者,随机分成单纯放疗组和放疗联合体外高频热疗组(简称热放组)各40例,现对其中资料进行回顾性分析,评价单纯放疗和局部热疗配合放射治疗非小细胞肺癌,观察两组临床疗效、急性放射毒副反应,无瘤生存率和总生存率。
1 资料与方法
1.1 一般资料 河南省漯河市舞阳县肿瘤医院放疗科2003~2006接受放疗的非小细胞肺癌患者80例,男48例,女32例。年龄35~78岁,平均年龄52岁。病理确诊为非小细胞肺癌,其中鳞癌43例,腺癌37例,周围型31例,中央型49例;临床以咳嗽、咳痰、痰中带血、胸闷、气促为主诉,均有组织诊断,按分期标准,Ⅱ期10例,Ⅲ期42例,Ⅳ期28例。KPS评分≥70;入组前未经过放疗、化疗和手术;体检及临床影像学检查没有发现远处转移;无恶性肿瘤病史及严重内科疾病。80例患者随机分成放疗组40人和热放组40人。
1.2 方法 放疗;放射治疗采用6MV-X射线直线加速器(山东新华600HA 型),常规分割照射,2GY/次,5次/周,总剂量60GY。临床靶区(CTV)包括:1.大体肿瘤体积(GTV):CT图像显示原发肿瘤的(左右前后)大小和转移淋巴结;2.亚临床病灶可能侵犯的范围:包括淋巴引流区,同侧肺门、对侧肺门、纵隔。热疗采用13.56MHz深部体外高频热疗机(珠海和佳医疗设备股份有限公司生产,型号HG-2000Ⅱ)50W~1000W电极,在放射后60min内进行加温,温度为42℃,每次治疗60min,每周2次。观察指标主要包括胸疼、咳嗽症状改善、近期急性反应放射损伤、1、3、5年无瘤生存率和总生存率等。
1.3 疗效及副反应评价 采用RECIST评价标准,两组患者均于治疗后2月进行胸部CT检查。完全缓解(CR):治疗后肿瘤消失,并维持4周以上;部分缓解(PR):治疗后肿瘤体积缩小50%发上,并维持4周以上;稳定(SD):治疗后肿瘤体积缩小不足50%或增大不超过25%,维持4周以上;进展(PD):治疗后肿瘤体积增大超过25%或出现新的病灶。放疗副反应采用RTOG放射损伤分级标准。
1.4 临床观察 加热过程中患者的呼吸、血压、脉搏的变化;加热区皮肤、皮下脂肪的反应;胸疼、咳嗽、血痰、气短症状的改善情况。
1.5 统计学方法 全部病例随访至2011年11月,失访2例,随访率为98%。应用SPSS 13.0统计软件建立完整数据库,运用χ2检验比较两组构成和急性毒副反应,运用U检验比较两组无瘤生存率和总生存率。检验标准P=0.05。
2 结果
2.1 局部病灶控制情况(见表1) 所有患者均在治疗后2月复查胸部CT观察局部肿物变化。热放组有效率(CR+PR)83%;放疗组有效率60%,两组比较显示:热放组对于局部病灶缓解程度明显好于单放组(P<0.05)。
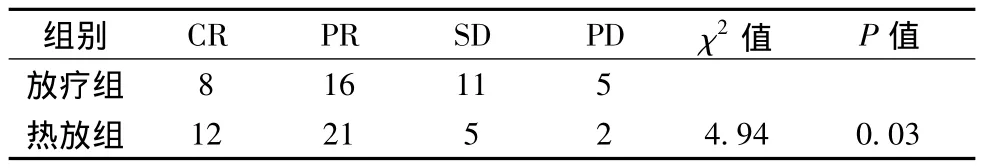
表1 两组患者局部病灶控制情况
2.2 症状改善 两组治疗后,临床症状改善比较(见表2),胸疼、咳嗽缓解率差异有显著性(P<0.05)。
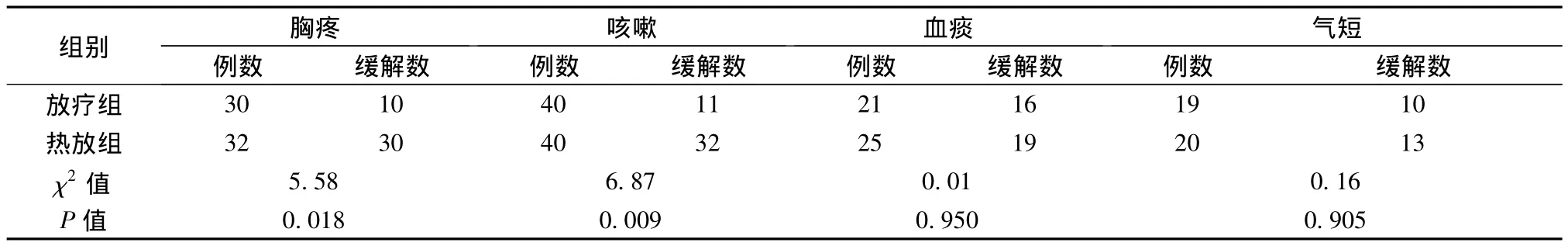
表2 两组患者临床症状改善情况
2.3 急性毒副反应(见表3) 加热过程中无患者主诉胸闷气短加重,加热前后的呼吸、血压、脉搏无明显变化。两组副反应比较差异无显著性(P>0.05)。
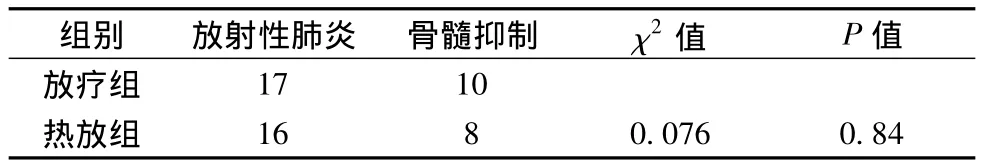
表3 两组患者主要副反应情况
2.4 无瘤生存率及总生存率 热放疗组1、3、5年无瘤生存率分别为55%(22/40)、20%(8/40)和8%(3/40),单纯放疗组分别为50%(20/40)、18%(7/40)和5%(2/40),两组比较差别无统计学意义,P>0.05。热放疗组1、3、5年总生存率分别为75%(30/40)、18%(7/40)和10%(4/40),单纯放疗组分别为70%(28/40)、15%(6/40)和8%(3/40),两组比较差别无统计学意义,P>0.05。
2.5 失败原因及并发症 失败原因为未控占13%(10/80)、复发者占45%(36/80)、远地转移者占63%(50/80)。并发症中1例出现胸壁纤维化。
3 讨论
非小细胞肺癌是我国常见的恶性肿瘤,其发病率居世界之首。放射治疗对于失去手术机会的晚期非小细胞肺癌患者是必不可少的手段,放疗直接攻击肿瘤目标。体外高频热疗是一种治疗肿瘤的新的辅助方法,通过对深部肿瘤进行加温,改变肿瘤细胞的内环境,导致肿瘤细胞死亡。
热疗联合放疗治疗恶性肿瘤的理论依据包括[6]:1.正常组织和肿瘤组织对高热的敏感性存在差异,正常组织细胞对温度的安全界值是45℃,局部可以长时间耐受42℃ ~43℃高热,而肿瘤细胞在42℃以上很快被灭活,其机制如下:直接杀瘤作用(1)高热可抑制肿瘤细胞DNA、RNA和蛋白质的合成,导致癌细胞死亡。(2)高热可引起细胞膜通透性改变,酶及细胞膜的功能障碍(能量转换、物质转运、信息传递等)。超微结构证实,癌细胞线粒体膜、溶酶体膜和内质网膜在热疗后均发生破坏,且由于溶酶体酸性水解酶的大量释放,导致胞膜破裂,胞浆外溢,癌细胞死亡。(3)高热使细胞骨架散乱,细胞功能受损,导致细胞死亡。故肿瘤细胞的热敏性高于正常细胞。2.在高热基础上42℃-45℃进行放疗,可提高放疗效果6倍,杀灭癌细胞的作用不仅与温度高低有关,也与加热持续时间有关。43℃、10Gy剂量的放射线,相当于37℃、60Gy剂量的放射线的杀癌效应。3.热疗合并放疗具有较强的协同和增敏作用:(1)处于慢性氧缺乏、营养不良和低PH值环境的肿瘤,对高热敏感,对放射线敏感性差。实体瘤中心部分的乏氧细胞对放射线不敏感,但对热疗敏感;而肿瘤周边部分的有氧细胞对放射线敏感。热疗增加了肿瘤周围及内部的血流量、肿瘤氧分压增高,从而改善了肿瘤乏氧状态,增加了放疗的敏感性。(2)S期细胞对放疗抗拒,但对热疗表现为高敏感性;而M期肿瘤细胞对放射线敏感,对高热不敏感。(3)热疗能增加瘤体内氧分压,从而提高肿瘤对放射线的敏感性。(4)热疗也可以抑制肿瘤细胞放射损伤的修复作用,主要是抑制DNA双链断裂的修复。(5)放疗可减少肿瘤细胞的热耐受性,提高热疗效果。(6)肿瘤对高热的敏感性是一致的,而放疗则肿瘤的组织学类型不同而效应不同。热疗配合放射治疗有一定的增敏作用,热疗联合放疗明显改善非小细胞肺癌的预后。
热耐受定义为第一次加热后对后继加温抗拒现象,此现象为暂时性、无遗传,一般可在48~72h后消失,以后细胞有再次对热敏感。也就是说1周热疗的次数最多为2次。热疗对肿瘤周边细胞的杀伤作用远不及肿瘤中央的杀伤作用,其治疗失败的主要原因为肿瘤周边复发;而放疗局部控制失败的主要原因为肿瘤中央的局部复发。本组失败原因为复发、转移。因此,对不能手术的非小细胞肺癌热疗配合放射治疗并不能明显改善生存,治疗策略还应辅以化疗、放射增敏治疗等。
肺癌患者的临床症状中表现最为明显的是胸疼、咳嗽、气短和血痰。本研究中两组的上述症状均有改善,热放组的临床症状改善更为明显,明显改善了患者的生活质量,其原因可能是热疗减轻了肿瘤周围组织水肿,抑制炎症介质的释放,从而症状减轻。两组放射性肺炎、骨髓抑制等副反应比较无统计学差异,说明热疗并没有增加放疗副反应。
综上所述,热疗联合放疗可使晚期非小细胞肺癌获得较好的局部病灶缓解,改善了伴随症状,提高了患者的生活质量,减轻了急性反应,能明显提高1~5年无瘤生存率和总生存率。综合治疗是肿瘤治疗的发展方向,热放疗可以克服放射治疗、热疗间的缺陷,起到优势互补、协同增敏的作用。
[1]殷蔚伯,谷铣之,主编.肿瘤放射治疗学.3版.北京:中国协和医科大学出版社,2002:437-444.
[2]彭楠,赵彼得.临床肿瘤热疗学.北京:人民军医出版社,2002.92-95.
[3]张惠洁,郭卫东,牛德森,等.中国肿瘤临床与康复,2010,17(4):299-304.
[4]Dvorak J,Zoul Z,Melichar B,et al.Pegylated liposomal doxorubicin in combination with hyperthermia in the treatment of a case of advanced hepatocellular carcinoma.J Clin Gastroenterol,2002,34(1):96-98.
[5]Van Vulpen M,Raaymakers BW,I.agendijk JJ,et al.Three-dimensional controlled interstitial hyperthermia combined with radiotherapy for locally advanced prostate carcinoma-a feasibility study.Int J Radiat Oncol Biol Phys,2002,53(1):116-126.
[6]王洪武,杨仁杰,主编.肿瘤微创治疗技术.北京:北京科学技术出版社,2007,1:356.
462400河南省漯河市舞阳县人民医院肿瘤科

