鸡传染性喉气管炎病毒(江苏株)的分离与初步鉴定
赵 妍 ,孔聪聪,张晓敏,崔红玉 ,石星明 ,蒿莲薇 ,胡顺磊 ,闫 帅 ,薛 美,牛秀杰,李巧玲,王 玫,刘胜旺,王云峰
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨 150001;
2.云南农业大学动物科学技术学院,昆明 650201)
鸡传染性喉气管炎(infectious laryngotracheitis,ILT)是由鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)引起的一种急性、高度接触性呼吸道传染病。其特征是呼吸困难,咳嗽和咳出血样渗出物,气管中上部有黄色干酪样假膜,剖检可见喉头、气管黏膜肿胀、大面积出血,最终糜烂、坏死[1,2]。自1925年美国的May等首次报道该病以来,ILT在全世界广泛流行[3]。中国在20世纪50年代末期首次报道该病发生[4],90年代开始有更多的报道[5-7]。2009年11月,江苏省某鸡场7周龄种鸡突然发生以呼吸困难为主要特征的疾病,剖检可见气管严重出血,经细菌学检查未见可疑致病菌,临床初步诊断为ILT。本研究采集病死鸡喉头气管组织进行了病毒的分离与鉴定。
1 材料与方法
1.1 病料与实验动物 病料采自江苏某养鸡场疑似感染ILT的病鸡喉头气管组织,9~11日龄SPF鸡胚、SPF鸡均由中国农业科学院哈尔滨兽医研究所提供。
1.2 主要试剂和仪器 rTaqDNA聚合酶、pMD18-T载体、DL2000 DNA Marker购自宝生物工程(大连)有限公司;基因组DNA提取试剂盒购自Tiangen公司;质粒DNA小量提取试剂盒、胶回收试剂盒购自BioFlux公司;PCR仪购自Biorad公司;低温离心机购自Thermo公司。
1.3 病毒分离 将病鸡喉头气管组织剪碎、研磨,按1:5比例加入PBS溶液,反复冻融3次,离心取上清,加入青霉素-链霉素双抗(终浓度500 U/mL),4℃作用6 h后,以鸡胚绒毛尿囊膜(chick chorioallantoic membrane,CAM)接种法,将病毒液接种于10日龄SPF鸡胚,每胚0.2 mL,同时设有阴性对照。逐日观察,弃去24 h内的死胚,连续观察5~7 d,及时收获死胚尿囊液和绒毛尿囊膜,观察并记录CAM病变及胚体情况。将收获的尿囊液和尿囊膜混合,剪碎、研磨,反复冻融3次,离心取上清,以相同方法继续传代3次,收获第4代的病毒液作为毒种,将其命名为LJS091151,分装保存于-20℃。
1.4 病毒毒价测定 将收集的第4代毒种以PBS进行10倍倍比稀释,每个稀释度接种4枚10日龄SPF鸡胚,每胚0.2 mL,每日观察记录直至d7。根据CAM病变,按Reed-Muench法计算EID50。
1.5 动物回归实验 将第4代毒种以喉内方式接种8周龄SPF鸡15只(1 mL/只)。同时设有正常对照SPF鸡10只,隔离器饲养,逐日观察记录发病情况,对发病鸡进行剖检,观察病理解剖学变化,并采集病变显著的脏器进行病理组织学切片观察。
1.6 病毒gB、TK基因扩增与分析 取200 μL收集的第4代毒种,按照基因组DNA提取试剂盒说明书进行DNA提取,同时以本实验室保存的ILTV WG株病毒液作为阳性对照,以水为阴性对照。
参考GenBank 中公布的ILTVgB基因(登录号:EU104982)、TK基因(登录号:GQ499344),在其保守区域分别设计1对引物。
gBsense: 5'-TTCCGAGATCGAAGAAGTGAG-3',gBanti-sense: 5'-ACTCTGGTGGCAAGTATCC TGT-3';
TKsense:5' -TCCGAGTTCGAGAACGATGAC-3',TKanti-sense: 5'-GAGTGGGTGCCTATCTACGA G-3′。
按照下列体系和条件进行PCR扩增:25 μL反应体系为:10×buffer 2.5 μL,dNTP 2.0 μL,sense 和 anti-sense 各 1.0 μL (10 pmoL/μL),DNA 2 μL,rTaq酶 0.2 μL,灭菌超纯水补至25 μL。反应条件:95 ℃变性5 min;94 ℃变性10 s,54 ℃退火20 s,72 ℃延伸 30 s,30个循环;72 ℃再延伸10 min;4 ℃ 10 min。反应结束后,以1%琼脂糖凝胶进行分析。将扩增获得的目的片段连接pMD18-T载体,经鉴定正确后进行序列测定与分析。
2 结果
2.1 病毒分离 经尿囊膜方式接种病料的鸡胚,在接种第2代时CAM增厚,有大小不等的白色不透明痘斑出现。与相同日龄阴性对照胚体相比,接毒胚体表面严重充血出血,胚体发育情况未见明显差异。随着传代次数增加,CAM病变越明显,并且死亡时间变短,集中于接种后的2~5 d。
2.2 病毒毒价测定 将第4代毒种进行EID50测定,结果显示,分离毒毒价为2×104EID50/0.2 mL。
2.3 分离毒回归试验 SPF鸡人工喉内接种分离毒,在攻毒后3~5 d就出现了精神沉郁、采食下降、伸颈、张口呼吸等临床症状,个别SPF鸡口腔内和粪便中均带有血丝。攻毒后10 d左右症状逐渐减轻直至消失。在临床症状最明显的时期,选取个别鸡进行剖杀,剖检可见喉头气管黏膜充血肿胀,黏液分泌情况与对照组相比明显增多,消化道空虚、黏膜充血肿胀,脾脏略肿大,胸腺有出血点等病理解剖学变化(图1)。进一步病理组织学切片结果显示,气管出现淋巴组织增生,肺脏动脉充血,副支气管有大量血液,消化道绒毛上皮脱落,脾脏白髓出现淋巴细胞坏死和胸腺淤血等病理组织学变化(图2)。
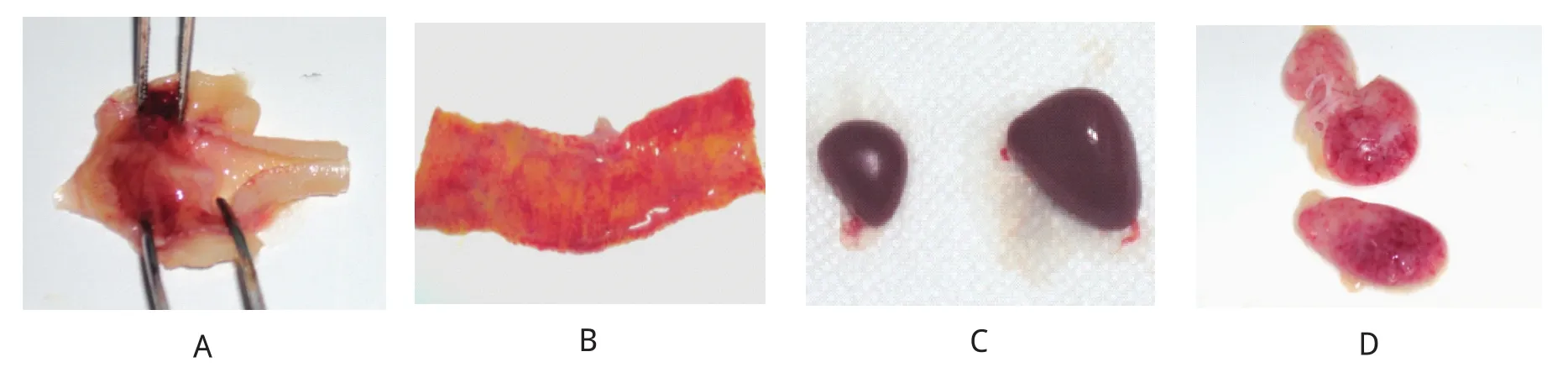
图1 SPF鸡攻毒后病理解剖学观察Fig.1 The pathological anatomy observation of SPF chicken after challenging

图2 SPF鸡攻毒后病理组织学观察Fig.2 The histopathology observation of SPF chicken after challenging
2.4 分离毒gB基因、TK基因PCR扩增与序列分析 以提取的LJS091151株基因组DNA和阴阳性对照DNA为模板,PCR扩增gB、TK基因,琼脂糖凝胶电泳结果显示扩增获得的目的条带分别为567 bp和405 bp,与预期片段大小相符(图3)。测序结果表明分离株gB和TK基因的核苷酸序列和推导的氨基酸序列与GenBank中发表的序列(详见表1)相似性分别为gB99.85%,99.46%;TK99.28%,99.22%。
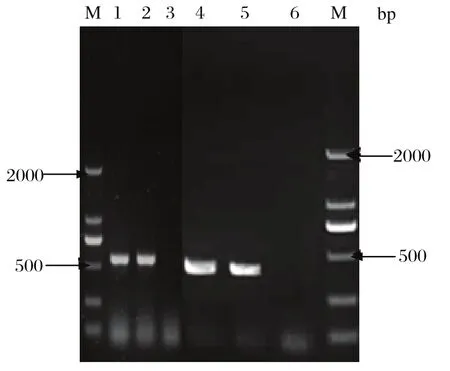
图3 gB基因、TK基因PCR扩增Fig.3 Amplif i cation of gB and TK gene

表1 GenBank中公布的ILTV gB基因、TK基因参考序列Table 1 The sequences of ILTV gB gene and TK gene in GenBank
3 讨论
自2009年以来,中国多个养殖场相继出现以眼结膜炎,呼吸极度困难,拉绿白色稀粪为特征的呼吸道疾病。该病发病急,具有较强的传染性,感染鸡群生产性能下降,病禽大多出现急性死亡,死亡率高,并突破了以往的发病季节规律性,给当地养殖户造成了极大的经济损失。
很多学者都以发病鸡的喉头、气管及其黏液等作为鸡传染性喉气管炎病毒分离的理想病料[8-10]。本研究也成功地从临床采集的疑似感染鸡传染性喉气管炎的病鸡喉头气管中分离到了病毒。通过鸡胚绒毛尿囊膜接种和动物回归实验对分离的病毒进行鉴定,结果表明,病毒接种SPF鸡胚第2代就出现了典型的痘斑;人工接种的SPF鸡在攻毒后d 3就出现了张口呼吸,口腔黏液带血丝等ILTV典型临床症状。剖检可见喉头气管黏膜充血肿胀;病理组织切片显示气管出现淋巴组织增生,肺脏动脉充血,副支气管有大量血液等病理变化。进一步的基因序列分析表明分离株gB和TK基因的核苷酸序列和推导的氨基酸序列与GenBank中发表的ILTV序列相似性均在 99%以上。综上所述,证明了本研究分离的病毒为鸡传染性喉气管炎病毒。
[1] 毕英佐.传染性候气管炎的防制[J].养禽与禽病防治,1993, 5(4): 4-5.
[2] 张德成, 陈恩义, 吴润培, 等.鸡传染性喉气管炎红细胞C_(3b)受体的变化研究[J].中国兽医杂志, 1992, 28(1):16-17.
[3] Calnk B W.禽病学[M].9版.北京: 北京农业大学出版社, 1991: 419-426.
[4] 彭连生.链霉素对鸡传染性喉气管炎的疗效观察[J].畜牧与兽医, 1960, 11(3): 117-119.
[5] 胡仁山.鸡传染性喉气管炎的诊断[J].中国兽医杂志,1992, 7(18): 9-10.
[6] 周建强, 潘琦.鸡传染性喉气管炎病毒的分离鉴定[J].中国畜禽传染病, 1995, 7(5):1-3.
[7] 何水林, 蔡玉书, 李新雨, 等.鸡传染性喉气管炎病毒的分离与鉴定[J].上海畜牧兽医通讯, 1994, 19(3): 7-9.
[8] 周建强, 潘琦, 吴敏秋, 等.鸡传染性喉气管炎病毒的分离鉴定[J].安徽农业科学, 2009, 37(26): 12572-12573,12581.
[9] 杨明凡, 崔保安, 陈红英, 等.鸡传染性喉气管炎病毒地方株的分离鉴定[J].河南农业科学, 2008, 35(11): 118-120.
[10] 陈红英, 崔保安, 李新生, 等.两株鸡传染性喉气管炎病毒的分离与鉴定[J].广东农业科学, 2007, 40(4): 76-78.

