一株新型鸭源呼肠孤病毒(TH11株)的分离与鉴定
陈宗艳,朱英奇,王世传,李传峰,李 露,王玢缤,付玉志,高景鹏,王 超,刘光清
(1.中国农业科学院上海兽医研究所,上海 200241;2.安徽省全椒县畜牧兽医局, 全椒 239500)
2011年上半年,中国太湖流域的许多养鸭场陆续发生一种新的鸭病毒性传染病,临床主要表现为发病雏鸭软脚,排白色稀粪,发病率约20%~60%,病死率在80%以上,给养鸭业造成了较为严重的经济损失。该类病例的临床病变主要为:肝脏呈土黄色,质脆,有点状、斑块状出血,或黄白色坏死灶;脾脏肿大、出血,呈暗红色,有多处大小不等的淡黄色坏死灶;其他脏器也表现出不同程度的肿大或出血等。为了查明该病的病原,我们对采集的病死鸭病料进行了病原分离和鉴定。初步研究结果表明,造成该次疫情的病原是一种不同于番鸭呼肠孤病毒的新型呼肠孤病毒。
1 材料与方法
1.1 材料 病料采集于安徽省太湖县某养鸭场;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;SPF鸭胚购自中国农业科学院哈尔滨兽医研究所实验动物中心。
1.2 试剂 Tissue DNA/RNA Kit 、PremixTaqTM(ExTaqTMVersion)、DNA Marker(DL2000)购自TaKaRa公司;DMEM细胞培养液、胎牛血清购自GBICO公司。
1.3 病毒分离 将病料剪碎,按1:5体积加生理盐水,匀浆器匀浆后反复冻融3次,10 800×g、4 ℃离心30 min,吸取上清液,0.22 μmol/L滤膜过滤除菌。取上述滤液接种按常规方法[1]制备的鸭胚成纤维细胞(Duck embryo fibroblasts, DEFs),出现病变时收集细胞液。过滤除菌的滤液同时经尿囊腔途径接种9日龄鸡胚10枚,接种量为0.2 mL/枚。接种后,置37 ℃生化培养箱恒温孵化。弃去24 h内死亡的鸡胚,每间隔12 h观察一次,收获死亡的胚体及尿囊液并记录结果。连续传3代,至该病毒致死鸡胚稳定为止。
1.4 病毒半数鸡胚致死量(ELD50)的测定 将分离株病毒悬液作10倍系列稀释,取105、106、107、108稀释度接种鸡胚,0.1 mL/个,每一稀释度接种5个鸡胚,观察记录鸡胚的死亡数,计算各稀释度的百分率。按Reed 和Muench 法计算病毒半数致死量(ELD50)[2]。
1.5 动物回归试验 1日龄健康太湖麻鸭20只,随机分为攻毒组和对照组,各16只和4只。攻毒组中8只鸭皮下注射病毒液0.5 mL,8只鸭口服病毒液0.5 mL。
1.6 电镜观察 收集病毒感染的鸡胚尿囊液, 以4℃、15 000×g离心30 min(Beckman)以除杂蛋白,上清转移至铺有蔗糖(40%,W/W;PBS 配制)垫层的离心管中,于4 ℃、45 000×g(rotor SW32 Ti, Beckman)离心3 h。超离后的沉淀用水重悬,取样使用磷钨酸负染后于JEM-1200EX电子显微镜下观察。
1.7 RT-PCR检测 按照Tissue DNA/RNA Kit说明书从细胞裂解液中提取病毒总RNA,随机引物反转录后做为模板扩增全基因。根据禽源呼肠孤病毒S2基因的部分序列设计特征性引物:上游引物P1: 5'-GCATGAACATGCCAGTTGAG-3';下游引物P2: 5'-AAGCCATAACGATGGCAGTC-3',其扩增长度为320 bp。引物由上海英骏生物公司合成。PCR 反应体系为: 2×PCRTaqMix 25 μL、上游引物(50 μmol/L)1μL、下游引物(50 μmol/L)1 μL、cDNA 模板4 μL、无菌ddH2O 19 mL,总体积为50 μL。反应条件为: 94 ℃预变性5 min ;94 ℃变性40 s ,56 ℃退火40 s,72 ℃延伸1 min,33个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳分离,用AXYGEN Gel Ext reaction Kit回收纯化后,将扩增的片段与pMD18-T载体连接,转化感受态细胞DH5α ,挑菌落PCR 鉴定,得到含目的片段的重组阳性菌株,用于测序分析。
1.8 序列测定及分析 将阳性克隆送上海桑尼工程有限公司测序,使用DNAStar、Mega4.1软件对测定的病毒核苷酸序列与GenBank中收录的禽源呼肠孤病毒的序列进行同源性比对和分析。
2 结果
2.1 病毒分离 将病毒液接入DEFs细胞,培养48 h后出现细胞堆聚,细胞核浓缩,胞间界限模糊,部分细胞脱落,有噬斑形成(图1)。培养72 h后,大部分细胞脱落。
将病毒液接种鸡胚后,鸡胚在60~84 h死亡,表现为胚胎蜷缩,体表充血、出血严重,全身弥漫针尖大小的出血点;内脏病变主要表现为肝脏肿大、质脆,出血明显,有边缘坏死灶(图2)。此外,病变呈渐进性,早期死亡胚肝脏出血比较多见,但随着死亡时间的延长,胚体肝脏出现边缘坏死增多。
2.2 病毒半数鸡胚致死量(ELD50) 分离到的毒株命名为TH11。其ELD50测定结果为:ELD50=107.1/0.2 mL。
2.3 动物回归实验 两种攻毒途径的鸭均在接毒后d 3发病,接毒后5 d内死亡,其发病率和死亡率分别为100%(8/8)和100%(8/8)。发病鸭精神萎靡,排白色稀粪。剖检发现肝脏呈土黄色,质脆,有点状或斑块状出血;脾脏肿大,呈暗红色,有多处约2 mm大小不等的淡黄色坏死点;肾脏表面出血(图3)。对照鸭无临床症状。临床自然病死鸭的临床病理变化与上述基本一致。
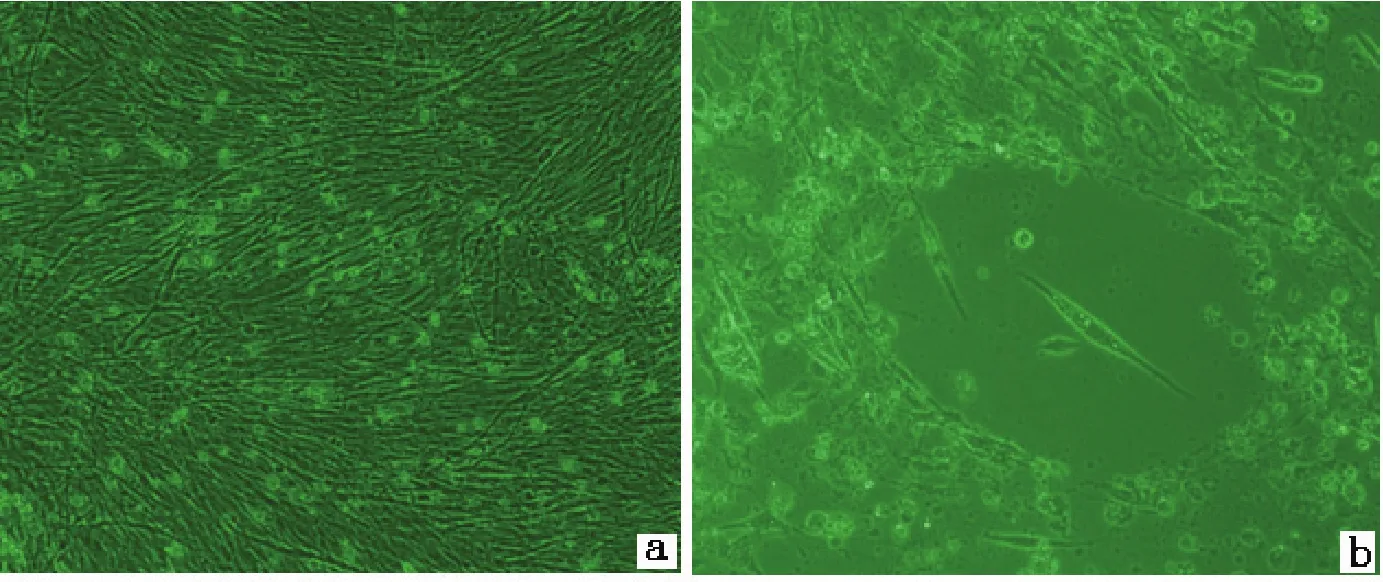
图1 分离的鸭源呼肠孤病毒TH11株引起鸭胚成纤维细胞的病变情况Fig.1 Cytopathic effect on duck embryo fi broblast induced by DRV-TH11 isolate
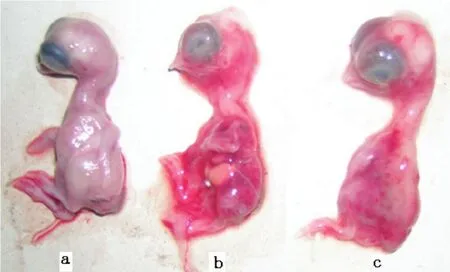
图2 DRV-TH11接种鸡胚Fig.2 Lesions of chick embryo experimentally infected with DRV-TH11
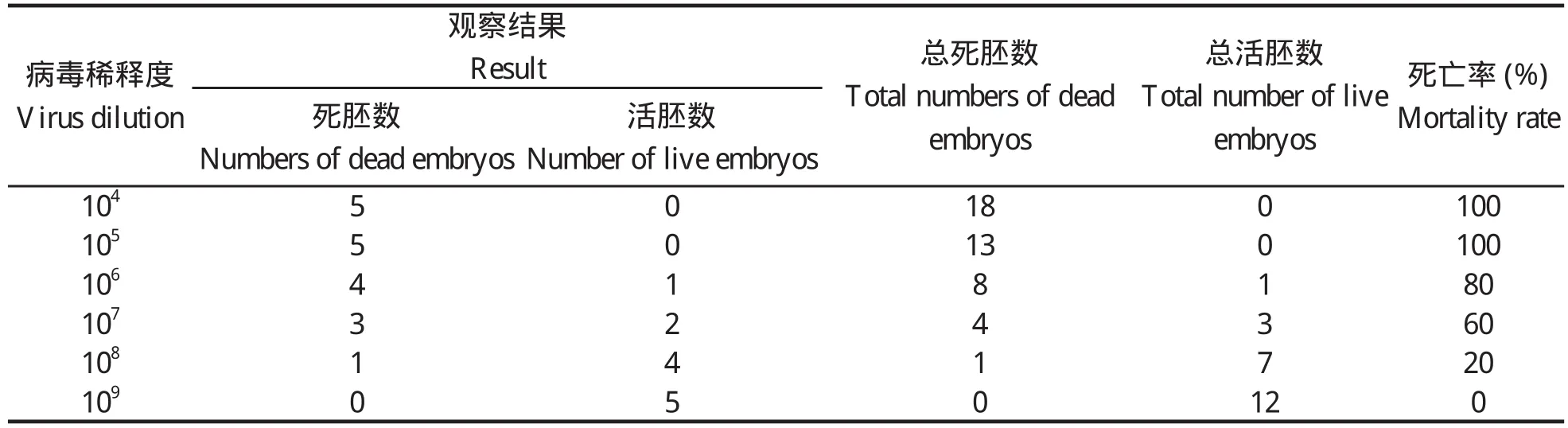
表1 DRV-TH11分离株接种鸡胚死亡率Table 1 Mortality rate of chick embryo experimentally infected with DRV-TH11 strain
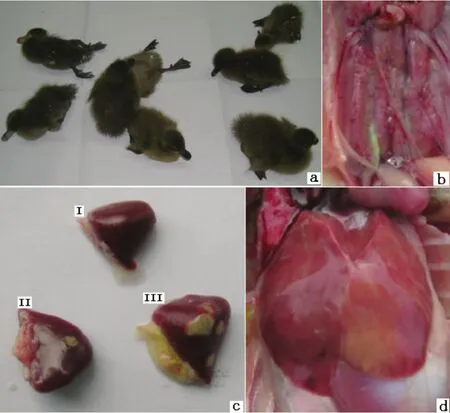
图3 动物回归实验Fig.3 Lesions of ducks experimentally infected with DRV-TH11
2.4 电镜样品的制备及观察 收集的病毒尿囊液经蔗糖垫底超速离心后,管底有沉淀聚集。使用PBS悬浮沉淀,取少量经磷钨酸负染后,电镜观察,可观察到具有典型呼肠孤病毒形态学特征的病毒颗粒(图4)。
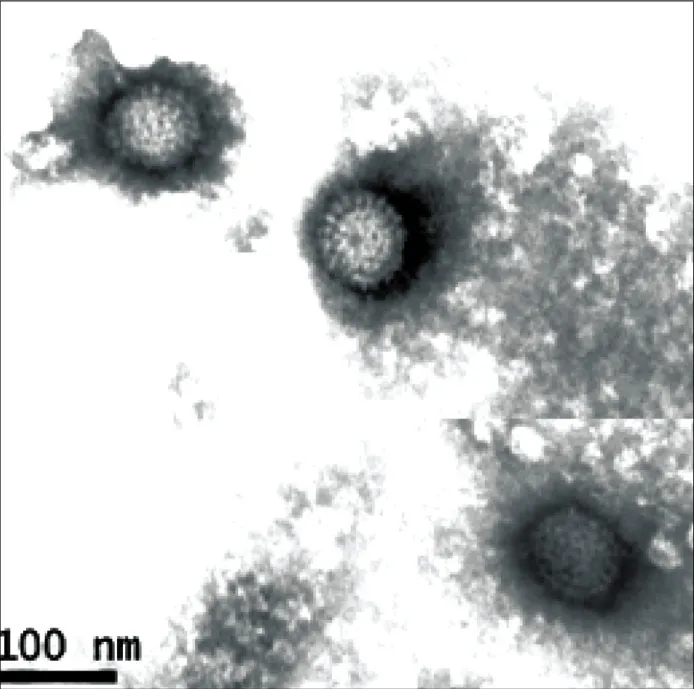
图4 电镜观察超速离心纯化的病毒粒子Fig.4 Observation of purif i ed DRV-TH11 particles by electron microscopy
2.5 基因同源性比较和进化树分析 从攻毒细胞裂解液中提取病毒RNA,用设计的特异性引物进行RT-PCR,可以获得预计大小的片段(图5)。经过序列测定和分析,获得320 bp核苷酸序列。将其与GenBank中的参考毒株DRV(JF320803)、DRV(HM591300)、DRV(FJ858376)、MDRV(AY219225)、MDRV(AY962265)、MDRV(EF076764)、MDRV(AY962259)、MDRV(AY589090)、MDRV(DQ013347)、MDRV(DQ013346)、MDRV(DQ013348)、MDRV(AJ278102) 的S2基因的部分核苷酸序列进行同源性比较,结果表明: 核苷酸序列同源性分别为 97%、96%、95%、92%、92%、92%、92%、92%、92%、92%、91%、90%。遗传进化树分析结果表明,DRV-TH11与2009年从福建分离的DRV毒株(JF320803)亲缘关系较近,而与番鸭源呼肠孤病毒亲缘关系较远(图6)。
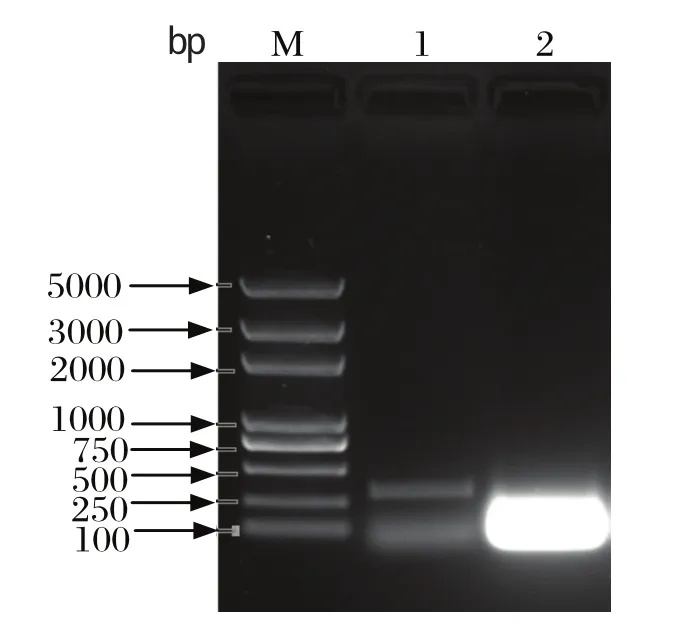
图5 RT-PCR扩增DRV-TH11Fig.5 RT-PCR amplif i ed product of DRV-TH11
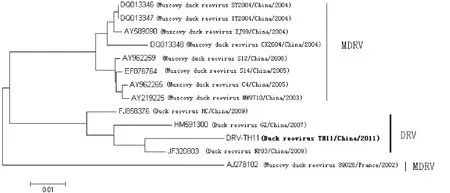
图6 DRV-TH11与其他参考毒株S2基因部分序列的遗传进化树分析Fig.6 Phylogenetic tree of partial S2 gene between DRV-TH11 and other Arian reovirns(ARV)
3 讨论
禽呼肠孤病毒(Avian reovirus,ARV)是呼肠孤病毒科、正呼肠孤病毒属的成员,为无囊膜、双股分节段的RNA 病毒。ARV呈世界性分布,可感染鸡、火鸡及其他水禽类[3-5]。胡奇林等[5]分别在福建省、广东省以肝、脾表面有大量坏死点为主要病理变化的病番鸭中分离到呼肠孤病毒,将其命名为番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)。ARV与番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV) 在致病性、抗原性、电泳图谱、病毒基因编码蛋白的顺序,以及病毒基因间的同源性方面存在着很大的差异。程安春等[7]根据“Koch假说”,认为四川省的患病鸭中存在一种新的病毒性传染病,并根据病毒的特性建议将分离毒划归呼肠孤病毒科,其名称暂定为“鸭病毒性肿头出血症病毒”(Duck viral swollenhead haemorrhagic disease virus),但未见有病毒分离报道。2008年,刘红等[8]对广东省某市一种以肿头、软脚、流泪,拉黄绿色稀便,肝出血和坏死及食道泄殖腔溃疡和结痂为主要特征的鸭病。在进行病因调查时,他们分离到多株病毒,其中包括1株呼肠孤病毒DRV-GZ 株。陈少莺等[9]从临床表现为肝脏不同程度点斑块状出血和坏死点灶为主要病变的病死雏番鸭、雏半番鸭和雏麻鸭肝脾组织中分离到呼肠孤病毒,并证明它是鸭出血性坏死性肝炎的病原。2011年,Liu等[10]从临床解剖以脾坏死为特点的北京鸭中分离到DRVHC株,其动物回归实验表明,DRV-HC在15 d内引起未能引起鸭的死亡,但能引起SPF鸡的死亡。
本研究从以脾脏坏死,肝脏点状或斑块状出血为主要特征的,临床表现为站立不稳的病死鸭中分离到鸭源呼肠孤病毒。透射电镜观察证明该病毒粒子具有呼肠孤病毒粒子的特征。经动物回归试验, 该病毒能高度致死实验感染鸭,产生与临床自然病死鸭基本一致的临床病理变化。初步表明分离毒是鸭站立不稳、脾坏死的病原。依据上述特性,认为该分离毒株有别于以往的分离株,我们将此分离毒归属于呼肠孤病毒科、正呼肠孤病毒属新型鸭呼肠孤病毒(DRV-TH11)。与经典的番鸭源呼肠孤病毒不同,本研究中分离的DRV-TH11株不仅能致死鸡胚,还可在DEFs中良好增殖。另外,与DRV-HC株相比较,DRV-TH11的致病性更强,其毒力变异的分子机制还有待于进一步研究。
为了探讨TH11株与国内、外参考毒株之间的遗传关系,我们将TH11株的S2基因部分核苷酸序列与参考毒株进行了比对和分析。结果发现,TH11株与番鸭呼肠孤病毒的同源性比较低(90%~92%),而与新近报道的麻鸭源呼肠孤病毒的同源性则较高(95%~97%)。系统发生树分析结果也显示,TH11与 新型鸭呼弧肠孤病毒(如福建分离株(JF320803))处于同一进化分支,具有较近的亲缘关系,而与早期的番鸭呼肠孤病毒则处于不同的分支,据此,我们推测当前在中国鸭群中流行鸭呼肠孤病毒病是由一种新型鸭呼肠孤病毒引起的。至于该病原是由番鸭呼肠孤病毒变异而来,还是一种新出现的病原,目前尚缺乏充分的证据。
[1] 殷震, 刘景华.动物病毒学[M].2 版.北京: 科学出版社,1997: 544-548.
[2] Reed L J, Muench H.A simple method of estimating fifty per cent endpoints[J].Am J Hyg, 1938, 27(3): 493-497.
[3] Saif Y M.禽病学[M].11 版.北京: 中国农业出版社,2005: 309-327.
[4] Benavente J, Martinez-Costas J.Avian reovirus: structure and biology[J].Virus Res, 2007, 123(2): 105-119.
[5] Heffels-Redmann U, Muller H, Kaleta E F.Structural and biological characteristics of reovirues isolated from Muscovy ducks (Cairina moschata)[J].Avian Pathol, 1992,21(3): 481-491.
[6] 胡奇林, 陈少莺, 林锋强, 等.番鸭呼肠孤病毒的鉴定[J].病毒学报, 2004, 20 (3): 242-245.
[7] 程安春, 汪铭书, 陈孝跃, 等.一种新发现的鸭病毒性肿头出血症的研究[J].中国兽医科技, 2003, 33(10): 15-21.
[8] 刘红, 郁宏伟, 朱朝辉, 等.鸭源呼肠孤病毒DRV-GZ株S2基因的序列分析及其表达[J].中国兽医科学, 2008,38(3): 224-228.
[9] 陈少莺, 陈仕龙, 林锋强, 等.一种新的鸭病(暂名鸭出血性坏死性肝炎)病原学研究初报[J].中国农学通报,2009, 25(16): 28-31.
[10] Liu Q F, Zhang G., Huang Yu,et al.Isolation and characterization of a reovirus causing spleen necrosis in Pekin ducklings[J].Vet Microbiol, 2011, 148(2-4): 200-206.

