乙型脑炎病毒NS1'蛋白移码序列的鉴定
郑 浩,童光志
(中国农业科学院上海兽医研究所,上海 200241)
乙型脑炎病毒(Japanese encephalitis virus,JEV)属黄病毒科黄病毒属(Flavivirus),同属成员还包括西尼罗河病毒(West Niles virus,WNV)、墨累谷脑炎病毒(Murray encephalitis virus,MVEV)、圣路易斯脑炎病毒(St.louis encephalitis virus,SLEV)、黄热病毒 (Yellow fever virus,YFV)、登革病毒(Dengue virus,DENV)和蜱传脑炎病毒(Tickborne encephalitis virus,TBEV)等。由于存在共同抗原,JEV与WNV、MVEV、SLEV构成黄病毒中的乙型脑炎血清群[1]。黄病毒属成员具有相同的基因组结构,对应基因编码蛋白具有相近功能[2]。
JEV基因组为单股正链RNA,长约11 kb,仅由单一开放阅读框翻译。表达的多聚蛋白在翻译中或翻译后裂解出3种结构蛋白(C、prM、E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)[2]。在JEV感染细胞中,可发现一个与NS1蛋白相关,但比NS1蛋白大的蛋白,称之为NS1'蛋白[3,4]。早期研究认为,NS1'蛋白是NS1蛋白C端在NS2A蛋白内裂解所形成的。Melian等[5]研究发现WNV可通过核糖体-1移码机制翻译出NS1′蛋白。本文根据病毒移码信号分析JEV基因组序列,并鉴定NS1'蛋白移码序列。
1 材料与方法
1.1 病毒与细胞 JEV HEN0701株分离自2007年河南地区流产猪胎儿,其基因组GenBank登录号为FJ495189[6,7]。Vero细胞以含10% FBS的DMEM培养液培养。
1.2 主要试剂和实验动物 抗JEV NS1单克隆抗体中国农业科学院哈尔宾兽医研究所华荣虹博士赠送;小量质粒提取纯化试剂盒和小量DNA片段快速回收试剂盒购自广东东胜生物技术公司;His-Bind Purification Kit为Merck产品;氟氏完全佐剂和氟氏不完全佐剂购自Sigma公司;Top10感受态细胞和BL-21感受态细胞购自天根生物技术公司;BCA蛋白浓度测定试剂盒和Western及IP细胞裂解液均为碧云天产品;LATaqDNA polymerase为大连宝生物产品;昆明小鼠购自上海斯莱克实验动物有限公司;DMEM培养基、FCS均购自Gibco公司。
1.3 NS1′移码片段的原核表达载体的构建 根据NS1与NS2编码区内移码信号及发生移码的编码框序列,设计下列引物序列:PNS1F: 5'-GAagatctA GCgctGGCccGTCTggtgatgtttctggcc-3';PNS1R: 5'-ccgctcgagTTAggatccGTGCAGGTGATGCCCCCAA GCATC-3';PNS1HF: 5'- GAagatctcatcatcatcatcatcat AGCGCTGGCCCGTCTGGTG-3'
以PNS1F和PNS1R为引物,以HEN0701的基因组cDNA克隆为模板[7],以LATaqDNA polymerase作PCR,扩增获得156 bp片段。以BglⅡ和XhoⅠ酶切回收的扩赠片段,以BamHⅠ和XhoⅠ酶切pET-28a载体,将酶切片段以T4 DNA 连接酶连接入pET-28a载体中。通过NdeI和XhoI酶切筛选,获得表达NS1'移码片段的pET1NS。以pET1NS为摸板,以PNS1F和PNS1HF为引物,PCR扩增获得His标签与NS1'移码片段融合的片段H-NS1'。以BglⅡ和XhoⅠ酶切回收的H-NS1',以BamHI和XhoⅠ酶切pET1NS。将酶切的H- NS1'片段以T4 DNA 连接酶连接入pET1NS载体中。通过NdeI和XhoI酶切筛选,获得表达2倍NS1'移码片段的pET2NS。以BamHI和XhoⅠ酶切pET2NS, 将经BglⅡ和XhoⅠ酶切的H- NS1'连接入pET2NS中,通过NdeⅠ和XhoⅠ酶切筛选,获得表达3倍NS1'移码片段的pET3NS。将pET3NS以T7 terminator primer测序。
1.4NS1'移码片段的表达与纯化 将pET3NS转化BL-21感受态细胞。挑取单菌落,接种含卡那霉素的 LB液体培养基中振荡培养过夜后,按1:100转接新的含卡那霉素液体培养基中培养至对数生长期(OD600=0.6),加入终浓度为1.0 mmoL/L的IPTG在37 ℃诱导培养4 h。以6000×g离心10 min收集菌体,并以500 μL PBS悬浮洗涤1次。将部分菌体冰浴条件下进行超声波破碎,超声5 s,间歇5 s,超声10 min,然后将破碎菌体于10 800×g离心5 min,收集上清和沉淀,将上清和未破碎菌体进行12% SDS-PAGE分析。
培养并诱导100 mL菌液,超声破碎后,参照说明书以His-Bind Purification Kit纯化目的蛋白,并用BCA蛋白浓度测定试剂盒测定蛋白浓度。
1.5 NS1′移码蛋白片段抗体的制备 将纯化的NS1'移码片段以弗氏完全佐剂乳化,免疫7 周昆明小鼠,每只小鼠接种50 μg抗原,共免疫8只。初免10 d后,以弗氏不完全佐剂乳化的NS1'移码片段进行二免,每只小鼠接种25μg抗原。二免7 d后, 采取小鼠抗血清。
1.6 免疫荧光 将HEN0701以0.5 MOI感染35 mm平皿中的Vero细胞,细胞感染后24 h,以1:400稀释的抗NS1'移码片段多抗为一抗,参照文献[8]方法进行间接免疫荧光试验。
1.7 Western blot 以 0.5 MOI的HEN0701感染 90 mm平皿中的Vero细胞,感染18 h后,弃细胞上清,并以PBS冲洗细胞1次。按“Western及IP细胞裂解液”产品说明书操作,收获细胞总蛋白。将蛋白液分装冻存于-70℃,并以BCA蛋白浓度测定试剂盒测定蛋白浓度。将变性后的总蛋白以12%SDS-PAGE进行分析。参照文献[9],分别以NS1单抗和抗NS1'移码片段多抗为一抗,进行Western blot分析。
2 结果
2.1 NS1'移码片段原核表达质粒的构建 以PNS1F-PNS1R和PNS1HF-PNS1R两对引物扩增,分别获得了假定的NS1'移码片段和His标签与NS1'移码序列融合片段。并利用BglII和BamH I同尾酶的特性,在pET-28a载体中顺向串联插入3倍NS1'移码后编码序列,获得表达质粒pET3NS。测序结果表明,获得的原核表达序列与实验设计一致。
2.2 NS1'移码片段表达与纯化 将pET3NS转化BL-21细菌,经IPTG诱导后,SDS-PAGE分析显示,菌体和上清中均存在特异蛋白片段(位于25 kDa和30 kDa间)的表达(图1)。经过纯化,蛋白显示单一条带(图2)。

图1 表达蛋白SDS-PAGE分析Fig.1 Analysis of expressed protein by SDS-PAGE

图2 表达蛋白的纯化Fig.2 Purif i cation of expressed protein
2.3 NS1′移码片段在JEV感染细胞中的表达 以NS1'移码片段多抗为一抗,对JEV感染细胞进行间接免疫荧光试验,结果如图3。JEV感染细胞呈荧光阳性反应,而对照细胞不显示荧光.这表明制备的NS1'移码片段多抗特异性识别JEV蛋白。为证实NS1'移码片段多抗是否识别NS1'蛋白,分别以NS1单抗和NS1'移码片段多抗为一抗,对JEV感染细胞总蛋白进行Western blot试验,结果如图4,以NS1单抗为一抗,Western blot呈现两条带,分别为48 kDa NS1和56 kDa的NS1',NS1与NS1'的比例为3:1,而以NS1'移码片段多抗为一抗,Western blot仅显示56 kDa的条带。上述实验结果显示,制备多抗识别NS1'蛋白, 这表明JEV病毒通过移码机制产生NS1'蛋白。
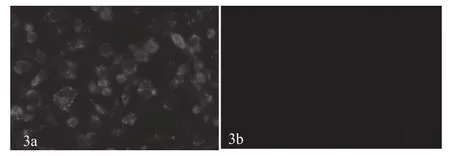
图3 表达蛋白的多克隆抗体免疫荧光试验Fig.3 IFA of the polyclonal antibodies against expressed protein
3 讨论

图4 Western blot分析JEV感染细胞总蛋白Fig.4 Analysis of the total proteins of Vero cells infected with JEV by Western blot
本文在分析NS2A编码区中核糖体移码后编码序列的基础上,并通过密码子的同义突变,合成三条引物, 将假定JEV NS1'移码片段以3倍重复克隆入pET-28a载体中,构建了原核表达质粒。 在BL-21E.coli中,3倍串联NS1'移码片段在37 ℃诱导条件下实现可溶性表达,并以纯化的NS1'移码片段免疫小鼠。经过两次免疫制备的多抗血清,可特异性识别NS1'蛋白。上述结果说明,本文表达的蛋白片段即为NS1'移码片段。
由于核糖体在JEV NS1基因3'末端移码后仅翻译45氨基酸即存在终止密码子,单独表达移码片段,则表达片段过小,不易在细菌中成功表达。因此,本文在构建移码片段原核表达质粒时,设计了3倍重复的移码片段,移码片段间以6 His连接, 构建的表达质粒在E.coli中获得良好的可溶性表达。从电泳结果看, 表达出的片段比根据氨基酸序列推测的蛋白质理论分子量(18.156 kDa)要偏大,这可能是由于表达的片段中含有3个His标签引致。His是碱性氨基酸,带有正电荷,能改变蛋白电泳时的行为,降低泳动速率,导致表观分子量偏大[10]。
核糖体移码是多顺反子mRNA在翻译过程中调控基因表达的一种重要方式。自1985年Jacks和Varmu首次证实,劳斯肉瘤病毒(Rous sarcoma virus,RSV)pol基因的表达需要核糖体在gag与pol基因连接处发生移码[11]。随后研究发现,核糖体移码是逆转录病毒(retroviruses) 表达pol基因的一种普遍现象。在多种RNA病毒、细菌噬菌体和酵母内源性病毒的基因表达中也存在核糖移码。一些细菌转座元件基因的表达及个别细菌、酵母、小鼠、大鼠等常规基因的表达中,也存在核糖体移码现象[12,13]。核糖体移码可分成+1移码和-1移码。在病毒中发生的核糖体移码多为-1移码。-1移码的机制早已明确,其典型信号包括两个mRNA元件:(1)一个滑动的七联核苷酸序列X XXY YYZ,X为任一相同的核苷酸,YYY为AAA或UUU,Z为非G的核苷酸,其中XXY、YYZ为原阅读框中的密码子,当核糖体移动到该位置时可发生滑动,改变原有阅读框,使YYY成为新阅读框密码子;(2) 滑动序列下游存在可形成假结结构的序列,假结结构具有促进移码功能。假结结构与滑动序列间距长为5~6个核苷酸。核糖体-1移码效率在1%~40%范围内,不同病毒存在差异[13]。2009年,Firth 等[14]分析认为乙型脑炎血清群黄病毒NS2A编码区内存在病毒移码信号。随后, Melian等[5]通过试验证实WNV通过核糖体-1移码机制翻译出NS1'蛋白。本文以NS1单抗和假定移码片段多抗进行的Western blot结果显示,JEV感染细胞产生NS1和NS1'蛋白, 而移码片段多抗仅识别NS1'蛋白,这表明JEV NS1'蛋白确实由核糖体-1移码机制翻译出。本文试验结果也显示,核糖体移码产生的JEV移码产物和非移码产物间的比例为1:3,则移码效率约为25%。
由于JEV基因组在翻译时发生核糖体移码产生NS1'蛋白,并导致感染细胞内非结构蛋白比结构蛋白的表达量降低。 Melian等[5]改变WNV 核糖体-1移码效率,降低NS1'蛋白表达可使WNV毒力下降,但毒力下降的机制还不明确。在逆转录病毒中,核糖体移码不仅调控表达参与病毒复制的pol蛋白,且核糖体移码调控的Gag与Gag-pol间的比例对病毒粒子的形成也具有重要影响[15]。在JEV基因组中,核糖体移码对病毒复制循环的影响尚不确定,移码产生的NS1'蛋白功能也不明确,有待深入研究。
[1] Mackenzie J S, Barrett A D T, Deubel V.The Japanese Encephalitis Virus Serological Group of Flaviviruses: a Brief Introduction to the group[J].Curr Top Microbiol Immunol, 2002, 267: 1-9.
[2] Chambers T J, Hahn C S, Galler R,et al.Flavivirus genome organization, expression and replication[J].Annu Rev Microbio, 1990, 44: 649-688.
[3] Mason P W.Maturation of Japanese encephalitis virus glycoprotein produced by infected mammalian and mosquito cells[J].Virology, 1989, 169(2): 354-364.
[4] Blitvich B J, Scanlon D, Shiell B J,et al.Identification and analysis of truncated and elongated species of the flavivirus NS1 protein[J].Virus Res, 1999, 60(1): 67-79.
[5] Melian E B, Hinzman E, Nagasaki T,et al.NS1' of Flaviviruses in the Japanese Encephalitis Virus Serogroup is a Product of Ribosomal Frameshifting and Plays a Role in Viral Neuroinvasiveness[J].J Virol, 2010, 83(4): 1641-1647.
[6] 郑浩, 张建武, 袁世山.猪源乙型脑炎病毒的分离鉴定及其E基因分析[J].中国兽医科学, 2009, 39(6): 476-481.
[7] 郑浩, 孙春清, 袁世山.猪源乙型脑炎病毒HEN071株全基因组的分子特征[J].中国兽医科学, 2011, 41(5): 441-447.
[8] Zheng H, Liu C L, Zhuang J S, Yuan S S.Baculovirus expression of cloned porcine arterivirus generates infectious particles in both insect and mammalian cells[J].J Biotechnol, 2010, 150(2): 251-258.
[9] 王斌, 华荣虹, 赵付荣, 等.抗乙型脑炎病毒非结构蛋白NS1单克隆抗体的制备与鉴定[J].中国预防兽医学报,2009, 31(1): 74-77.
[10] 唐威华, 张景六, 王宗阳, 等.SDS-PAGE法测定Histag融合蛋白分子量产生偏差的原因[J].植物生理学报,2000, 26(1): 64-68.
[11] Jacks T, Varmus H E.Expression of the Rous sarcoma virus pol gene by ribosomal frameshifting[J].Science,1985, 230(4731): 1232-1242.
[12] Brierley I.Ribosomal frameshifting on viral RNAs[J].J Gen Virol, 1995, 76(Pt8): 1885-1892.
[13] Dinman J D, Ruiz-Echevarria M J, Peltz S W.Translating old drugs into new treatments: ribosomal frameshifting as a target for antiviral agents[J].Trend Biotechnol, 1998,16(4): 190-196.
[14] Firth A E, Atkins J F.A conserved predicted pseudoknot in the NS2A-encoding sequence of West Nile and Japanese encephalitis flaviviruses suggests NS1' may derive from ribosomal frameshifting[J].Virol J, 2009, 6:14-19.
[15] Shehu-xhilaga M, Crowe S M, Mak J.Maintenance of the Gag/Gag-Pol Ratio Is Important for Human Immunodeficiency Virus Type 1 RNA Dimerization and Viral Infectivity[J].J Virol, 2001, 75(4): 1834-1841.

