传染性法氏囊病病毒的分离与鉴定
郭露铰,徐成刚,贾伟新,刘大伟,王雪洁,任 涛
(华南农业大学兽医学院 农业部新兽药创制重点开放实验室,广州 510642)
传染性法氏囊病(infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus, IBDV)引起的危害雏鸡的一种急性、高度接触性、病毒性传染病[1]。IBDV主要侵害鸡的中枢免疫器官,导致免疫抑制,从而增强机体对其他病原体的易感性[2,3]。自从1979年在北京、上海和广州等地报道该病以来[4,5],目前IBDV标准毒株、超强毒株及变异株在中国并存,导致免疫过IBDV疫苗的鸡群发病的情况经常发生,给防疫该病带来了较大的困难。
IBDV属 双RNA病 毒 科(Birnaviridae) 双RNA病毒属(Birnavirus)[6,7]。基因组包括A、B两个片段,编码VP1到VP5 五种病毒蛋白,其中由A片段编码的VP2是病毒的主要保护性抗原,与病毒中和抗体的诱导、抗原的变异以及毒力有关[8]。
通过对不同毒株VP2氨基酸序列比对发现,在VP2蛋白206~350位区域内的氨基酸变化较大,称为IBDV高变区[9]。本研究应用RT-PCR技术对近几年广东省IBDV分离株的VP2基因高变区进行扩增及测序分析,从分子水平探讨广东省IBDV分离株的流行情况,为更好地防制该病提供理论参考。
1 材料与方法
1.1 材料
1.1.1 毒株 8株IBDV分离毒为2009~2011年期间分离自广东省的传染性法氏囊病发病鸡场,具体背景见表2。
1.1.2 菌株、质粒和试剂 大肠杆菌DH5α菌株由华南农业大学兽医学院农业部动物疫病防控重点开放实验室提供;RNAiso Reagent、dNTP、SuperscriptTM RT-PCR Systems试剂盒、TaKaRa ExTaqDNA Polymerase、DNA Marker(DL 2000)等购自TaKaRa(大连)公司;DNA凝胶纯化试剂盒为天根生化科技(北京)有限公司产品;质粒抽提试剂盒为Omega Bio-Tek公司产品;琼脂糖、胰蛋白胨(Tryptone)、酵母浸出物(Yeast Extract)为OXOID产品;其他常规试剂均为国产分析纯试剂。
1.1.3 SPF鸡胚及试验动物 SPF鸡胚及试验动物购自新兴大华农禽蛋有限公司SPF实验动物中心。
1.2 方法
1.2.1 病料的采集与处理 从IBD发病鸡场的病死鸡体内采集病变严重的法氏囊组织,冻存,带回实验室,病料相关资料详见表2。
按OIE手册中诊断与疫苗标准部分关于IBDV病料处理的标准方法进行[1]:将冻存的病料融化后剪碎,放入研磨器中,加入灭菌PBS(1 g/mL)研磨(加入青链霉素,终浓度为1 mg/mL),得到悬浊液;加入等体积氯仿,在低温旋转摇床上旋转24 h(200 r/min) ;4 ℃ 1000×g离心 30 min,将上清液移入无菌的小试剂瓶中,-70 ℃保存。
1.2.2 病毒的分离与纯化 将上述处理后的病毒原液用PBS 104倍稀释后,以0.2 mL/胚接种于10 日龄SPF 鸡胚的绒毛尿囊膜中,然后置37℃恒温箱中培养,弃去24 h内的死胚,其余的继续培养至120 h后转入4℃冷冻过夜,次日收集绒毛尿囊膜并观察膜的病变情况,如此进行反复传代至第3代,收集的绒毛尿囊膜毒作为试验用种毒。
1.2.3 IBDV基因组RNA的抽提 按照TRIzol试剂说明提取病毒RNA,加入适量的DEPC处理水溶解。
1.2.4 引物的设计与合成 依据IBDV P2株A节段VP2基因的ORF序列(GenBank登录号为X84034),用Oligo6.0设计一对用于扩增分离毒株VP2基因高变区的特异性引物VP2-F 和VP2-R(VP2-F :5'-TGTAAAACGACGGCCAGTGCAT GCGGTATGTGAGGCTTGGTGAC-3' ; VP2-R :5'-CAGGAAACAGCTATGACCGAATTCGATCCT GTTGCCACTCTTTC- 3'),预计扩增片段600 bp左右,引物由英俊生物技术有限公司(Invitrogen)合成。
1.2.5 病毒的RT-PCR扩增 按照TaKaRa公司AMV反转录酶产品说明书进行VP2基因的反转录。在20 μL反应体系中加入以下各组分:病毒总RNA溶液9.5 μL、20 pmol/μL随机引物(R:O)1.0 μL、RNA 酶 抑 制 剂(40 U/μL)0.5 μL、5×RTase M-MLV Buffer 4.0μL,dNTPs(2.5mmol/L)4.0μL、AMV 1.0 μL,瞬时离心混匀,室温静置10 min后置42 ℃水浴锅中温育1 h,然后立即冰浴3 min 用于VP2基因的PCR 扩增。
在25 μL 的PCR 体系中加入以下各组分:10×ExTaqTMBuffer 2.5 μL、dNTPs (2.5 mmol/L) 2.0 μL、模板(RT product)1.0 μL、上游引物 OIE-F(20 pmol/μL) 0.5 μL、 下 游 引 物 OIER(20pmol/μL) 0.5 μL、去离子水 18 μL,瞬时离心混匀,然后进行以下程序:94℃预变性3 min;94 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 30 s,循环29次;最后72 ℃延伸10 min。反应结束后,用1×TAE缓冲液配制1.0%的琼脂糖凝胶,加入EB至终浓度为0.5 μg/mL。取5 μL的PCR产物检测是否扩增出VP2基因片段。
1.2.6 目的基因的克隆 将扩增的PCR产物通过1%琼脂糖凝胶电泳回收目的条带进行抽提、纯化,将纯化后的PCR产物与pMD18-T按要求进行连接,连接产物按常规方法转化至DH5α感受态菌中,挑取生长良好的菌落接种于LB培养基中(含AMP+50 mg/L),扩增培养,按碱裂解法提取质粒,以备进行PCR鉴定。
1.2.7 重组质粒的鉴定 将筛选的阳性重组质粒作为模板,应用相同的引物进行PCR扩增,扩增产物通过琼脂糖凝胶进行电泳检测。
1.2.8 VP2基因的核苷酸序列测定和遗传进化分析 经PCR鉴定均为阳性的重组质粒由上海Invitrogen公司进行序列测定。根据IBDV分离毒株及参考毒株的VP2高变区核苷酸序列(435 bp)用MEGA4.0软件中的N-J法构建的遗传进化,bootstrap为1000次。所用参考毒株名称及其 GenBank登 录 号 如 下:OKYM(D49706)、UK661(X92760) 、Harbin(AY321955)、GHUT-12(DQ778035)、CJ801(AF416621)、P3009(AF109154)、GZ29112(AF051837)、BK912(AF416620)、B87(DQ202329)、D78(AF499929)、Cu-1M(AF362771)、23-82(AF362773)、OH(M66722)。
1.2.9 病毒ELD50测定 用灭菌PBS将病毒液稀释成10-1、10-2、10-3、10-4和10-5等5个不同稀释度,每个稀释度通过绒毛尿囊膜接种6枚8日龄SPF鸡胚,同时设阴性对照组。试验结束后按Reed-Muench法计算分离病毒的ELD50。
1.2.10 对SPF鸡致死率的测定 将10羽3周龄SPF鸡以滴鼻、点眼途径攻毒,剂量为10ELD50/0.2 mL,同时设阴性对照,攻毒后连续观察直至无死亡鸡出现为止(连续观察2周),记录死亡情况,并计算病毒对SPF鸡的致死率。
2 结果
2.1 分离毒株的RT-PCR鉴定结果 取5 μL RTPCR产物用0.8%琼脂糖凝胶电泳进行检测,结果如图1所示(略去毒株名称),与预期结果相符。
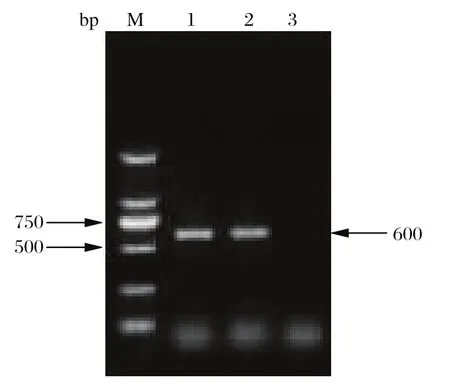
图1 PCR产物凝胶电泳图Fig.1 PCR amplif i cation of IBDV isolates
2.2 8株IBDV地方分离株VP2基因推导的氨基酸分析 对8株IBDV地方分离株VP2基因推导的氨基酸序列进行分析,与超强毒株特征性氨基酸位点进行比较,结果如表1。据其他研究报道[10],超强毒株VP2高变区氨基酸残基具有3个典型的特征:(1)249和254位的氨基酸分别为Q和G;(2)保守的SWSGSAS七肽区,且279和284位分别为D和A,而非N和T,这是IBDV毒株具有高致病性的必要条件;(3)222、294和299位具有3个特征性氨基酸,分别为A、I和S。

表1 IBDV特征性氨基酸位点比对Table1 Sequence analysis of hypervariable region of VP2 amino acid sequences among different strains of IBDV
2.3 8株IBDV地方分离株VP2基因系统进化树分析 利用8个IBDV地方分离株和13个参考毒株VP2基因高变区核苷酸序列绘制的IBDV系统发育进化树见图2。由图2可以看出,8株分离毒和4个超强毒参考株(UK661、Harbin、OKYM及GHUT-12)在系统发育进化树中共同形成一个大的分支。
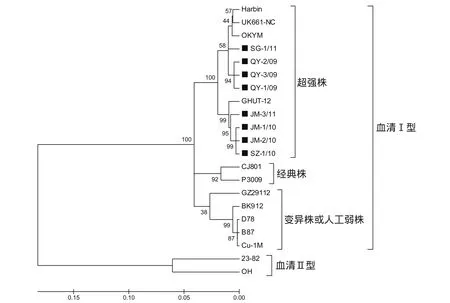
图2 根据VP2基因高变区核苷酸序列(435 bp)构建的IBDV遗传进化树Fig.2 Phylogenitic tree based on VP2 high variable region(HVR) of IBDVs
2.4 ELD50及对SPF鸡致死率的测定结果 病毒的ELD50及其对SPF鸡的致死率测定结果如表2所示。人工接种SPF鸡胚绒毛尿囊膜后,8个IBDV分离株均可在SPF鸡胚上复制并使鸡胚致死,但ELD50呈现一定程度的差异。人工感染SPF鸡后,8个分离株对SPF鸡的致死率均达到60.0%以上,SG-1/11株对SPF鸡的致死率更是达到了100%,这几个毒株均称为超强毒。
3 讨论
IBD是一种重要的鸡免疫抑制性传染病,免疫接种是预防和控制该病的重要手段。近年来,变异株和超强毒株的出现导致IBD频频发生,对养鸡业的危害极大。根据SPF鸡的致死率和病毒中和试验可将血清I型的IBDV分为vvIBDV、经典毒株和变异毒株。其中超强毒株的致死率很高,但与经典毒株相比较抗原性却无差异,常用的血清学手段很难鉴定区分二者,因此利用分子生物学对IBDV分离株进行分群具有非常种要意义。另外,通过对IBDV的系统进化分析,找出毒株的起源与进化关系,可为防控IBD的发生提供依据。
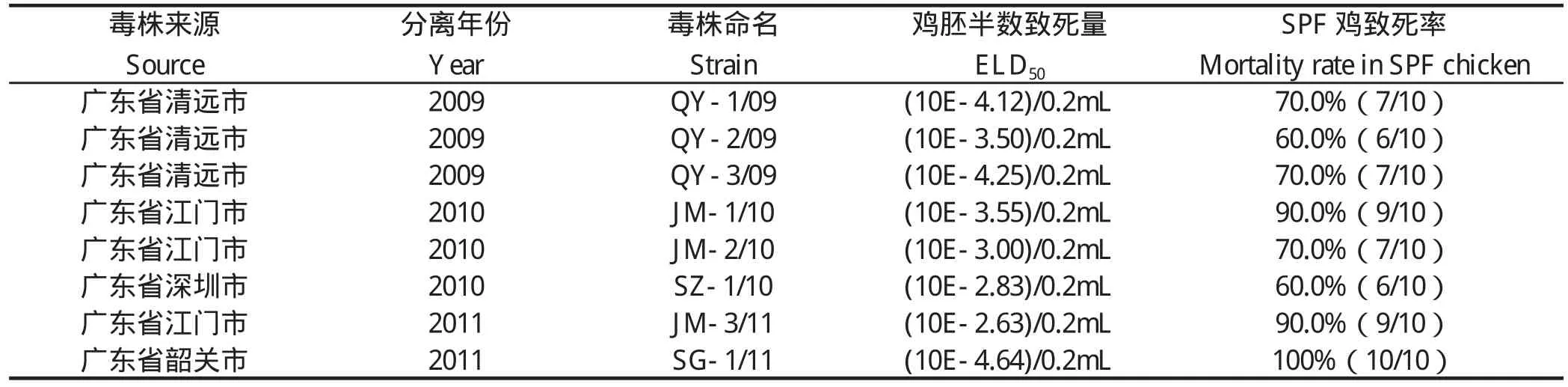
表2 病料及病毒情况Table2 Biological characteristic of different strains
目前对IBDV分子流行病学研究集中在该病毒VP2基因的高变区,VP2基因与病毒中和抗体的诱导、抗原的变异以及毒力有关[8],VP2高变区氨基酸变化较大,因此对该区域的分子特征进行研究不仅可以发现IBDV的抗原性变化,还可提供IBDV毒株遗传进化信息。
IBDV毒力变异的分子机制较为复杂,曾经认为VP2高变区内富含S的七肽区SWSASGS是IBDV毒力的标志。1996年,Yamiguchi等[10]发现将超强毒OKYM株的I256突变为T后,毒力变弱,从而开始了IBDV其他毒力位点的研究。279位和284位的氨基酸被认为是区分强弱毒株的关键。强毒株在279位和284位分别是D和A,而弱毒株分别为N和T。这些位点可能导致毒力的变化,但未必是决定因素,IBDV的毒力应是由多因子共同决定的。
本研究应用RT-PCR方法扩增了8株分离自广东省不同地区的IBDV的VP2基因高变区,通过推导的氨基酸序列分析显示,JM-1/10、JM-2/10、SZ-1/10、JM-3/11和SG-1/11分离株的7个特征性氨基酸位点以及富含丝氨酸的七肽区均与vvIBDV完全一致。而QY-1/09、QY-2/09、QY-3/09在254及279位存在一到两个突变,但是G、D、S、N均属于亲水性氨基酸的替换,并不会改变相关区域的亲水性,不影响其成为强毒株[11]。另外通过与13个参考株同源性比较可以看出,这8个分离株与4个超强毒株同源性较高,在95.1%~99.5%之间,在IBDV系统发育进化树中共同形成一个大的分支。说明当前在广东省引起鸡传染性法氏囊病的主要毒株类型多为超强毒IBDV。
本次分离的8株病毒对3周龄SPF鸡的致死率均在60.0%以上,有些甚至达到100%的死亡,与遗传进化分析一致,符合超强毒株的特性。超强毒株的出现,给IBD的免疫带来了困难。近几年IBD疫苗免疫失败的情况屡屡发生,除免疫不合理外,抗原变异和毒力增强都可能导致免疫失败。传统的经典Ⅰ型疫苗是否能提供较好的保护效果,尚需进一步研究证实。
[1] 卡尔尼克B W.禽病学[M].9版.高福, 刘文军,译.北京: 北京农业大学出版社, 1991.
[2] Wang Z C, Wang Y S, Tang Y D,et al.Development of the detection system for infectious bursal disease virus[J].Chin J Vet Sci, 2008, 28(9): 1015-1019.
[3] Qi X L, Wang X M, Gao Y L,et al.Progress in research about Vp2 protein of infectious bursal disease virus[J].Chin J Pre Vet Med, 2008, 30(8): 656-660.
[4] 周蛟, 刘福致, 陈丽勇.北京地区鸡传染性法氏囊病病原分离[J].中国兽医杂志, 1982, 18(7): 25-26.
[5] 毕英佐.广东地区鸡传染性法氏囊病的研究[J].华南农业大学报, 1985, 7(1): 46-59.
[6] Dobos P, Hill B J, Hallett R,et al.Biophysical and biochemical characterization of five animal viruses with bisegmented double-stranded RNA genomes[J].J Virol,1979, 32(2): 593-605.
[7] Kibenge F S, Dhillon A S, and Russell R G.Growth of serotypes I and II and variant strains of infectious bursal disease virus in Vero cells[J].Avian Dis, 1988, 32: 298-303.
[8] Mundt E.Tissue culture infectivity of different strains of infectious bursl disease virus if determined by distinct amino acids in VP2[J].J Gen Virol, 1999, 80: 2067-2076.
[9] Azad A A, Barrett S A, and Fahey K J.The characterization and molecular cloning of the double-stranded RNA genome of an Australian strain of infectious bursal disease virus[J].Virology, 1985, 143(1): 35-44.
[10] Yamaguchi T, Ogawa M, Miyoshi M,et al.Identification of sequence changes responsible for the attenuation of highly virulent infectious bursal disease virus[J].Virology,1996, 223(1): 219-223.
[11] 易道生, 张倩, 李楠, 等.鸡传染性法氏囊病毒江苏地方株的分离及其VP2基因分析[J].畜牧与兽医, 2008,40(10): 63-67.

