猪源牛病毒性腹泻病毒SD0803株细胞传代研究
孙春清,邓 宇,2,张宏彪,3,龙进学,韦祖樟,童光志,袁世山
(1.中国农业科学院上海兽医研究所,上海 200241;2.西昌学院动物科学学院,西昌 615000;3.南京农业大学动物医学院,南京 210095)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)与猪瘟病毒(Hog cholera virus, HCV)、羊边界病病毒(Border disease virus,BDV)同属于黄病毒科(Flaviviridae)、瘟病毒属(Pestivirus)的成员[1],分为两个基因型,即BVDV-Ⅰ和BVDV-Ⅱ。BVDV 最早由Olafon等报道于美国[2],现在已经遍布于世界各国,但是BVDV-Ⅱ的报道较晚,最早报道见于20世纪80年代晚期一次北美急性爆发[3],随后在南美洲、德国、比利时,意大利、澳大利亚、日本、韩国和印度等国均有该病的报道[4-6]。BVDV能引起感染动物产生一系列复杂的临床症状,包括腹泻、粘膜病、持续感染与免疫耐受、繁殖障碍、血小板减少与出血综合征等。BVDV除引起牛病毒性腹泻,急、慢性粘膜病,免疫耐受和持续性感染,免疫抑制,母畜流产、早产、死胎外,还可引起羊、鹿和猪等动物感染发病。猪感染BVDV可出现类似于猪瘟的临床症状和病理变化[7-10],已逐渐引起许多国家,尤其是已经消灭或控制了猪瘟国家的关注。
BVDV在猪群中流行广泛。据报道,澳大利亚、爱尔兰、德国等国家猪群中BVDV抗体的阳性率达3%~40%,荷兰达15%~20%[11,12]。王新平等[13]于1996年首次从疑似猪瘟病料中检出BVDV。2008年宋永峰等[14]利用PCR方法检测了浙江、安徽、湖南、江西、广西、辽宁等省的43份猪病料,阳性率为16.3%。母猪感染BVDV会导致繁殖障碍、产仔数下降和流产;先天性感染的仔猪出生后可产生BVDV抗体,会形成持续性感染和免疫耐受,可长期带毒、并且可将BVDV传播给易感的母猪[10]。目前该病毒对猪体的危害及致病机理尚不明确,尚需进一步研究。在本次研究中,将已分离到的BVDV-1型SD0803毒株在MDBK细胞上连续传40代,为研制猪源BVDV疫苗做好了物质储备,为进一步研究其致病性和抗原性奠定基础。
1 材料与方法
1.1 病毒 BVDV SD0803毒株为2008年8月从山东某猪场疑似猪瘟发病仔猪的全血、肾脏、肝脏、淋巴结、脾脏等样品中研磨分离得到,鉴定为非致病型 BVDV-Ⅰ[15]。
1.2 细胞和主要试剂 MDBK细胞,购于美国 ATCC(American type culture collection,ATCC),经本实验室建立的套式PCR检测为BVDV阴性。细胞培养液为含10%马血清的1640培养基,维持液为含2%马血清的1640培养基,病毒稀释液为无血清的1640培养基。QIAGEN cador BVDV Type 1/2 RT-PCR Kit购自QIAGEN公司;Reverse Transcriptase XL、dNTP购自TaKaRa公司;pGEM-T载体、病毒RNA提取试剂盒、Top10感受态细胞、T4 DNA Ligase购自天根生化科技(北京)有限公司;DNA片段胶回收试剂盒、质粒提取试剂盒购自东盛科技股份有限公司;马血清、PBS购自Gibco公司,RPMI-1640培养基购自Hyclone公司,三者经检测BVDV抗原抗体均呈阴性;抗BVDV E2单克隆抗体为军事医学科学院军事兽医研究所涂长春教授惠赠;TOPO载体、羊抗鼠二抗购自Invitrogen公司。
1.3 SD0803病毒在MDBK细胞上的培养与传代用含10%马血清的1640细胞培养液培养MDBK细胞,按1:5传代,待细胞长满单层后,将SD0803病毒原液按1:10稀释接种,每个25 cm2细胞培养瓶接种300 μL稀释后的毒液,于5% CO2、37 ℃细胞培养箱中孵育1.5 h后换液,用含2%马血清的1640培养液维持生长,培养60 h后收取细胞上清,并以同样的方法传下一代,将病毒传至第40代,将收取的第1、10、20、30、40代细胞上清保存于-70℃备用。
1.4 套式PCR 根据已发表的BVDV SD0803毒株全序列,选择BVDV变异性较大的E2结构蛋白区域[16],利用Premier 5软件设计合成两对特异性引物,由上海杰李生物技术公司合成。引物序列见表1。取250 μL病毒液,按天根病毒RNA提取试剂盒上的方法提取病毒RNA。随后进行cDNA的合成,在RT反应体系中加入1 μL第一轮扩增的下游引物、4 μL 5×AMV buffer、2 μL 10 mmol/l dNTPs、1 μL RNAsafe 、1μL AMV(10U,TaKaRa)、11μL RNA提取液,总体积20 μL。42 ℃温浴l h,在冰水中冷却2 min,-20℃保存。合成cDNA后,接着进行PCR扩增。反应体系:5 μL 10×PCR bufer、5 μL dNTP、上游下游引物各1 μL、cDNA模板2 μL、LATaq酶1 μL,用灭菌ddH2O补至总体积50 μL,于PCR仪上进行扩增。第一轮PCR反应:95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;第二轮PCR反应:95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 30 s,35个循环。
1.5 间接免疫荧光检测(indirect immunofluorescence assay, IFA) 按1.3中所述将第10、20、30和40代病毒分别感染MDBK细胞,60 h后用冰甲醇固定细胞,室温作用10 min;用PBS洗细胞2遍,加入适量1:100稀释的抗BVDV E2单克隆抗体,室温作用1.5 h;再用PBS洗2遍,再加入适量1:800稀释的的二抗(绿色荧光标记的羊抗鼠二抗)室温作用1 h;PBS洗3遍,然后在细胞孔中加入PBS溶液。置于荧光显微镜下观察结果,并拍照保存。
1.6 SD0803第40代毒株病毒全长基因组的扩增与克隆 根据BVDV SD0803亲本序列利用Premier 5软件设计合成5对特异性引物,每对引物扩增的片段与下一段均有重叠,由上海杰李生物技术公司合成。引物序列见表1。取250 μL病毒液,按天根病毒RNA提取试剂盒上的方法提取病毒RNA。
将提取的RNA反转录成cDNA,其体系:1 μL第一轮扩增的下游引物、4 μL 5×AMV buffer、2 μL 10 mmol/L dNTPs、1 μL RNAsafe 、1 μL AMV(10U, TaKaRa)、1 μL RNA提取液,42 ℃温浴l h,在冰水中冷却2 min。以反转录得到的cDNA片段为模板进行PCR反应,在反应体系中依次加入5 μL 10×PCR bufer、5 μL dNTPs、上游下游引物各1μL、cDNA模板2 μL、pfuⅡ高保真酶1μL,用灭菌ddH2O补至总体积50 μL,于PCR仪上进行扩增。第一段产物:95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;第二段产物:95 ℃变性 30 s,59 ℃退火 30 s,72 ℃延伸 1 min 30 s,35个循环;第三段产物:95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;第四段产物:95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸 1 min 30 s,35个循环;第五段产物:9 5℃变性30 s,58 ℃退火30 s,72℃延伸1min,35个循环。将扩增片段用东盛试剂盒纯化回收后,与TOPO载体连接,构建载体与片段的重组质粒,按常规方法提取质粒,将阳性克隆送上海杰李生物技术公司测序。
利用DNASTAR软件对测序结果进行分析,并用SeqMan软件拼接全长序列,将拼接序列与亲代病毒比对分析。
1.7 用Real-time PCR进行病毒定量及病毒多步生长曲线的绘制
1.7.1 构建并稀释质粒标准品 按照QIAGEN cador BVDV Type 1/2 RT-PCR Kit说明书中反应体系和反应条件,对BVDV-Ⅰ型阳性对照进行Real-time PCR,回收扩增产物,克隆到pGEM-T载体,并进行序列测定。将所得阳性质粒测浓度,按倍比梯度稀释方法获得标准品。
1.7.2 绝对定量PCR法定量各代次病毒RNA拷贝数 以1.7.1制备的质粒为标准品,进行荧光定量PCR反应,定量 P1、P10、P20、P30、P40代病毒RNA的拷贝数,拷贝数的计算公式如下:样本分子量=碱基数×324,待测样本拷贝数(copies/μL)=待测样本浓度/样本分子量×6×1014。
1.7.3 生长曲线的绘制 根据定量结果,P1、P10、P20、P30、P40代病毒以相同低感染剂量(0.1 MOI)接种MDBK细胞,分别在不同的时间段(0、12 、24 、36 、48 、60 、72 、84 、96 、108 、120h)收取200 μL细胞上清,同时补充培养基,收取的上清在-70℃冻存,在收取完后提取细胞上清中病毒总RNA,按照QIAGEN cador BVDV Type 1/2 RT-PCR Kit说明书中反应体系和反应条件进行绝对定量PCR反应,利用7500 System Software软件,计算各代次病毒的RNA拷贝数,并绘制生长曲线。
2 结果
2.1 病毒传代及鉴定结果 为了研究BVDV在MDBK 细胞中的生长特性,将以前分离获得的SD0803株作为亲本毒株在MDBK细胞连续传代,每十代建立病毒种(stock),并通过套式PCR和IFA方法鉴定病毒的复制效率。套式PCR产物的电泳结果显示为1400 bp的目的片段(图1),与预期大小一致,测序结果也证实该片段为BVDV E2区域片段。IFA结果发现,病毒传代的细胞内(10、20、30和40代)可观察到特异绿色荧光(图2)。两者均表明病毒在MDBK细胞上能够持续传代。
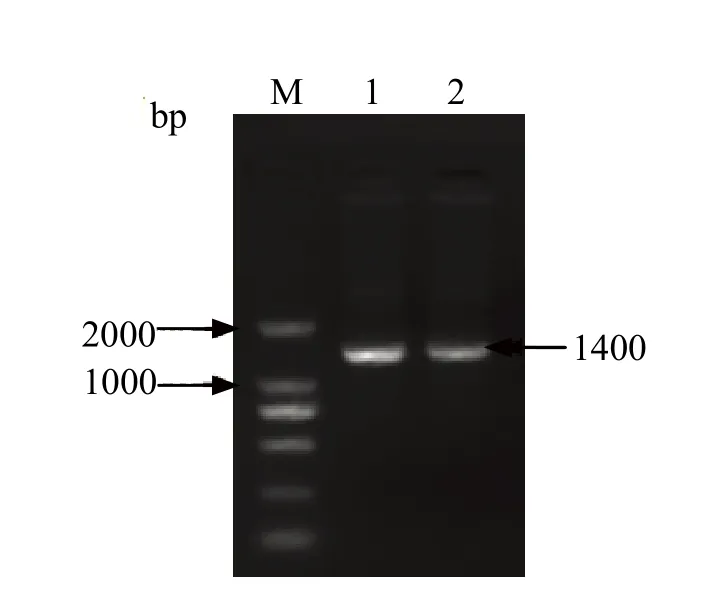
图1 第20代和40代病毒基因组套式PCR电泳图Fig.1 Nested-PCR products of P20 and P40 virus
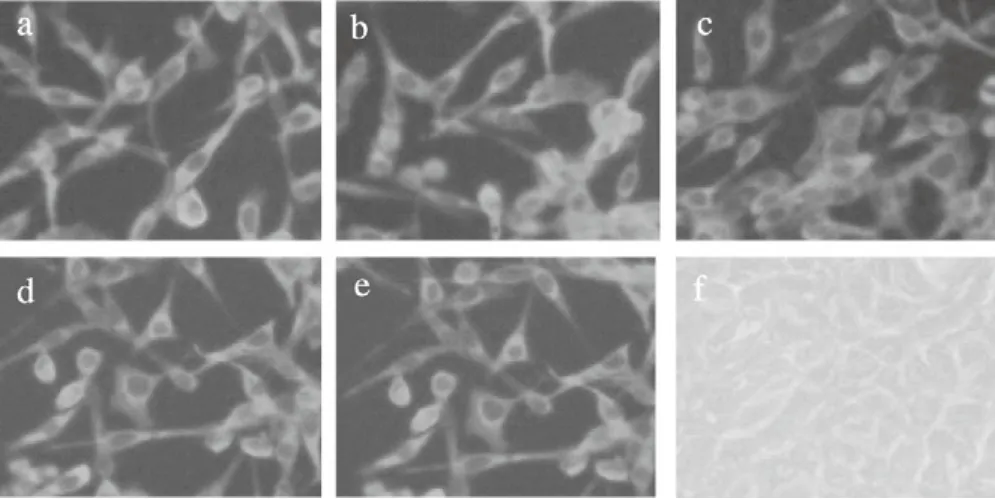
图2 亲代病毒、P1、P10、P20、P30、P40传代病毒的IFA鉴定(100×)Fig.2 IFA results of MDBK cells infected with parental virus, P10, P20, P30 and P40, respectively(100×)
2.2 病毒多步生长曲线的绘制 为了鉴定传代病毒(10、20、30和40代)在传代细胞中的复制效率,将各代次的传代病毒分别接种MDBK细胞,分时段收取上清,用qRT-PCR的方法鉴定各个时段(12、24、48、72、96 h)细胞上清中病毒基因组RNA拷贝数,并绘制多步生长曲线。如图3所示,各个代次的病毒有着相似的生长特性,并在培养48 h达到繁殖高峰,48 h后进入平稳期,第1、10代病毒毒力稍较低,20、30、40代毒株复制效率基本一致。说明病毒传代过程中生长特性没有改变,适应在MDBK细胞中繁殖。
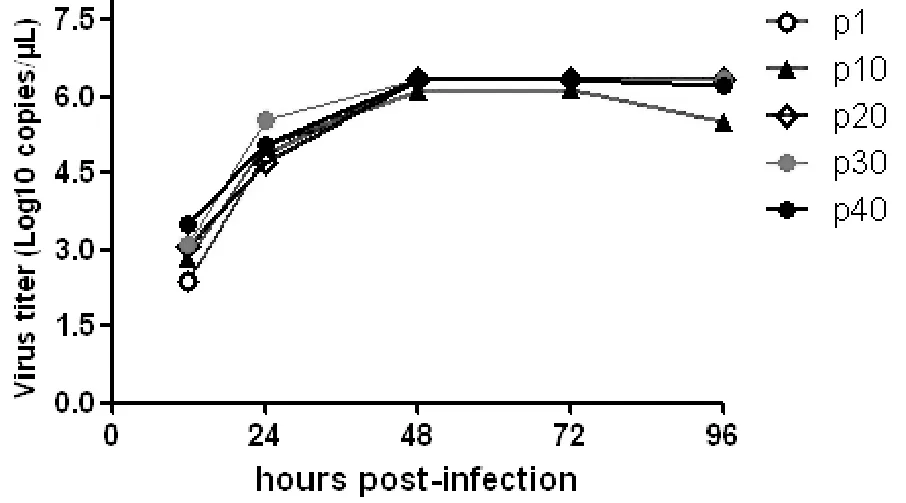
图3 SD0803 P1、P10、P20、P30和P40病毒多步生长曲线Fig.3 Multi-step growth curves of SD0803 P1, P10, P20, P30 and P40
2.3 SD0803 P40毒株病毒基因组的全长扩增及序列比对分析 为了确定BVDV细胞适应株的基因组序列,通过分段扩增克隆和测序对全长基因组进行序列分析。通过设计5对引物,如图4所示,分五段扩增BVDV P40全长基因组,得到的RT-PCR产物长度依次为2713 bp、3987 bp、2074 bp、3577 bp和2078 bp。将PCR产物进行回收、纯化,并克隆到pCR-TOPO载体中,利用表1 的测序引物和载体通用引物将克隆进行正反向测序,根据各扩增片段的重叠序列利用DNAstar软件对序列拼接,获得BVDV P40的全长基因组序列。
通过DNAstar软件对SD0803 P40代与亲代病毒两者核苷酸及氨基酸同源性比较,我们发现核苷酸序列的同源性为99.8%,氨基酸序列的同源性为99.6%。共有23个核苷酸发生突变,其中14个为有义突变且对应12个氨基酸突变,主要集中在E2和NS5B区域:2个突变位于E1,3个突变位于E2,3个位于NS2-3,2个位于NS5A,4个位于NS5B。传代过程中非结构蛋白NS2~3区没有外源序列的插入,3'UTR和5'UTR均未发生碱基序列的缺失、插入及突变(表2、表3)。说明病毒适应细胞繁殖的过程中,病毒的基因组也发生了一些变异。
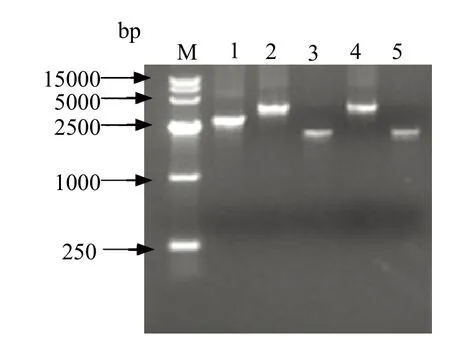
图4 分5段扩增第40代病毒全长基因组Fig.4 PCR products of P40 full-length genome
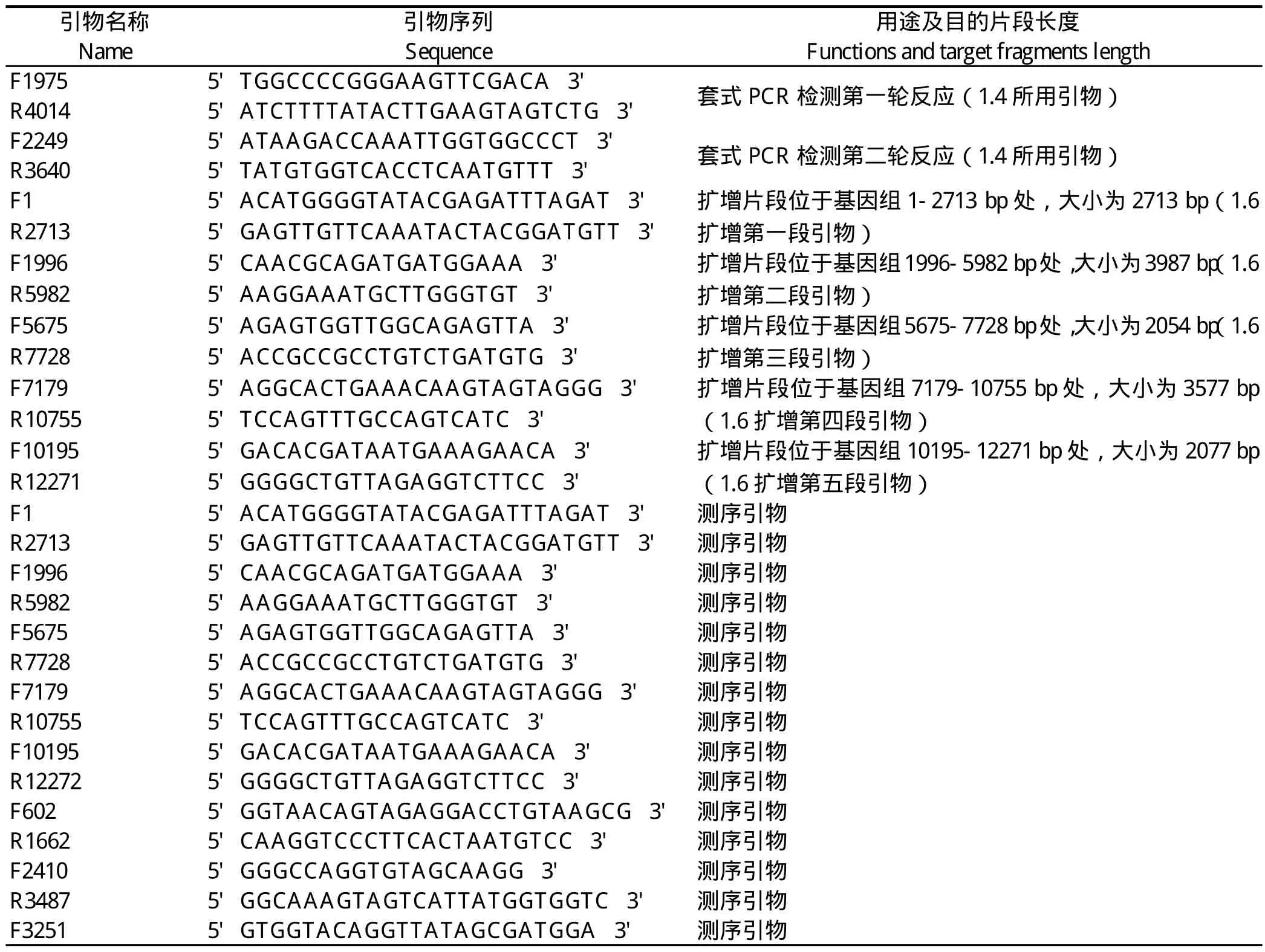
表1 测序及PCR引物Table 1 Primers used for PCR amplif i cation and sequencing

(续表)
3 讨论
猪感染BVDV已经引起有关国家,尤其是已经消灭或控制了猪瘟的国家的关注。由于在中国该病发病并不高,且多伴有持续感染和免疫耐受等隐性感染,因此一直未引起养猪场对该病防治的重视。该病可通过牛血清传染,所以存在疫苗污染问题。我国目前还没有对应的BVDV疫苗应用,曾经用Oregon C 弱毒株和猪瘟兔化弱毒疫苗进行免疫预防该病,取得了一定的效果,但弱毒疫苗的安全性问题仍不明确,因此并没有推广。从畜群中分离出优秀的候选毒株用于疫苗研制,对于BVDV的防控是一个有效的途径之一。
本研究中将本实验室分离的BVDV-Ⅰ型毒株SD0803在MDBK细胞上连续传代40代,让其在细胞上适应性生长,并对传代病毒的生物学特性进行研究。为确保病毒在细胞上的连续传代,采用套式PCR 检测P20、P40细胞上清中的病毒核酸及IFA方法检测P10、P20、P30、P40细胞中的病毒蛋白,结果均表明病毒在能细胞上连续传代。
根据能否引起细胞病变,可将BVDV 分为2种生物型:致细胞病变型(cytopathic CP)和非致细胞病变型(non-cytopathic, NCP),当NS2~3区域有外源序列的插入,基因重组、重排或缺失时,NCP型BVDV会转化为CP型BVDV[17,18]。本研究中将病毒连续传到40代时测序表明,虽然病毒既无外源序列插入,也无基因重组、重排或缺失,细胞形态观察也一致证明病毒未从NCP型转为CP型,但与亲代病毒相比,核苷酸的同源性为99.8%,氨基酸的同源性为99.6%,说明病毒在传代过程其基因组有变异。病毒的生长曲线结果显示,病毒在培养48 h达到复制高峰,48 h后进入平稳期,亲本和传代病毒均能在细胞中获得较高的病毒复制效率。病毒在传代过程中,病毒的基因组发生了一定的遗传变异,但是这些遗传变化并不能导致病毒在细胞上获得较高的病毒复制效率。病毒在细胞中的生长特性未变化,由此,我们获得的细胞适应毒株为研制猪源BVDV疫苗候选株奠定了物质储备,为下一步研究其致病性和抗原性奠定基础。
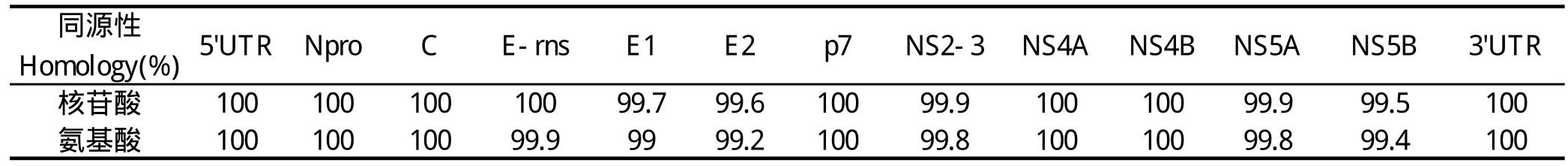
表2 SD0803 P40与亲代病毒核苷酸与氨基酸同源性比较Table 2 Nucleotide and amino acid homology between SD0803 P40 and parental virus
表3 SD0803 P40与亲代病毒ORF编码区氨基酸序列比较Table 3 Amino acid sequence comparison of ORF coding region between SD0803 P40 and parental virus
[1] Francki R I B, Fauquet C M, Knudson K L,et a1.Classification and nomenclat ure of viruses:fifth report of the international committee on Taxonomy of viruse[J].Arch Virol, 1991, sup 12:223-233.
[2] Heinz F X, Collett M S, Purcekk R H,et al.Family Flaviridae [M].//Fauquet C M, Mayo M, Maniloff J,Desselberger U, Ball LA(Eds), Virus Taxonomy: Eighth Report of the International Committee on Taxonomy of Virus.San Diego: Academic Press, 2004: 981-998.
[2] Remsey F K, Chivers W H.Mucosal disease of cattle [J].North Am Vet, 1953, 34:629-633.
[3] Perdrizet J A, Rebhun W C, Dubovi E J,et al.Bovine virus diarrhea-clinical syndromes in dairy herds[J].Cornell Vet,1987, 77(1): 46-74.
[4] Letellier C, de Meulemeester L, Lomba M,et al.Detection of BVDV persistently infected animals in Belgium:Evaluation of the strategy implemented [J].Prev Vet Med,2005, 72(1-2): 121-125.
[5] Kim I J, Hyun B H, Shin J H,et al.Identification of Bovine Viral Diarrhea Virus type 2 in Korean native goat (Capra hircus) [J].Virus Res, 2006, 121(1):103-106.
[6] Mishra N, Rajukumar K, Vilcek S,et al.Molecular characterization of bovine viral diarrhea virus type 2 isolate originating from a native Indian sheep(Ovies aries)[J].Vet Microbiol, 2008, 130(1-2): 88-98.
[7] Terpstra C, Wensvoort G.Natural infections of pigs with bovine viral diarrhea virus associated with signs resembling swine fever [J].Res Vet Sci, 1988, 45(2):137-142
[8] Paton D F, Done S H.Congenital infection of pigs with ruminant type pestiviruses [J].Comp Path, 1994, 111(2):15l-163.
[9] Matschullat G, Dahle J, Roder B,et a1.Field infection with BVD virus in swine: epidemiology and diagnosis [J].Dtsch Tierarztl Wochen schr, 1994, 10l(1): 22-26.
[10] Carbrey E A, Stew art W C, Kresse J I,et a1.Natural infection of pigs with bovine viral diarrhea virus and its differential diagnosis from hog cholera [J].JAVMA, 1976,169:1217-1219.
[11] Xu X, Zhang Q, Yu X,et al.Sequencing and comparative analysis of a pig bovine viral diarrhea virus genome [J].Virus Res, 2006, 122(1-2):164-170.
[12] Terpstra C.Wensvoort G.Bovine viral diarrhea virus infections in swine[J].Tijdschr Diergeneeskd, 1991,116:943-948.
[13] 王新平, 涂长春, 李红卫, 等.从疑似猪瘟病料中检出牛病毒性腹泻病毒[J].中国兽医学报, 1996, 16 (4): 341-345.
[14] 宋永峰, 张志, 张燕霞, 等.猪源牛病毒性腹泻病毒的流行初探[J].中国动物检疫, 2008, 25(7): 25-27.
[15] 邓宇, 孙春清, 张宏彪, 等.一株猪源牛病毒性腹泻病毒的分离与鉴定[J].畜牧兽医学报,2012, 43(3):416-423.
[16] Donis R O, Corapi W V, Dubiovi E J.Bovine viral diarrhea virus proteins and their antigenic analysis[J].Arch Virol, 1991, Suppl(3): 29-40.
[17] Brownlie J.Pathogenesis of mucosal disease and molecular aspects of bovine viral diarrhea virus [J].Vet Microbio1, 1990, 23(1-4): 371-382.
[18] Saperstein G.Effect of levamisoleon induced bovine viral diarrhea [J].JAVMA, 1983, 183: 425-427.

