胶原/羟基磷灰石一体化支架修复关节软骨缺损的机制研究
刘兴漠,项禹诚,潘滔,孙青,王德春,王迎军,吴刚
目前已有大量实验研究利用组织工程学技术修复关节软骨缺损,各种新型修复材料层出不穷,但在临床上仍不能利用此技术高质量地修复关节软骨缺损并达到很好的远期疗效[1-2]。这在很大程度上是因为具体的修复机制以及相应的理论尚不明确。在前期研究工作中,我们已证实胶原/羟基磷灰石骨一体化修复体具有良好的生物相容性,并且在动物体内诱导全层关节软骨缺损的修复[3]。本研究观察其在实验性兔膝骨关节全层软骨缺损修复中对基质金属蛋白酶(matrix metalloproteinases,MMPs)活化和表达的影响。
1 材料与方法
1.1 实验动物及器材 6~8周龄新西兰白兔45只,体重2.0~2.5 kg,雌雄不限,购于广东省医学实验动物中心。实验过程中动物处置符合动物伦理学标准。新型胶原/羟基磷灰石骨一体化修复体由华南理工大学材料科学与工程学院提供,为“双极”结构,体外实验证实材料完全降解时间为16周,环氧乙烷消毒备用。免疫组织化学试剂盒:武汉博士德生物工程有限公司;反转录-聚合酶链反应(RT-PCR)试剂盒:上海飞捷生物技术有限公司。
1.2 动物造模 实验动物随机分为3组,各15只。正常组不予处理,实验组与对照组分别用10%戊巴比妥钠10 mg/kg耳缘静脉麻醉,随机逐层切开一侧膝部皮肤至关节囊,将髌骨推向外侧,暴露关节腔,于股骨内外髁间制备全层软骨缺损,直径3.5 mm,深6 mm达髓腔,钻头配保护圈,防止钻孔过深;实验组植入大小、形状与缺损相似的新型胶原/羟基磷灰石骨一体化修复体,对照组不予修复体植入。髌骨回位,仔细止血,逐层闭合关节囊和皮肤。术后所有动物均肌注青霉素5×105U。膝关节不固定,置笼内自由活动。
1.3 RT-PCR检测 术后24 h、48 h、1周、2周和4周随机选取各组实验动物3只,按照1.2方法麻醉后切开术侧膝关节(正常组随机一侧),切除部分滑膜组织后逐层缝合切口并将动物放回笼内饲养。将取下的滑膜组织行ELISA测定MMPs mRNA的表达水平。按照试剂盒操作说明提取滑膜组织总RNA,紫外分光光度法(260/280 nm)测定MMPs RNA含量及纯度,-80℃储存备用。按照常规方法进RT-PCR实验。退火温度58℃,共32个循环。RT-PCR引物设计见表1。扩增完毕后8μl产物2%琼脂糖凝胶(含溴化乙啶)电泳,紫外摄像。以目的基因与内参基因条带的积分吸光度比值表示4个基因的表达水平。同一实验重复3次。

表1 RT-PCR引物设计
1.4 大体观察 术后1、2、4周分别静脉注射利多卡因处死每组动物各5只,取膝关节软骨,肉眼观察,采用Wakitani等改良的半定量组织学评分法[4]进行评分。
1.4.1 细胞形态 无透明软骨细胞:0分;透明软骨细胞为主:1分;纤维软骨细胞为主:2分;非软骨细胞为主:3分;全部非软骨细胞:4分。
1.4.2 基质染色 正染色:0分;轻度减弱:1分;明显减弱:2分;未着色:3分。
1.4.3 表面平整度 表面光滑:0分;表面较光滑:1分;表面不规则:2分;表面极不规则:3分。
1.4.4 新生软骨厚度 ≥正常2/3:0分;达正常软骨1/3~2/3:1分;<正常软骨1/3:2分。
1.4.5 与周围正常软骨组织整合 两边结合:0分;一边结合:1分;不结合:2分。
1.5 统计学分析 采用SPSS 13.0统计软件进行统计学分析。数据以(±s)表示,分别对各组检测结果的数据进行单因素方差检验。P<0.05为差异有统计学意义。
2 结果
2.1 大体观察 术后实验动物双膝活动少,至1周时活动增加,行走正常,手术切口愈合良好,均无感染。术后2周实验组缺损区由新生乳白色组织填充,表面平整,有光泽,与周围正常软骨界线模糊(图1a),而对照组缺损区无明显修复(图1b);术后4周实验组缺损区外观与周围正常软骨组织相似,不易辨别,切面可见修复组织与周围结合紧密(图1c),对照组缺损区由白色纤维组织填充,表面粗糙,与周边正常组织界线明显,切面可见修复组织不完全填充缺损区(图1d)。各时间点两组间Wakitani半定量组织学评分差异有统计学意义。见表2。
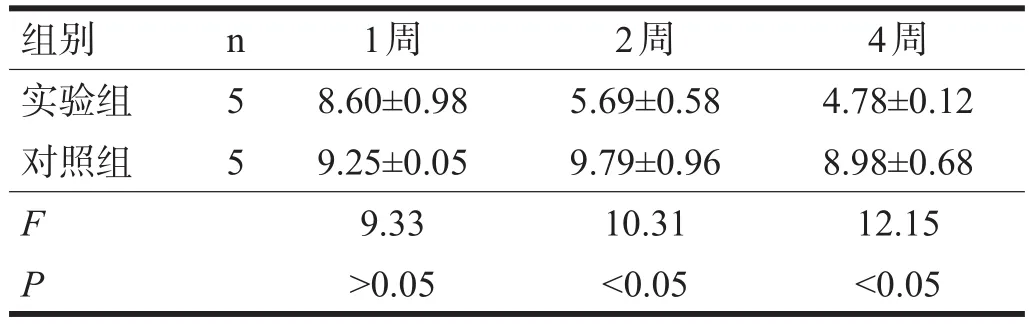
表2 术后不同时间点修复组织Wakitani半定量组织学评分
2.2 关节滑膜MMPs mRNA表达 3组关节中术前、术后均有MMP-2、MMP-3、MMP-9和MMP-13的表达。正常组4种MMPs绝对表达值极低,相对表达值维持恒定;实验组和对照组4种MMPs的表达水平在术后24 h达到峰值,并在4周内逐步下降。其中术后1周实验组和正常组MMP-2表达差异无统计学意义(P>0.05),术后48 h实验组和正常组MMP-3表达差异无统计学意义(P>0.05),术后1周实验组和正常组MMP-9表达差异无统计学意义(P>0.05),术前和术后4周实验组MMP-13表达差异有统计学意义(P<0.05),术后4周实验组和对照组MMP-2表达差异有统计学意义(P<0.05)。见表3。
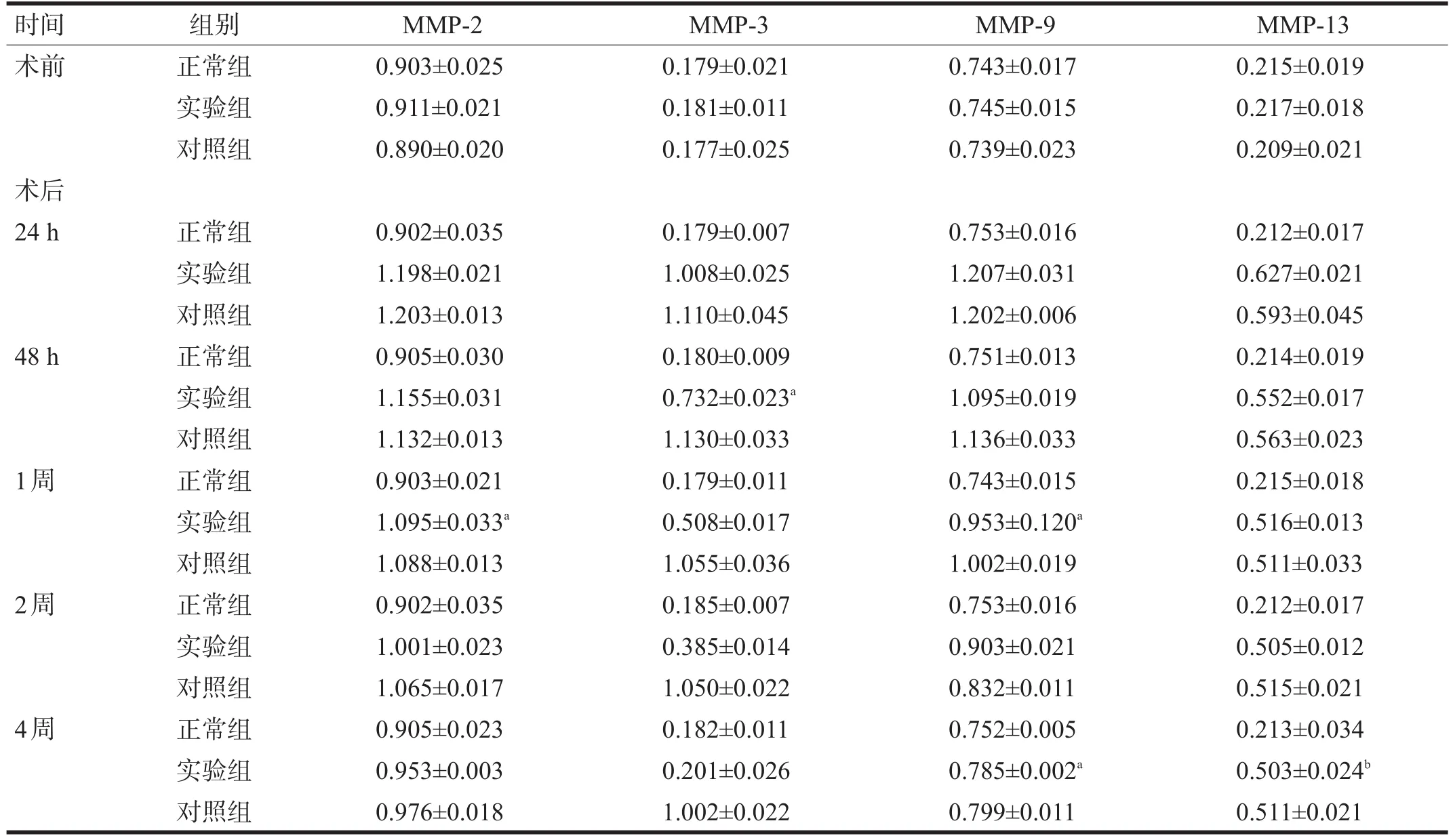
表3 不同时间点各组MMPs表达(n=3)
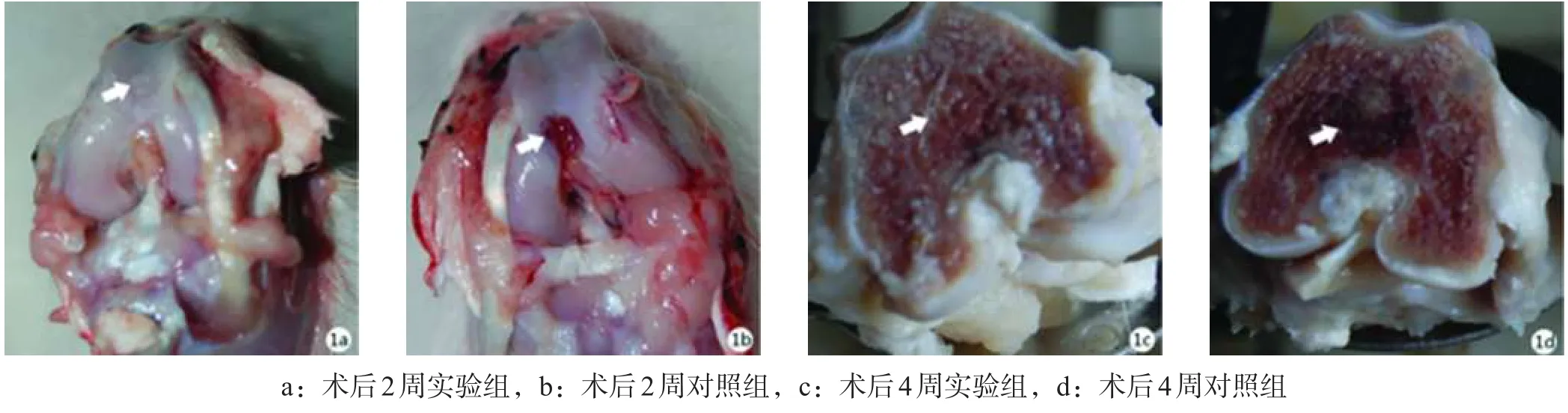
图1 术后不同时间点关节软骨修复结果
3 讨论
颜炜群等在国内首次将软骨细胞体外培养成软骨组织,推出了软骨组织工程新技术[5]。目前各种治疗软骨缺损的支架材料各有优缺点,但尚无完全理想的软骨组织工程支架材料,这是因为天然材料支架存在一定的免疫原性,与细胞复合后存在易发生收缩和碎裂、力学强度较差等不足和缺陷[6];另外,作为软骨细胞赖以生存的三维空间,理想的生物支架材料不仅必须具有良好的生物相容性,同时还必须为种子细胞提供合适的黏附、分化、增殖微环境。直接移植成熟软骨,其退行性变发生较早且严重[7]。
本实验采用的支架材料为“双极”结构,包括适于软骨细胞生长的修复体上层以及适合骨细胞生长的修复体下层。上层结构主体由经过改性的生物大分子组成,并复合具有缓释作用的促进软骨细胞生长的生长因子释放微球及其他生物活性成分;下层结构主体以高生物活性的纳米钙磷盐组成,同时复合相关的生长因子释放微球、部分天然大分子及其他生物活性成分。我们的前期研究已证实所采用的一体化修复材料无毒、无刺激性,具有良好的生物安全性,并能促进关节软骨和与之相联系的软骨下骨协同修复[3]。杨波等利用扫描电镜观察支架材料的超微结构时发现,新型胶原/羟基磷灰石骨支架材料的骨层和软骨层之间没有明显的物理界面,能确保植入体内后支架与软骨下骨组织快速结合及固定,提供软骨再生所需要的生理及力学环境[8]。
MMPs已知有26种,根据其蛋白结构和作用底物的特异性可以分为5个亚型,其中MMP-2、MMP-3、MMP-9和MMP-13的水解底物均为纤维类胶原,并且是MMPs级联激活途径中的关键MMPs[9]。
正常关节中MMPs与金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase,TIMPs)的表达量极低,由于各种理化因素的影响,MMPs与TIMPs之间的动态平衡被打破,导致关节软骨细胞外基质(extracellular matrix,ECM)过度降解。大量研究证实,MMPs的过度表达可导致软骨逐渐出现炎症、溃疡、缺损等一系列退行性变[10]。这提示我们,抑制MMPs的活化和表达可以延缓关节软骨退行性变的过程,为关节软骨缺损的修复提供良好的细胞生长微环境。
本实验表明,3组关节中术前、术后均有MMP-2、MMP-3、MMP-9和MMP-13的表达,但是各时间点正常组4种MMPs在关节软骨及滑膜中的绝对表达值几乎检测不到,其相对表达值(与GADPH比值)维持恒定。而在实验组和对照组的4种MMPs的表达水平在术后24 h即达到峰值,并在4周内逐步下降。其中实验组MMP-2、MMP-3和MMP-9分别在术后1周、术后48 h和术后1周的表达水平与对照组有显著性差异(P<0.05),这说明关节软骨缺损修复过程中,修复材料对各种MMPs亚型的活化和表达水平均有调节作用。
实验组MMP-13的表达水平在术前和术后4周有显著性差异(F=1.73,P=0.0059,n=3),这可能与MMP-13关节软骨的缺损和修复的病理生理过程中持续表达有关[9]。有研究表明,MMP-13不仅可以直接降解软骨基质中的纤维类胶原,而且其他MMPs亚型对Ⅱ型胶原的降解也需要通过MMP-13起作用[10]。
综上所述,新型胶原/羟基磷灰石一体化修复体能在软骨缺损修复过程中有效的抑制炎症因子的活化表达,减少ECM的破坏和降解,为软骨修复提供良好的细胞增殖分化环境。一体化修复体对MMPs以及其他细胞因子的具体调控机制有待进一步研究。
[1]van der Kraan PM,Buma P,van Kuppevelt T,et al.Interaction of chondrocytes,extracellular matrix and growth factors:relevance for articular cartilage tissue engineering[J].Osteoarthritis Cartilage,2008,10(8):631-637.
[2]Hulmes DJ,Marsden ME,Strachan RK,et al.Intra-articular hyaluronate in experimental rabbit osteoarthritis can prevent changes in cartilage proteoglycan content[J].Osteoarthritis Cartilage,2008,10(3):232-238.
[3]刘兴漠,项禹诚,麦海民,等.关节软骨-骨一体化修复体修复全层关节软骨缺损的实验研究[J].中华骨科杂志,2011,31(4):365-371.
[4]Wakitani S,Goto T,Young RG,et al.Repair of large full-thickness articular cartilage defects with allograft articular chondrocytes embedded in a collagen gel[J].Tissue Eng,1998,4:429-444.
[5]颜炜群,佟明华,宇丽,等.培养软骨细胞再形成生长板样软骨组织的研究[J].实验生物学报,1994,27(2):193-204.
[6]Drury JL,Mooney DJ.Hydrogels for tissue engineering:scaffold design variables and applications[J].Biomaterials,2008,24(24):4337-4351.
[7]Jordan DR,Brownstein S,Dorey M,et al.Fibrovascularization of porous polyethylene(Medpor)orbital implant in a rabbit model[J].Opthal Plast Reconstr Surg,2004,20(2):136-143.
[8]杨波,胡蕴玉,毕龙,等.胶原/羟基磷灰石骨软骨一体化支架的生物学特性研究[J].中国矫形外科杂志,2010,18(4):304-307.
[9]Wada Y,Shimada K,Sugimoto K,et al.Novel p38 mitogen-activated protein kinase inhibitor R2130823 protects cartilage by down-regulating matrix metalloproteinase-1,-13 and prostaglandin E2 production in human chondrocytes[J].Int Immunopharmacol,2009,6(2):144-155.
[10]Link DP,Strandberg JD,Virmani R,et al.Histopathologic appearance of arterial occlusions with hydrogel and polyvinyl alcohol embolic material in domestic swine[J].J Vasc Interv Radiol,1996,7(6):897-905.

